Revista Científica UDO Agrícola
Volumen 9. Número 3. Año 2009. Páginas: 563-570
Anatomía foliar comparada de materiales
geneticos in vitro de papa (Solanum tuberosum L.)
Compared foliar
anatomy of in vitro genetic materials
of potato (Solanum tuberosum L.)
José E. SALAS R.1,
María Elena SANABRIA CHOPITÉ ![]() 2, Dorian RODRÍGUEZ2,
Rosario VALERA2 y Yijan HIM DE FRÉITEZ2
2, Dorian RODRÍGUEZ2,
Rosario VALERA2 y Yijan HIM DE FRÉITEZ2
1Insituto Nacional de Investigaciones Agrícolas
(INIA-Mérida) y 2Universidad Centroccidental “Lisandro Alavarado”,
Decanato de Agronomía, Laboratorio de Microtecnia e Histopatología Vegetal.
Apartado 400. Tarabana, estado Lara, Venezuela.
E-mails: mesanabria@ucla.edu.ve, mesanabria@yahoo.com,
rdorian@ucla.edu.ve y rosariovalera@ucla.edu.ve ![]() Autor para correspondencia
Autor para correspondencia
|
Recibido:
29/01/2009 |
Fin de
primer arbitraje: 28/03/2009 |
Primera
revisión recibida: 03/08/2009 |
|
Fin de
segundo arbitraje: 05/10/2009 |
Segunda revisión recibida: 25/10/2009 |
Aceptado:
30/10/2009 |
RESUMEN
Se estudió la anatomía
de la lámina foliar de plantas in vitro
de los cultivares de papa (Solanum
tuberosum L.) 'Andinita', 'Caribay' y 'Tibisay', a fin de de establecer la
posible relación entre las características histológicas de este órgano y la
tolerancia de los materiales ante Phytophtora
infestans Montagne. Las muestras
se analizaron según las técnicas usuales de anatomía vegetal. A los datos obtenidos
se les realizó un análisis de varianza y comparación de medias por Tukey. Las
hojas son pilosas, anfistomáticas, bifaciales. Se observó variación en los
espesores de la pared externa de las células epidérmicas adaxiales, las cuales
resultaron ser mas largas que anchas en 'Andinita' (2,02 µm) y en la
abaxial, 'Tibisay' resultó con el mayor
valor para esta variable (1,9 µm). Se presentaron diferencias significativas
(P<0,01) entre los materiales en cuanto al espesor de la epidermis adaxial,
índice y densidad estomática. El espesor de la epidermis abaxial fue similar en
los tres cultivares. El espesor del mesofilo fue de 13,6 µm en 'Tibisay'; 13,3 µm en 'Andinita'
y de 12,3 µm en 'Caribay' y el largo de
las células del parénquima en empalizada fue de 6,0µm para 'Andinita'; 5,7 µm
para 'Tibisay' y 4,7 µm para 'Caribay'; el parénquima esponjoso fue de 7,9 µm;
7,6 µm y 7,4 µm en 'Tibisay', 'Andinita' y 'Caribay', respectivamente. En este último material, el ancho de la lámina foliar
fue 18,0 µm, seguida de 'Andinita' (17,8
µm) y 'Tibisay' (16,3 µm). Los tricomas se clasificaron como glandulares y
eglandulares. La presencia de apéndices epidérmicos en ambas superficies y un
mayor valor de densidad estomática en la abaxial podrían funcionar como las
barreras físicas para la entrada del patógeno a la hoja.
Palabras
clave: Solanum, anatomía vegetal, densidad e índice estomático,
Solanaceae.
ABSTRACT
The anatomy of the leaves of in
vitro grown plants of the cultivars of potato (Solanum tuberosum L.) 'Andinita', 'Tibisay' and 'Caribay' was
studied in order to establish the possible relationship between the
histological characters of this organ and the tolerance of the materials to Phytophthora infestans Montagne. Samples
were analyzed following standard plant anatomical techniques. The data obtained
were evaluated by an analysis of variance and means compared by Tukey test.
Leaves were pubescent, amphistomatic, and bi-phacial. Variation in the
thickness of the outer wall of the adaxial epidermal cells was observed, which
were longer than wide in 'Andinita' (2.02 µm), whereas in the abaxial,
'Tibisay' had the highest value for this variable (1.9 µm). Significant
differences (P ≤ 0.01) were found among cultivars with regard to the
thickness of the adaxial epidermis, and stomatic and density indexes. Abaxial
epidermis thickness was similar in all three cultivars. Mesophyll thickness was
13.6 µm in 'Tibisay', 13.3 µm in 'Andinita' and 12.3 µm in 'Caribay'. The
length of the palisade parenchyma cells was 6.0 µm for ' Andinita ', 5.7 µm
for' Tibisay ' and 4.7 µm for' Caribay '. The spongy parenchyma was of 7.9 µm,
7.6 µm and 7.4 µm in' Tibisay ',' Andinita 'y' Caribay ', respectively. In the
latter material, leaf width was 18.0 µm, followed by 'Andinita' (17.8 µm) and 'Tibisay'
(16.3 µm). Trichomes were classified as glandular and non-glandular. The
presence of epidermal appendices on both surfaces and a higher value of
stomatal density on the abaxial one could function as physical barriers to
control the entry of the pathogen to the leaf.
Key words: Solanum, plant anatomy,
stomatal index and density, Solanaceae.
INTRODUCCIÓN
De todos los órganos de la planta, la hoja es la más sensible en
responder a las condiciones del ambiente. Por ello, en este órgano se reflejan
muchas alteraciones morfológicas y anatómicas ocasionadas como consecuencia del
estrés, al producirse cambios en la síntesis de proteínas, de la pared celular,
del espesor de la cutícula y la conductancia estomática (Trewavas, 2003).
La presencia de barreras mecánicas en los órganos de los vegetales
tales como el espesor, cantidad y calidad de la cera de la cutícula y el grosor
de los tejidos epidérmicos dificultan el contacto o entrada de agentes
patógenos (Anderson y Albersheim, 1975). Por otra parte existen rasgos de la
anatomía foliar que pueden actuar como barreras físicas que controlan la
entrada del agente patógeno en la hoja, tales como espesor de la cutícula,
desarrollo de las capas cuticulares, espesor de la epidermis, densidad
estomática, grado de desarrollo del aerénquima en el parénquima esponjoso,
presencia de apéndices epidérmicos, entre otros (Valerio et al., 2002; Agrios, 2005). En el caso de algunas variedades de Musa sp. la resistencia a enfermedades,
tales como sigatoka negra y amarilla, está relacionada con los mecanismos
fitoquímicos, como la acumulación de fenoles y las reacciones de
incompatibilidad del hongo (Micophaerella
fijiensis Morellet) en el apoplasma del huésped y que se desarrollan una
vez que el hongo penetra por los estomas.
Agrios (2005) sugirió dos tipos de resistencia
ante el ataque de patógenos en los vegetales, una controlada por unos cuantos
“genes mayores” que es fuerte y específica para cada uno (resistencia vertical) y la otra
determinada por “los menores”, débil pero eficaz contra todas las razas
de una misma especie de patógeno (resistencia horizontal). Las estructuras y
sustancias de las células vegetales constituyen el medio por el cual se piensa que
estos genes confieren resistencia a las enfermedades de las plantas. La
mayoría de los hongos y bacterias penetran a
los órganos a través de los
estomas, hidatodos, nectarios y lenticelas. Algunas defensas estructurales se
encuentran en las plantas antes de que el patógeno entre en contacto con éstas,
y entre ellas se incluye cantidad y calidad de ceras y de la cutícula que cubre
a las células epidérmicas, estructura de la pared celular, tamaño, localización
y forma de los estomas, la presencia de
tejidos protegidos por paredes celulares gruesas que obstaculizan el avance del
patógeno.
Las hojas de las especies de Solanaceae son bifaciales, anfistomáticas
y con ambas epidermis uniestratificadas (Cutter, 1978). Las epidermis presentan
células con paredes celulares sinuosas en vista superficial (Salas et al., 2007) y variables en cuanto a
forma y tamaño (Granada y Benítez, 2004). García y Torres (1997) describieron caracteres
similares en Physalis pubescens L. y P. peruviana L., cultivadas in vivo. Ehleringer y Money (1978)
describieron la epidermis de Solanum
lycocarpum St. Hill. y
mencionaron estomas localizados al mismo nivel de las demás células
epidérmicas, con las células anexas ligeramente hundidas, por debajo del nivel
de las oclusivas y cámaras estomáticas, generalmente pequeñas. Finalmente Granada y Benítez (2004) describieron en Solanum agrarium
Sendtn las células epidérmicas típicas como grandes y
redondeadas, de tamaño desigual en ambas caras, rectangulares o redondeadas en Solanum
capsicoides All.
Granada
y Benítez (2004) determinaron que el índice estomático resultó ligeramente
diferente dentro de una misma especie, cuando se calculó en distintos
materiales de Solanum; según estos
mismos autores, puede deberse a que
éste tenga una variación definida dentro de un determinado rango, condicionado
por la superficie de la lámina que se considere y los factores ambientales.
Estos resultados coinciden con los obtenidos por Salas et al. (2007) cuyos
valores de índice estomático en el cv Granola de Solanum tuberosum fueron de
5,46 para la superficie adaxial y de 20,0 para la abaxial.
Liscovsky y Cosa (2005) clasificaron los tricomas de Cestrum (Solanaceae) de Argentina como
eglandulares, simples o ramificados y glandulares con cabezuela unicelular o
bicelular. Salas et al. (2007)
describieron para plantas in vitro del cv. Granola, tricomas simples,
unicelulares o pluricelulares, los que se correspondían con los eglandulares
descritos por Liscovsky y Cosa (2005) y glandulares, es decir diferentes tipos tricomáticos, lo que coincidió con lo
observado en especies de Physalis por
García y Torres (1997). Granada y Benítez de Rojas (2004) señalaron además los
estrellados en la superficie abaxial de las hojas de Solanum acerifolium Dun., estructuras éstas que según Ehleringer y Mooney (1978) representan una adaptación morfológica que favorece
la asimilación del CO2, promueven la reducción de la temperatura
foliar en períodos de elevada temperatura ambiental y poca disponibilidad de
agua y protege a las láminas foliares contra el ataque de patógenos.
Salas et al. (2007) describieron los estomas de Solanum tuberosum cv. Granola como paracítico y anomocítico, en ambas superficies de la
lámina foliar y señalaron que predominaban los paracíticos y se distribuyen en
forma irregular. Benítez y Ferratoto (1997) describieron algo similar en
especies de Cestrum propagadas por
métodos convencionales. Ambos tipos estomáticos han sido señalados como típicos
de Solanaceae (Bonas y Lajaye, 2002). El índice estomático citado para el cv
Granola fue de 5,46 para el epifilo y de 20 para el hipofilo (Salas et al. 2007) y según Granada
y Benítez (2004) las hojas son
hipostomáticas, muy rara vez anfistomáticas.
Salas et al. (2007)
estudiaron las hojas del cv Granola en sección transversal y encontraron una
epidermis adaxial con células cutinizadas de contorno poligonal, y consideraron
la lámina como bifacial, un tipo frecuente de organización de mesofilo común en
la familia. El clorénquima fue descrito como constituido por una capa de tejido
en empalizada y por dos a tres capas de parénquima esponjoso, con células de
paredes delgadas y separadas por espacios intercelulares. Estos autores
destacaron que la cutícula de la epidermis abaxial presentaba menor espesor que
la adaxial y sus células eran más pequeñas y señalaron que ese cultivar tenía
diferencias anatómicas marcadas con respecto a otros cultivares de Solanum tuberosum y a otros géneros de
Solanaceae.
Los cultivares de Solanum
tuberosum, Andinita, Caribay y Tibisay, son señalados en la literatura como
tolerantes al tizón tardío ocasionado por Phytophtora
infestans. Entre los caracteres anatómicos foliares de interés
fitopatológico que permiten establecer una relación entre estas características
y el comportamiento de materiales vegetales ante el ataque de patógenos,
causante de enfermedades en las hojas de los cultivos se mencionaron, el grosor
de la cutícula de la epidermis, el índice estomático y el desarrollo del
mesofilo (Bonas y Lajaye, 2002; Camacho de Torres y Subero, 1991).
Por lo que antecede, esta investigación se planteó como objetivo el
estudio de la anatomía de la hoja de plantas in vitro de los cultivares de papa (Solanum tuberosum) Andinita,
Caribay y Tibisay con el fin de establecer la posible relación entre las
características estructurales de este órgano y la tolerancia al ataque del
hongo Phytophtora infestans, causante
de la enfermedad conocida como tizón tardío.
MATERIALES Y MÉTODOS
Las plantas in vitro de los cultivares Andinita,
Caribay y Tibisay (S. tuberosum subespecie andigena) provenientes del Centro Internacional de
![]()
NE es el número de estomas por
campo de observación y CE es el número de células epidérmicas típicas en el
campo de observación.
Para la preparación de las
secciones transversales foliares se realizaron preparaciones semipermanentes;
se efectuaron secciones a mano alzada que se colorearon con fast-green
alcohólico al 0,1% (Martín et al.,
2006), se lavaron con agua destilada, se montaron con agua:glicerina (1:1) y se
sellaron con esmalte para uñas transparente (Roth, 1964). Se realizó una
descripción detallada de la distribución de los tejidos y se determinó el ancho
y la longitud de las células epidérmicas adaxiales y abaxiales; el grosor de
la cutícula más la pared externa de las
células epidérmicas abaxiales y adaxiales y el espesor total de la lámina.
Para la descripción anatómica
y la determinación de los valores se usaron 32
hojas, provenientes de 8 individuos, cuyas secciones se observaron en 10
campos del MO. Se calculó varianza y se efectuaron comparaciones de medias
según la prueba de Tukey. Para el análisis estadístico se utilizó el Programa
Statistix (Versión 8).
RESULTADOS Y
DISCUSIÓN
La histología de los tercios
medios foliares de los cultivares de Solanum
tuberosum, Andinita, Caribay y
Tibisay fue
similar y coincidió con lo observado para
otras especies de Solanaceae (Cutter, 1978; Metcalfe y Chalk, 1979); para los
cultivares Granola (S.
tuberosum subespecie tuberosum); Idiafrit, María Bonita y los
clones E86-011, I-931, 390663-8, E86695, I-1062 y E-86604 (S. tuberosum sub especie andigena) (Salas et al.,
2003; Salas et al., 2007).
Las láminas foliares de los cultivares de papa incluidos en esta
investigación son bifaciales y anfistomáticas y los tejidos vasculares se
disponen en haces colaterales, algo común en Solanaceae (Metcalfe y Chalk,
1979, Granada y Benítez, 2004, Liscovsky y Cosa, 2005), Salas et al. (2003) y Salas et al. (2007),
también observaron estas características en otros género de Solanaceae; en los cultivares Granola,
Idiafrit, María Bonita y los clones E86-011, I-931, 390663-8, E86695, I-1062 y
E-86604.
En los haces vasculares de las
hojas de los cultivares Andinita, Caribay
y Tibisay no se observaron las vainas transcurrentes rodeando a
los haces vasculares descritas para algunas especies de Solanum por Granada y Benítez
(2004) y que según estos autores están asociadas con la capacidad de la
hoja para evitar en mayor o menor grado el colapso del mesofilo ante una
eventual disminución de la turgencia, en condiciones de déficit hídrico, como
el que experimentan las plantas en ambientes secos o en condiciones de sequía.
Esta diferencia podría deberse al hecho de que este estudio se realizó con
vitroplantas, por lo tanto las condiciones del cultivo son distintas a las
planteadas por estos autores.
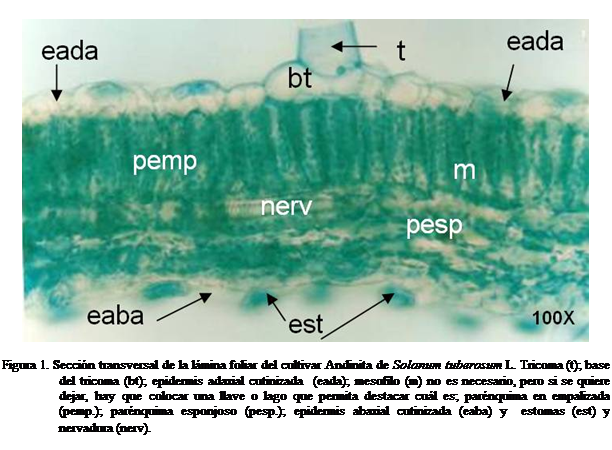
En la sección transversal la hoja presentó una epidermis adaxial uniestratificada, con las
paredes externas cutinizadas y células aproximadamente cuadrangulares. El
mesofilo está diferenciado en un estrato de células parenquimáticas en
empalizada y de dos a tres de células de parénquima esponjoso, ambos con las
células de paredes delgadas. La epidermis abaxial y adaxial son similares
(Cutter, 1978; Salas et al., 2003;
Salas et al., 2007) (Figura 1).
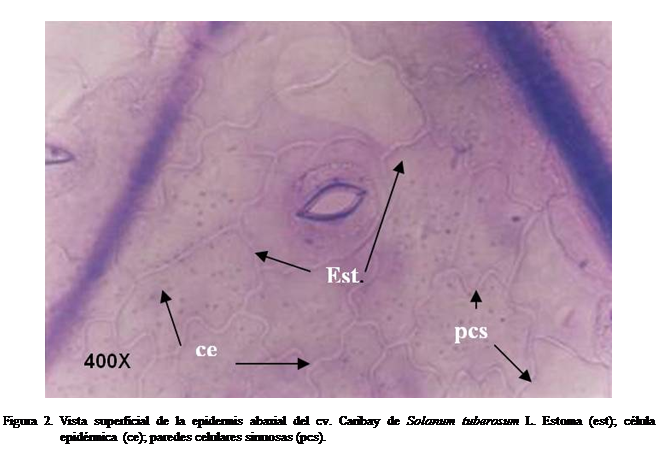
En esta investigación, las paredes de las células epidérmicas en vista
superficial, se presentaron desiguales en cuanto a forma y tamaño y con las
paredes sinuosas, con ondas curvas y angulosas. Caracteres similares se
observaron en Physalis pubescens y P. peruviana, cultivadas in vivo por García y Torres (1997) y
Granada y Benítez (2004). No se observó la hipodermis ni tejido
esclerenquimático, como los descritos en la lámina foliar de Solanum lycocarpum, una especie cuya
epidermis tiene células más sinuosas en el epifilo (Elias et al., 2003) (Figura 2).
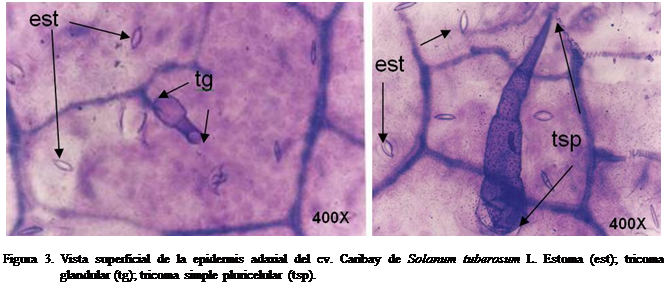
Los tricomas observados en la lámina foliar de los cultivares Andinita, Caribay y Tibisay fueron clasificados como
glandulares y eglandulares. Los primeros presentan un pie 1-celular y una
cabezuela ovoide también 1-celular, o bien un pie 2-celular y cabezuela globosa
4-6-celular, tectores, rectos o recurvados. Los segundos son simples 1-celulares
o pluricelulares, uniseriados. Estos mismos tipos de tricomas fueron descritos
en las investigaciones relacionadas con la anatomía foliar de Solanum por Cutter (1978) y Elias et al. (2003); en Physalis
por García y Torres (1997); en Cestrum
por Benítez y Ferratoto (1997); en los cultivares Granola, Idiafrit,
María Bonita y los clones E86-011, I-931, 390663-8, E86695, I-1062 y E-86604 por Salas et al.
(2003) y Salas et al. (2007). Sin
embargo, no se presentaron los estrellados (eglandulares, ramificados)
descritos por Elias et al. (2003) en
las plantas in vitro de Solanum. Se podría inferir que estas
estructuras se presentan en las siguientes etapas de desarrollo de las plantas (Dangl y Jones, 2001;
Fornoni et al., 2004) (Figura 3).
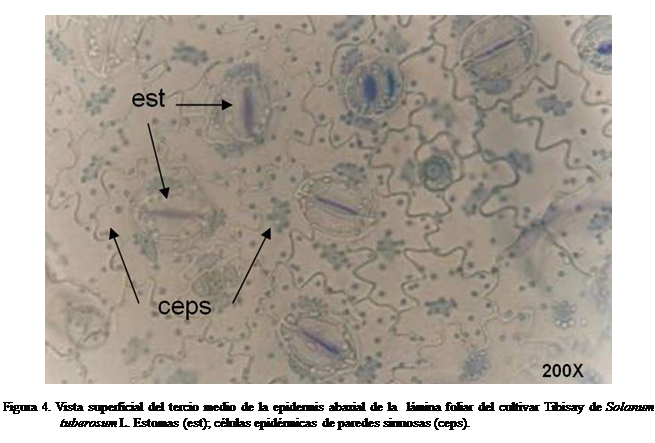
En los
cultivares Idiafrit, María Bonita y los clones E86-011, I-931, 390663-8,
E86695, I-1062 y E-86604, solamente fueron paracíticos (Salas et al., 2007). En 'Granola', 'Andinita', 'Caribay' y 'Tibisay' fueron paracíticos y
anomocíticos, sin la predominacia del primer tipo mencionado. Los estomas tienen células oclusivas orientadas de
forma variada con respecto a las nervaduras de la lámina foliar. De esta forma
fue descrito también para Cestrum (Solanceaea) por Benítez y Ferratoto (1997)
(Figura 4).
Los valores obtenidos en la
determinación del espesor de la cutícula más la pared externa de las células
epidérmicas adaxiales y abaxiales; largo de las células epidérmicas adaxiales y
abaxiales; el ancho de las células epidérmicas adaxiales y abaxiales en los
tercios medios de las láminas foliares de los cultivares obtenidos en este
estudio se muestran en el Cuadro 1.
|
Cuadro 1. Grosor de la cutícula + la pared
externa de las células epidérmicas adaxiales y abaxiales (Gc+pceada y
Gc+pceaba); largo de las células epidérmicas adaxiales y abaxiales (lcepada y
lceaba); ancho de las células epidérmicas adaxiales y abaxiales (acepada y
acepaba) en los tercios medios de las láminas foliares de los cultivares
Andinita, Caribay y Tibisay de papa (Solanum
tuberosum L.). Unidades micras (µm). |
||||||
|
Cultivares |
Gc+pcead |
Gc+peceaba |
lceada |
lceaba |
aceada |
aceaba |
|
Andinita |
0,37 a |
|
|
|
1,65 b |
|
|
Carbay |
|
|
|
|
1,79 b |
|
|
Tibisay |
|
|
|
|
|
|
|
Significación |
ns |
ns |
ns |
ns |
** |
ns |
|
C. V. (%) |
38,73 |
37,08 |
18,32 |
24,43 |
17,60 |
25,69 |
|
** Altamente significativo (p ≤ 0,01); ns : No Significativo (p
> 0,05). C. V. : Coeficiente de
variación † Letras diferentes indican promedios estadísticamente diferentes
según Prueba de Tukey (p ≤ 0,05) |
||||||
Se presentaron diferencias significativas
(p ≤ 0,05) entre los materiales con respecto al ancho de las células epidérmicas
adaxiales, las más anchas en Tibisay
(2,61µm), algo menos anchas en Caribay (1,79 µm) y las de menor ancho en Andinita (1,65 µm). Lo contrario se presentó en la superficie abaxial, donde en este
último cultivar se observó una tendencia a que el ancho de las células
epidérmicas abaxiales fuera mayor (1,88 µm) si se les compara con las de
Caribay (1,65 µm) y Tibisay (1,83 µm). Los valores de espesor de la cutícula más la pared
externa de la epidermis adaxial fueron similares (0,37 µm) para los tres
materiales. Respecto a la superficie abaxial, 'Andinita' presentó el mayor
espesor (0,413 µm), seguida por 'Tibisay' (0,367 µm) y en esta última también
se presentaron los mayores valores de ancho de la lámina foliar (18,01 µm)
(Cuadros 1 y 2). Se podría pensar que la presencia de células epidérmicas y
láminas foliares más gruesas, deberían ejercer algún efecto sobre el factor de
resistencia estructural de las plantas, considerando que la línea de defensa de
los vegetales para el ataque del patógeno es la epidermis (Anderson y
Albersheim, 1975; Agrios, 2005).
|
Cuadro 2. Largo del mesofilo (lm), número de capas de células del mesófilo (nccm); largo del parénquima
en empalizada (lpemp); largo del parénquima esponjoso (lpesp.) y ancho de la
lámina foliar en sección transversal (alf) en los tercios medios de las
láminas foliares de los cultivares Andinita, Caribay y Tibisay de papa (Solanum
tuberosum L.). Unidades micras (µm). |
|||||
|
Cultivares |
lm |
nccm |
lpesp |
lpem |
alf |
|
Andinita |
13,34 ab |
|
|
|
17,74 ab |
|
Carbay |
12,28 b |
|
|
4,68 b |
16,27 b |
|
Tibisay |
|
|
|
5,73 ab |
|
|
Significación |
* |
ns |
ns |
* |
* |
|
5,49 |
6,67 |
7,06 |
12,89 |
6,07 |
|
|
* Significativo (p ≤ 0,05); ns :
No Significativo (p > 0,05). C. V.
: Coeficiente de variación † Letras diferentes indican promedios
estadísticamente diferentes según Prueba de Tukey (p ≤ 0,05) |
|||||
Se presentaron diferencias altamente significativas (p ≤ 0,01)
para el índice y la densidad estomática. Estos valores variaron entre las
superficies foliares y entre los materiales (Cuadro 3) lo que coincide con lo
señalado por Salas et al. (2003)
para el
cv. ´Granola` y para los cvs. Idiafrity María Bonita;
resistente y medianamente tolerantes a Phytophtora infestans y los clones E86-011; I-931,
390663-8, E86695, I-1062 y E-86604 (Salas et
al., 2007). Los valores del índice y
la densidad estomática representan adaptaciones que favorecen los procesos
fisiológicos de las plantas y las protegen contra el ataque de los patógenos
(Dangl y Jones, 2001).
|
Cuadro 3. Indice estomático
(IE) y |
||||
|
Cultivares |
IEABAX |
IEADAX |
DEADAX |
DEABAX |
|
Andinita |
36,2 c |
17,7 a |
33,6 a |
131,5 a |
|
Caribay |
40,7 b |
12,7 b |
17,0 b |
114,5 b |
|
Tibisay |
44,9 a |
17,5 a |
31,1 a |
131,7 a |
|
Significación |
** |
** |
** |
** |
|
C. V. (%) |
8,2 |
18,9 |
24,4 |
8,9 |
|
* Altamente Significativo (p ≤ 0,01) C. V. : Coeficiente de variación † Letras diferentes indican promedios estadísticamente diferentes
según Prueba de Tukey (p ≤ 0,05) |
||||
CONCLUSIONES
En los cultivares de Solanum
tuberosum Andinita. Caribay y Tibisay tolerantes a Phytophtora infestans, se sugiere que el escaso desarrollo de las cutículas
en las paredes celulares engrosadas de la epidermis es compensado fisiológicamente
con la formación de cubiertas pilosas y un mayor número de estomas en la
superficie abaxial.
La presencia de apéndices epidérmicos en ambas superficies y un mayor
valor de densidad estomática en la abaxial podrían funcionar como las barreras
físicas para el control de la entrada del patógeno a la hoja.
RECOMENDACIONES
La tolerancia de los cultivares de Solanum
tuberosum L., Andinita, Caribay y Tibisay a Phytophtora
infestans
podría estar asociada a factores o
mecanismos de tipo bioquímico, por lo que se recomienda su estudio en este
sentido, en plantas obtenidas in vitro,
en fase de aclimatación y campo.
LITERATURA
CITADA
Agrios, N. 2005.
Fitopatología. Traducción del inglés por Manuel Guzmán Ortiz. Limusa. México. 756
pp.
Anderson, A. and P. Albersheim. 1975. Host pathogen interaction. Plant Phisiology. 56: 286-291.
Benítez de Rojas, C. y M. Ferratoto. 1997. Arquitectura foliar de tres
especies de Cestrum
(Solanaceae-Cestreae) de Venezuela. Anales de Botánica Agrícola 4: 5-10.
Bessus, J. and M. Guyot. 1979. An attempt to use stomatal characteres in systematic
and philogenetic studies of Solanaceae. pp.321-326. In: Hawkes. J.R. Lester
y A. Skelding (Eds.) The biology and taxonomy of the Solanaceae. Linn. Soc.
Symp. Ser. 7 Academic Press. London.
Bonas, U. and T. Lahaye. 2002. Plant disease resistance triggered by
pathogen-derived molecules: refined models of specific recognition. Current Opinion Microbiology 5: 44-50.
Camacho de Torres, E. y L. Subero. 1991. Características anatómicas
foliares de interés fitopatológico en tres cultivares de maní (Arachis hypogaea L.). Biollania 3: 11.
Cutter, E. 1978. Structure and development of potato plant. pp. 70-152. In: The potato crop (ed.) P.N.H. Harris.
Chapman and Hall. London.730p.
Dangl, J. and J. Jones. 2001. Plant pathogens and integrated defence
responses to infection. Nature 411: 826-833.
Ehleringer, J. and H. Mooney. 1978. Leaf hairs: effect on physiological
activity and adaptive value to a desert shrub. Oecologia
37:183-200.
Elias, S.; R. Assis, E. Stacciarini Seraphin y M. Rezende. 2003. Anatomía
foliar en plantas jóvenes de Solanum lycocarpum A.St.-Hil. (Solanaceae) Brasil. Bot. 26
(2): 169-174.
Fornoni, J.; J. Núñez Farfán, P. Valverde and M. Rausher. 2004. Evolution
of mixed strategies of plant defense allocation against natural enemies. Evolution 58: 1685-1695.
García, M. y F. de Torres. 1997. Anatomía foliar
de cuatro especies del género Physalis
(Solanaceae). Anales de Botánica Agrícola 4: 23-32.
Granada, W. y C. Benítez de Rojas. 2004. Anatomía
foliar de cuatro especies de Solanum L. seccion Acanthophora Dunal
en Venezuela. Acta Científica Venezolana 55: 13-26.
Liscovsky, I. y M. Cosa. 2005. Anatomía
comparativa de la hoja y tallo en los representantes de Cetreae g. Don
(Solancaeae) de Argentina. Gayana Bot. 61 (2): 36-42.
Martín, M.; J. Pastor y R. Juan. 2006. Observaciones morfológicas y anatómicas en
núculas de Rosmarinus L. (Lamiaceae)
en el suroeste de España. Lagascalia 26: 111- 117.
Metcalfe, C. and L. Chalk. 1979. Anatomy of dicotyledons. 2nd ed. v.1. Clarendon Press.
Oxford. 581p.
Murashige, T. y F. Skoog.
Roth, I. 1964. Microtecnia vegetal. Ediciones de
Salas, J. E.; N. Mogollón y M. E. Sanabria.
2003. Anatomía de estructuras
vegetativas y origen de los estolones, microtubérculos y raíces adventicias en
plantas in vitro de papa (Solanum
tuberosum L.) cv. Granola. Rev. Fac. Agron. 20 (2): 131-143.
Salas. J. E.; M. E. Sanabria, D. Ulacio, D. Rodríguez y R. Valera. 2007.
Anatomía foliar de materiales genéticos de papa (Solanum tuberosum L.) in
vitro. Memorias del XVII Congreso Venezolano de Botánica. Maracaibo, edo.
Zulia del 20-25 de Mayo.
Torres, J.; L. Laskowski y M. E. Sanabria. 2006. Efecto del ambiente de
desarrollo sobre la anatomía de la epidermis foliar de Cattleya jenmanii Rolfe. BIOAGRO 18 (2):
93-99.
Trewavas, A. 2003. Aspects of plant intelligence. Annals of Botany 92:
1-20.
Valerio, R.; H. Lindorf y E. García. 2002. Relación entre la anatomía
foliar de variedades de Musa sp. y su
comportamiento frente a
Wilkinson, R. 1979. The plant surface (mainly leaf). In C.R. Metcalfe y Chalk (eds.) Anatomy of
dicotyledons. 2da edition. Oxford. Claredon Press.1:97-165.
Página diseñada por Prof. Jesús Rafael Méndez Natera
TABLA DE CONTENIDO DE LA REVISTA CIENTÍFICA UDO
AGRÍCOLA



