Revista Científica UDO Agrícola
Volumen 9. Número 3. Año 2009. Páginas: 547-555
Regeneración
in vitro de Heliconia psittacorum, variedad choconiana, usando el sistema de sección transversal delgada "Tcls" (thin cells layer)
In vitro regeneration of Heliconia psittacorum, choconiana variety using thin cell layer (Tcls) culture system.
Andrés
Julián MENESES GUZMÁN ![]() 1, Nelson ROJAS MARTÍNEZ 1
y Lucia ATEHORTÚA GARCÉS2
1, Nelson ROJAS MARTÍNEZ 1
y Lucia ATEHORTÚA GARCÉS2
1Universidad
del Cauca. Laboratorio de Investigación en Biología Celular y Molecular,
Facultad de Ciencias Naturales, Exactas y de la Educación, Ciudad Universitaria
Popayán, sector Tulcán, Colombia y 2Universidad
de Antioquia. Laboratorio de
Biotecnología. Facultad de Ciencias Naturales y Exactas, Ciudad
Universitaria, calle 67 N° 53-108, Medellín, Colombia. E-mails: ajmeneses@unicauca.edu.co,
julianm419@hotmail.com, bionelron@gmail.com, latehor@yahoo.es y
latehor@gmail.com ![]() Autor para correspondencia
Autor para correspondencia
|
Recibido:
10/04/2009 |
Fin de
primer arbitraje: 12/07/2009 |
Primera
revisión recibida: 13/08/2009 |
|
Fin de
segundo arbitraje: 23/09/2009 |
Segunda revisión recibida: 11/10/2009 |
Aceptado:
18/10/2009 |
RESUMEN
Las heliconias son
especies de gran demanda en el mercado de flores de corte. Esto despierta el
interés en las investigaciones de propagación vegetativa rápida, vigorosa y a
grandes escalas siendo la micropropagación una alternativa. Además las plantas
propagadas mantienen ciertas
características de interés satisfaciendo así las exigencias de los productores.
El sistema de sección transversal
delgada "TCLs"
(Thin Cells Layer) es una herramienta importante en el cultivo in vitro de las plantas, debido a que se
requiere muy poco material para el proceso y se puede obtener gran cantidad de
germoplasma, en este sentido, se establecieron
las condiciones apropiadas para la propagación in vitro de la Heliconia psittacorum var. choconiana, mediante este
sistema; las secciones transversales delgadas de (1 mm ) de grosor se obtuvieron
del pseudotallo de esta especie y fueron
cultivadas con una respuesta óptima, en
el medio Murashige y Skoog
(MS, 1962), enriquecido con tiamina 1 mg L-1, piridoxina
1 mg L-1, acido nicotínico 1 mg L-1, Myoinositol
100 mg L-1, carbón activado 0,5 g L-1, 2,4-D 1 mg L-1;
BAP 1 mg L-1; Caseína hidrolizada 1 g L-1 y como agente gelificante Gelrite 1 g L-1. Las condiciones de
cultivo fueron a una temperatura de 25 ±
1 °C y 16 h luz, diariamente. Resultando finalmente la
inducción de organogénesis directa que permitió obtener microplántulas
vigorosas de heliconia, después de once semanas de cultivo. Concluyendo que la técnica de sección
transversal delgada, es una buena
herramienta para cultivar secciones de rizoma.
Palabras clave: Heliconia,
organogénesis directa, TCLs, pseudotallo, cortes
transversales, micropropagación.
ABSTRACT
Heliconias are
species with big goals in cut flowers market. It arouses interest in research
about vigorous, fast and big scale of vegetative propagation, in that way micropropagation could be an option. Moreover plants
propagated maintain several characteristic of interest to satisfy the
exigencies of producers. Cross section system or thin cells layer “TCLs” is an
important tool for in vitro plant
culture, due to few vegetative materials that is required for the process and
it is possible to obtain big quantity of germoplasm.
In this way, were established the appropriated conditions for in vitro propagation of in Heliconia psittacorum choconiana
variety, through this system; Thin cross sections of
Key words: Heliconia,
direct organogenesis, TCLs, pseudosteam, cross
sections, micropropagation.
Abreviaturas: MS= Murashige y Skoog; 2,4-D= acido 2,4 diclorofenoxiacetico;
BAP= Benzilaminopurina
INTRODUCCIÓN
Entre los grupos taxonómicos más
ampliamente representados en los trópicos se encuentra la familia Heliconiaceae, constituida por el género Heliconia con cerca de 220 especies
taxonómicamente descritas y cuyo centro de diversidad se encuentra en Colombia
con más de 98 especies, de las cuales 48 se han descrito como endémicas de este
país (Berry y Kress, 1991; Kress, et al.,
1999).
Actualmente los mercados internacionales
tienen una gran demanda de plantas ornamentales tropicales, entre las que se
encuentran las heliconias, que se consideran como plantas exóticas (Berry y Kress,
1991; Kress et al,
1999). La demanda de este tipo
de plantas ornamentales se ha
incrementado notablemente, tanto a nivel nacional como internacional, y sin
lugar a dudas, hoy en día su cultivo se ha convertido en un factor de
importancia en la economía agrícola de muchos países (Prevatt y Harbauch, 1985).
Un aspecto relevante de las heliconias, es que pueden ser utilizadas tanto para
el ornato de parques y jardines, como flores de corte, así como cultivos con
miras a la producción de semillas certificadas con fines de exportación (Clay y Hubbard, 1987).
Adicionalmente, son varias las especies de heliconias que actualmente se
cultivan comercialmente, como flores de corte,
para los mercados internacionales en Centro y Sur América, el Caribe y
Hawái (Escalona et al, 1992)
No obstante, hay que tomar en cuenta que
la mayoría de las heliconias se propagan
vegetativamente a través de rizomas, debido a la dificultad en la germinación de las semillas, que suelen
tardar entre 2 o 3 meses y hasta 3 años en madurar su embrión (Montgomery 1986;
Criley, 1988). Además a pesar de la belleza,
diversidad y potencial de las heliconias, estas especies presentan otras
limitaciones que impiden aprovechar su potencial dentro del actual mercado de
flores de corte, tales como tamaño, peso, disposición de las inflorescencias y
estacionalidad (Broschat
y Dosenlman, 1984; Atehortúa,
1997).
Actualmente la biotecnología a diferencia de métodos tradicionales, juega un papel primordial en obtener, inducir
y mantener características florales más
atractivas o competitivas en el mercado. El cultivo de tejidos,
conjuntamente con la
implementación de la la técnica TCLs, ha resultado todo un éxito en la micropropagación de especies e individuos de interés
comercial, entre ellas las heliconias, TCLs (Thin Cells Layer)
consiste en cortar capa delgada de tejido, en este caso la
región de pseudotallo (Texeira,
2003).
En esta investigación se estableció un
protocolo que permitió propagar bajo condiciones in vitro Heliconia psittacorum var. Choconiana vía organogénesis directa. Mostrando que las secciones
transversales del pseudotallo tienen un gran
potencial de respuesta, resultando finalmente
microplántulas vigorosas de 15 cm de longitud, después de la onceava semana
del inicio del cultivo; por medio del sistema "TCLs"
y con un medio nutritivo apropiado para el desarrollo normal de los explantes (Thin Cells Layer) (Tan Nhut, et al.,
2003).
MATERIALES Y
MÉTODOS
Materiales
Material vegetal:
Plantas madres: microplántulas
libres de contaminación.
Explantes: secciones transversales de pseudotallos.
Medios de cultivos:
Tres tratamientos establecidos para el
cultivo de los explantes y el medio de preservación
del material vegetal (Cuadro 1).
Métodos
de aislamiento de los explantes mediante la técnica
de TCLs
· A partir de plántulas cultivadas in vitro de H. psittacorum, provenientes del Laboratorio de
Biotecnología Vegetal de
·
El
aislamiento y cultivo de los explantes, se realizó en
cámara de flujo laminar. Tres tratamientos fueron establecidos: utilizando el
medio básico de cultivo modificado Murashige y Skoog; con pH ajustados a 5,7 ± 0,8. Las condiciones de crecimiento
establecidas fueron: fotoperíodo de 16 h. luz
correspondiente a 1700 Lux y bajo temperatura de 25 ±
Diseño
experimental y análisis estadístico
Se diseñó un experimento de bloques completamente al azar, con una
variable dependiente que corresponde al número de brotes, y una variable
independiente que corresponde a los tratamientos; con un tamaño de la muestra
igual a 90 explantes, con 30 repeticiones.
En este experimento cada uno de los tratamientos
es un medio de cultivo de diferente composición, con el medio básico de cultivo
Murashige y Skoog, que
varía en la concentración de fitoreguladores y
algunos componentes referenciados en la bibliografía (Cuadro1) (Goh, et al.,
1995; Nayak, et
al., 2002).
Una vez a la semana se contaron los
brotes presentes en cada explante y para cada
tratamiento. de Heliconia psittacorum var. choconiana.
Dado
que los datos se ajustaron a la distribución normal y son paramétricos
se realizó la prueba de significancia estadística, (ANOVA) para saber si hay
diferencias significativas.
Posteriormente se realizó una prueba
estadística de comparación de medias (Scheffé, 1959 con los resultados de la 4, 5 y 8 semanas de cultivo, para determinar
si hubo diferencias significativas entre
los tratamientos.
Aislamiento
de explantes y subcultivos
de brote.
Se establecieron tres tratamientos
(Cuadro 1) para inducir la respuesta de los explantes,
en este caso, inducción de brotes. Posterior al cultivo del explante,
el tejido fue fragmentado en la onceava semana para separar cada uno de los
brotes obtenidos, además para el desarrollo normal de los brotes se amerito un
proceso de conservación a través de subcultivo,
estableciéndose un medio nutritivo con base en las experiencias del laboratorio
y en los reportes bibliográficos del cultivo in vitro de heliconias (Atehortúa, 1997;
Roca et al., 1983; Tan Nhut, et al.,
2003) , y bajo las siguientes condiciones: Medio basal; MS (Murashige
y Skoog 1962), enriquecido con 120 mg L-1
de tiamina, 80 mg L-1 de piridoxina, 100 mg L-1 de acido
ascórbico, 40 mg L-1 de acido nicotínico,
con 100 mg L-1 de Myo-inositol,
|
Cuadro 1. Medios de cultivo para la obtención de brotes de Heliconia psittacorum,
var. Choconiana mediante TCLs. |
|||||
|
Medio N° 1 |
[ C ] |
Medio N° 2 |
[ C ] |
Medio N° 3 |
[ C ] |
|
(MS 1962) |
|
(MS 1962) |
|
(MS 1962) |
|
|
Tiamina |
1 mg L-1 |
Tiamina |
1 mg L-1 |
Tiamina |
1 mg L-1 |
|
Acido Nicotinico |
1 mg L-1 |
Acido Nicotinico |
2 mg L-1 |
Sacarosa |
30 g L-1 |
|
Piridoxina |
1 mg L-1 |
Acido Ascorbico |
50 mg L-1 |
Acido Ascorbico |
200 mg L-1 |
|
Myoinositol |
100 mg L-1 |
Myoinositol |
100 mg L-1 |
2,4-D |
0,42 mg L-1 |
|
2,4 –D |
1 mg L-1 |
BAP |
1,5 mg L-1 |
Zeatina |
1,5 mg L-1 |
|
BAP |
1 mg L-1 |
Kinetina |
0,3 mg L-1 |
Myoinositol |
100 mg L-1 |
|
Carbon Activado |
0,5 g L-1 |
ANA |
0,25 mg L-1 |
Carbon Activado |
0,2 g L-1 |
|
Sacarosa |
30 g L-1 |
Sacarosa |
30 g L-1 |
Gelrite® |
1 g L-1 |
|
Caseina Hidrolizada |
1 g L-1 |
Gelrite® |
1 g L-1 |
|
|
|
Gelrite® |
1 g L-1 |
|
|
|
|
|
C= cantidad de compuesto
en la preparación de medios |
|||||
RESULTADOS
Los medios de cultivo que se utilizaron
para optimizar el sistema de sección transversal delgada "TCLs" (Thin Cells Layer) en Heliconia
psittacorum
var. choconiana, indicaron que los tejidos se mantuvieron vivos
en los tres tratamientos pero la eficiencia en la producción de brotes no fue
la misma, se observa que en el tratamiento 1, hubo mayor cantidad de explantes regenerados que en los tratamientos 2 y 3 (Cuadro
2). Esto se pudo apreciar por medio de las pruebas estadísticas realizadas
(Cuadro 3), donde el análisis de varianza muestra que hay un alto grado de
diferencias significativas y por tanto al menos uno de los tres tratamientos
fue diferente.
|
Cuadro 2. Frecuencia de
regeneración de los explantes de Heliconia psittacorum
var. choconiana obtenidos mediante la técnica de TCLs. |
|||||
|
TCLs |
PB |
Tratamientos † |
Total de Cortes |
||
|
Medio N° 1 |
Medio N° 2 |
Medio N° 3 |
|||
|
RE |
No |
2 |
20 |
20 |
42 |
|
Si |
28 |
10 |
10 |
48 |
|
|
Total |
|
30 |
30 |
30 |
90 |
|
PB: Presencia de brotes y RE: Respuesta del explante † Ver
cuadro 1. |
|||||
|
Cuadro 3.
Prueba de ANOVA realizada con los datos obtenidos en el recuento del
número de brotes producidos de Heliconia
psittacorum var. choconiana
mediante TCLs. |
||||||
|
Semana |
|
Suma de cuadrados |
Grados de libertad. |
Media cuadrática |
F |
Sig. |
|
4 |
Inter-grupos |
30,489 |
2 |
15,244 |
29,256 |
** |
|
Intra-grupos |
45,333 |
87 |
0,521 |
|
|
|
|
Total |
75,822 |
89 |
||||
|
5 |
Inter-grupos |
67,222 |
2 |
33,611 |
38,510 |
** |
|
Intra-grupos |
75,933 |
87 |
0,873 |
|
|
|
|
Total |
143,156 |
89 |
||||
|
8 |
Inter-grupos |
249,956 |
2 |
124,978 |
69,108 |
** |
|
Intra-grupos |
157,333 |
87 |
1,808 |
|
|
|
|
Total |
407,289 |
89 |
||||
|
Sig.= Significación, **
indica que existen diferencias altamente significativas entre los
tratamientos (al menos uno de los tres) con una probabilidad del 99%. |
||||||
Se observó que uno de los tratamientos
fue diferente y más eficiente para la producción de brotes (Cuadro 2); la
evidencia se obtuvo mediante la aplicación de la prueba estadística de
separación de medias “Scheffé” (Cuadro 4), en las
semanas 4, 5 y 8 después de la siembra del explante.
|
Cuadro 4. Prueba de
separación de medias (Scheffe), en la cuarta,
quinta y octava semana de inoculado el explante.
Se analizan los tres tratamientos para
evaluar el mejor medio para la obtención de brotes de Heliconia psittacorum var. choconiana mediante TCLs |
|||
|
Semana 4 |
|
Medias armónicas |
|
|
Tratamiento † |
N |
a ‡ |
B |
|
3 |
30 |
0,40 |
|
|
2 |
30 |
0,47 |
|
|
1 |
30 |
|
1,67 |
|
Sig. |
|
0,938 |
1,000 |
|
Semana 5 |
|
Medias armónicas |
|
|
Tratamiento |
N |
A |
b |
|
3 |
30 |
0,57 |
|
|
2 |
30 |
0,57 |
|
|
1 |
30 |
|
2,47 |
|
Sig. |
|
1,000 |
1,000 |
|
Semana 8 |
|
Medias armónicas |
|
|
Tratamiento |
N |
a |
b |
|
3 |
30 |
0,67 |
|
|
2 |
30 |
0,80 |
|
|
1 |
30 |
|
4,27 |
|
Sig. |
|
0,929 |
1,000 |
|
† Ver
cuadro 1. ‡ Se muestran las medias
para los grupos en los subconjuntos homogéneos. (a: Agrupa las medias de los
tratamientos que no poseen diferencias significativas) y (b: Agrupa las medias
del tratamiento que difiere del grupo). Usa el tamaño muestral
(n) de la media armónica = 30. |
|||
Según los resultados de la prueba estadística,
se estableció que los tratamientos 2 y 3
se comportaron de forma semejante, es decir que no hay diferencias
significativas en la eficacia de producción de brotes entre los dos
tratamientos, mientras que el tratamiento 1 tuvo un comportamiento diferente,
de modo que presenta diferencias altamente significativas con respecto a los
otros dos tratamientos (cuadro 4). Esto se hace evidente en el tiempo,
además durante la octava, novena y
onceava semana, se puede apreciar claramente la respuesta de los explantes
al tratamiento 1, por la formación de una gran cantidad de brotes, en promedio 15
por explante; mostrando ser el tratamiento mas
efectivo en la micropropagación de Heliconia psittacorum
var. choconiana (Figura 1).

Etapas de
producción de brotes mediante TCLs
Después de haber realizado los cortes
transversales, se observó que hacia la tercera, cuarta y quinta semana, los tejidos inician las respuestas de inducción
de brotes (Figura 2).
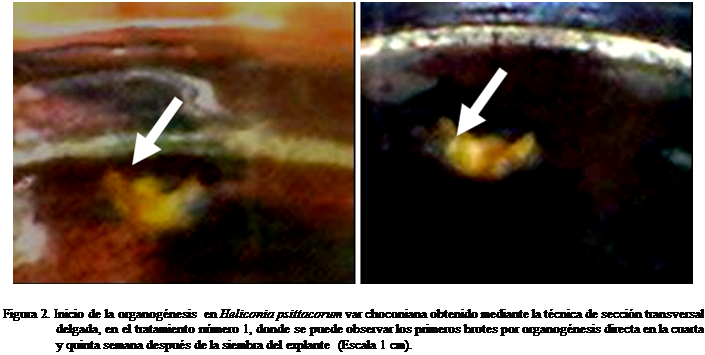
En el tratamiento 1, los tejidos
continúan con su desarrollo normal y el número de brotes producidos por el
proceso de organogénesis directa, empieza a incrementarse a medida que
transcurre el tiempo en cada uno de los explantes.
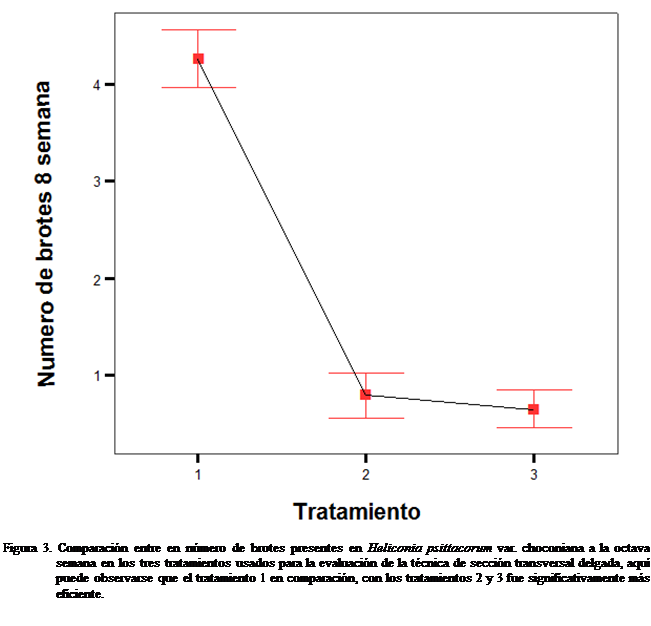
En la octava semana después de
establecido el cultivo, se registró un incremento en la producción de brotes
por organogénesis directa, la capacidad de los tejidos para regenerarse se hace
mayor y se registró la aparición de un
gran número de brotes (Figura 3).
Según trabajos realizados por otros
autores (Goh, et
al., 1995; Nayak, et al., 2002) en el establecimiento de heliconias in vitro se estableció un medio de
cultivo que permitió la conservación del material vegetal para que las plantas
continuaran su proceso normal, hasta que fuesen llevadas a su fase de
adaptación ex vitro (Figura 4).

DISCUSIÓN
La multiplicación in vitro de plantas del
orden Zingiberales, especialmente plátanos y bananos
entre otros, se realiza principalmente a
través de la proliferación de los meristemas
vegetativos. El desarrollo reciente de suspensiones de células embriogénicas
abre la posibilidad para la producción masiva de este tipo de plantas
a bajo costo (Haicour, et al., 1998). Varios estudios
sobre las suspensiones celulares se han realizado en
Al emplear una concentración
de fitoreguladores; 2,4–D (1 mg L-1)
en asociación con BAP en una concentración de 1 mg L-1
(tratamiento 1), los tejidos forman órganos directamente; y esto podría
explicarse debido al efecto producido
por la asociación de los fitoreguladores (Auxina: Citoquinina), ya que mientras el 2,4-D (Auxina sintética)
promueve la elongación celular, el BAP (Citoquinina),
promueve la multiplicación celular, permitiendo la formación de brotes
directamente del explante cultivado, lo cual
representa un menor periodo de tiempo en
la producción de plantas. A pesar
de que en el tratamiento 3 se tiene relación igual de Auxina/Citoquinina), entre Zeatina 1,5
mg / L y 2,4 – D 0,4 mg / L, no se presenta una inducción mayor al explante para la
producción de brotes; aunque algunos tejidos presentan brotes la cantidad no se
iguala a la cantidad de brotes que se presentan en el tratamiento 1, esto
muestra que si se disminuye demasiado la
concentración de 2,4 – D en asociación a una citoquinina
como es el caso del tratamiento 3, la respuesta del explante
no es la mejor, además aunque
El uso de los fitoreguladores
BAP 1,5 mg L-1, Kinetina 0,3 mg L-1
y ANA 0,25 mg L-1, empleados en el tratamiento 2, presentan una respuesta similar al
tratamiento 3 en cuanto a la inducción de brotes por organogénesis directa;
aunque esta combinación de reguladores ha sido utilizada para la propagación
por “TCLs” en
orquídeas del género Cymbidium, no resultó para la propagación de Heliconia psittacorum var. choconiana (Nayak et al., 2002).
Según los trabajos realizados, en Heliconia psittacorum
L, los valores altos de 2,4 D,
inducen la producción de polifenoles, generando un
color pardo oscuro, característica indeseable en el cultivo de tejidos,
principalmente para este tipo de planta; además dificultan el proceso de
diferenciación, para la obtención de brotes a partir de callo (Goh, et al 1995).
El protocolo establecido mostró que el
tratamiento 1, presentó mayor cantidad
de brotes que el resto de los tratamientos, Alcanzando finalmente el desarrollo
de microplántulas vigorosas de Heliconia psittacorum var. choconiana.
Confirmando el éxito de los resultados, es decir la obtención de brotes, con el
análisis estadístico realizado. La octava semana muestra una diferencia
significativa en la producción de
brotes, comparado con los tratamientos 2
y 3. Un aspecto para tener en cuenta es que los componentes del medio nutritivo
que hacen referencia al tratamiento 1 (cuadro1), y la concentración de los
reguladores de crecimiento utilizados es baja (1 mg / L), esto debido a que en
ensayos previos pudo observarse que una concentración mayor del regulador de crecimiento (Goh et al,
1992), 2,4-D (Goh
et al, 1995), induce primeramente una
formación de callo para luego de ahí
obtener los brotes, haciendo mas difícil la producción.
Uno de los alcances del sistema es que al usar una concentración
baja de 2,4 – D (1 mg /L) en asociación del regulador de crecimiento BAP
con una concentración de 1 mg L-1,
los tejidos se desarrollan por organogénesis directa, que puede explicarse
gracias al efecto producido por la
asociación de los dos reguladores de crecimiento, ya que mientras el 2,4- D
promueve la elongación celular, el BAP, promueve la multiplicación celular
permitiendo la formación de brotes directamente del explante
cultivado (Roca et al, 1983), lo
cual representa un menor periodo de
tiempo en la producción de plantas y
además una disminución en el costo de la producción, y simplemente los Brotes que fueron aislados evitando así la competencia entre
ellos y permitiendo el buen desarrollo
de los mismos al ser subcultivados, también bajo
condiciones estériles, en un medio
nutritivo alcanzando obtener microplántula.
Finalmente, y en forma global uno de los
aportes de esta investigación, fue haber logrado un incremento en la producción
de brotes mediante organogénesis directa. Por tanto se puede afirmar, que el proceso
de optimización de la técnica de sección transversal delgada "TCLs" (Thin Cells Layer) en combinación con
el medio de cultivo utilizado, es exitoso y es una buena herramienta para la
producción de plantas de Heliconia psittacorum, variedad choconiana.
Sin embargo se requieren numerosos estudios para lograr mayor eficiencia en la
producción de esta variedad ornamental de plantas que presenta limitaciones
para reproducirse sexualmente.
Esta investigación abre puertas a
estudios con mayor profundidad acerca del tema; que ayuden al mejoramiento en
la calidad y productividad en este tipo de plantas cultivadas con fines tanto
científicos como netamente comerciales.
CONCLUSIONES
·
Los cortes del pseudotallo de plantas de H. psittacorum, variedad choconiana aislados a través de la técnica de sección
transversal delgada, al ser cultivados in
vitro respondieron exitosamente. Los explantes de
H. psittacorum
cultivados con el sistema de sección
transversal delgada “TCS” (Thin Cross Section) o "TCLs" (Thin Layer Cells), responden de una
forma positiva, manteniéndose vivos, e induciendo a la formación de brotes en
el medio nutritivo compuesto principalmente por: MS, (Murashige y Skoog 1962), suplementado con tiamina, piridoxina,
acido nicotínico, Myo inositol,
carbón activado, sacarosa, los reguladores de crecimiento 2,4-D (2,4-Acido diclorofenoxiacetico) y BAP (Benzil
amino purina) y Caseína hidrolizada.
·
Los explantes cultivados no tuvieron la mejor respuesta en
cuanto a inducción de organogénesis directa, con la asociación de reguladores
de crecimiento como 2,4 – D y Zeatina. La combinación
de fitoreguladores Kinetina,
ANA y BAP, no fue ideal para H. psittacorum,
variedad choconiana y aunque hay respuesta en algunos
tejidos no es la ideal para este tipo de plantas.
·
Los brotes
obtenidos se desarrollan mediante organogénesis directa, mediado por una baja
concentración de fitoreguladores; 2,4-D y BAP. Los brotes pueden fragmentarse y
conservarse en un medio donde se mantengan vivos y continúen su desarrollo, hasta su posterior
adaptación a la fase ex vitro.
·
El sistema
de sección transversal delgada, es
una herramienta innovadora para cultivar
secciones de rizoma, que pueden diferenciarse, mediante combinaciones adecuadas
de fitoreguladores, como los utilizados en el
presente trabajo de investigación.
·
En el medio 1
(tratamiento 1), la respuesta de los tejidos es mayor en cuanto a la producción
de brotes, presentando hacia la octava y novena semana el mayor número de brotes
por explante.
LITERATURA CITADA
Atehortúa, L. 1997. Heliconia:
A new challange for The Colombian Floricultural
Industry. In: Biotechnology and
Development. p. 20-22.
Berry, F y W. J. Kress. 1991. Heliconia: An identification guide. Smithsonian Institucion Press, Washinton, D. C.
Broschat, T. K. y H. M. Donselman. 1984. Growing Heliconia psittacorum
for cut flowers. Nurseryments Digest. p. 42-43.
Bui Trang Viet, Cung
Hoang Phi Phuong, Tran Thanh Huong
and Pham Thanh Luong. 2000.
Callus and cell suspension initiation from male flowers of M. balbisiana cv. Hot and M. cavendishii
cv. Gia cui. Viet Nam National University-HCM
City, College of Natural Sciences. p. 114-118.
Clay, H. F. y J. C. Hubbard. 1987. The Hawain Garden. Tropical Exotics. The University Press of Hawai. Honolulú. p. 143-173.
Criley, R.A. 1988. Propagation of
tropical cut flowers: Strelitzia,
Alpinia and
Heliconia. Acta Hort. 226:
509-517.
Cung Hoang Phi Phuong and Bui Trang Viet. 2000. Development of embryos and callus
initiation from immature embryos of Musa balbisiana
(abstract in English). J. Science and Technology Development 3 (5-6):
38-44.
Goh, C.; J. N. Marie and K Prakash. 1992. High frequency plant regeneration in Heliconia psittacorum L.f. Plant Science 90 (1): 63 -71.
Goh, C.; J. N. Marie and K
Prakash.1995. Direct organogenesis and induction of morphogenic
callus through thin section culture of Heliconia psittacorum. Scientia Horticulurae 62 (1-2): 113-120.
Haicour R.; V. Bui Trang, D. Dhed’a , A. Assani, F. Bakry and F. X. Cote.
1998. Banana improvement through
biotechnology-ensuring food security in the 21st century (Abstract in English).
Cahiers Agricultures 7: 468-475.
Kress, W. J.; J. Betancur, C. S. Roesel y B. Echeverry. 1993. Lista preeliminar de
las Heliconias de Colombia y cinco especies nuevas. Caldasia
17(2): 183-197.
Kress, W. J; J. Betancur, C. S. Roesel
y B. Echeverry. 1999. Heliconias llamaradas de la selva colombiana. Bogota, Colombia.
Montgomery, R. 1986. Propagation of Heliconia
from seeds. Bull. Heliconia Soc. Int. 1(2): 6- 7.
Murashige, T. and F. Skoog1982. A
revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiologia Plantarum 15 (3):
472-497.
Nayak, N.; S. Sahoo,
S. Patnaik and S. Rath.
2002. Establishment of thin cross section (TCLs) culture method for rapid micropropagation of Cymbidium
aloifolium (L). and Dendrobium nobile Lindl. Orchidaceae) Scientia Horticulturae 94 (1-2):
107- 116.
Pierik, R. 1990. Cultivo in vitro de las plantas superiores.
Ediciones Mundi prensa. España.
Roca, W. M. y L.
Mroginski.1983. Cultivo de tejidos en la agricultura: Fundamentos y
Aplicaciones. Centro Internacional de Agricultura Tropical. CIAT, Cali, Colombia, 20 p.
Scheffé, H. 1959. The Analysis of Variance. John Wiley Sons, Inc. USA. 38,39,417 p.
Teixeira da Silva, J. 2003. Thin Cell Layer technology in ornamental
plant micropropagation and biotechnology. African
Journal of Biotechnology. 2 (12).
Tran Thanh Huong and
Bui Trang Viet. 2000. Effects of various antioxidants
on Musa cavendishii cell suspension culture
(abstract in English). Viet Nam National University-HCM City, College of
Natural Sciences. 17-23 p.
Tran Thanh
Huong and Bui Trang Viet.
2003. Growth of the cell suspension of Musa paradisiaca
L. cv. Cau Man (abstract in English). Viet Nam
National University-HCM City, College of Natural Sciences. 423-430 p.
Página diseñada por Prof. Jesús Rafael Méndez Natera
TABLA DE CONTENIDO DE LA REVISTA CIENTÍFICA UDO
AGRÍCOLA



