Revista Científica UDO Agrícola
Volumen 9. Número 3. Año 2009. Páginas: 595-598
Estudios citogenéticos de Hibiscus
sabdariffa L. (Malvaceae)
Cytogenetic studies
of Hibiscus sabdariffa L. (Malvaceae)
Nilda ALCORCÉS DE GUERRA
Universidad de Oriente. Núcleo de Monagas. Postgrado
en Agricultura Tropical. Laboratorio de Citogenética. Urbanización Juanico,
Maturín, 6201, estado Monagas, Venezuela.
Emails: nildafel@gmail.com y nildafel@cantv.net
|
Recibido: 19/02/2009 |
Fin de primer arbitraje:
17/03/2009 |
Primera revisión recibida: 23/04/2009 |
|
Fin de
segundo arbitraje: 13/07/2009 |
Segunda
revisión recibida: 28/07/2009 |
Aceptado: 29/07/2009 |
RESUMEN
Con el objetivo de corroborar el número
cromosómico, fórmula cariotípica, tipo de polen y profundizar el estudio de la
meiosis de Hibiscus sabdariffa
L., se utilizaron meristemas de raíces tratados con colchicina (0,05%) y
anteras procedentes de flores jóvenes, colectadas en dos localidades del
municipio Maturín, Monagas, Venezuela. Se encontró un número diploide de 2n =
72 cromosomas, con 32 pares metacéntricos y 4 pares submetacéntricos. Los pares cromosómicos 34 y 35 mostraron
constricciones secundarias. En la meiosis se observaron entre 96,3 a 100,0% de
células normales y un índice meiótico de 96,9
a 97,2%.
Palabra
claves: Hibiscus sabdariffa, meiosis,
número cromosómico, fórmula cariotípica.
ABSTRACT
With
the objective to corroborate chromosome number, karyotypic formulae, pollen
type and to do a deeper study of meiosis of Hibiscus sabdariffa L.,
root
tips treated with colchicine (0.05%) and anthers from floral buds were used.
They were collected from two localities of Maturin Municipality, Monagas State,
Venezuela. A diploid chromosome number
(2n = 72) was found, with 32 metacentric pairs and four submetacentric
ones; 34 and 35 chromosome pairs showed secondary constrictions. Furthermore, normal
cells between 96.3 to 100.0% and meiotic index between 96.9 to 97.2% were
observed in meiosis.
Key words: Hibiscus sabdariffa, meiosis,
chromosome number, karyotipic formulae
INTRODUCCIÓN
Hibiscus sabdariffa L. es una especie perteneciente a la familia
Malvaceae, subfamilia Malvoideae, tribu Hibisceae. En esta subfamilia se ubican
aproximadamente unos 112 géneros. El género Hibiscus
ubicado en la sección Furcaria comprende aproximadamente 785 taxas específicas
e infraespecificas, se citan para Venezuela 12 especies. Este género está
ampliamente distribuido en la región
tropical y subtropical (Adamson y O’Bryan 1981), con algunas especies de
importancia económica, como fuente alimenticia y medicinal (Wilson y Menzel
1964; Dickel et al. 2006; Tolulope y Teixeira 2007). Existen varias
especies dentro de Hibiscus donde se
han realizado reportes del número cromosómico y no hay criterios de unificación
en la información. Entre ellas, se puede citar H. rosa-sinensis con 2n = 36, 38, 40, 44, 46, 52, 70, 76, 84, 90,
92, 118, 132 y 144 (Ge et al. 1989,
Munirajappa y Krishnappa 1989 y Sidhu et
al. 1990); H. vitifolius 2n=34 y
96 (Dasgupta y Bhatt 1976, Dasgupta et al.
1980, Munirajappa y Krishnappa 1989 y
Shanmughasundaram 1992, citados por Goldblatt y Johnson 1975, 1978, 1990, 1991,
1998, 2000).
Para
H. sabdariffa Menzel y Wilson (1966)
reportaron n=36; Kuwada, (1977), Kuwada y Mabuchi, 1977, n=36 y 2n=72; Bhatt y
Dasgupta, (1977), n=36 y 2n=36 y 72; Huang et
al. (1985, 1989) indicaron 2n=18 y 36 (citados por Goldblatt y Johnson,
1975-1978, 1984-1985); Naznin et al.
(2006) realizaron bandeo cromosómico a H.
sabdariffa var. HS-24 y reportan 2n=2x=72 con los cromosomas todos
metacéntricos y su tamaño de 1,43-3.80 µm. Kuwada (1977) reportó que los
híbridos F1 y F2 entre Hibiscus
acetosella y Hibiscus radiatus
presentaron 2n=72. Debido a la
importancia del cultivo en el oriente del país y a la diversa información
citogenética, se hace necesario conocer el material existente en la zona, para
lo cual se realizó el estudio citogenético del mismo.
MATERIALES Y
MÉTODOS
Se usaron
botones florales y frutos secos de H. sabdariffa L., provenientes de dos
sitios de colección en el Municipio Maturín: Parcela Experimental de
Los
recuentos cromosómicos se establecieron con la hora mitótica de la especie.
Para ello se trataron 30 ápices radiculares con colchicina al 0,05% m/v durante 2 h y luego con cloruro de sodio al
0,03% m/v, durante 10 min, para incrementar la frecuencia de células
metafásicas con cromosomas dispersos. Luego fueron fijados en Carnoy (3:1
etanol absoluto-ácido acético glacial). Para la preparación de las láminas, los
ápices fueron colocados en HCl 18% v/v durante 10 min y en agua destilada por
otros 10 min. En un portaobjetos fueron disectados, macerados y posteriormente
teñidos con orceína FLP al 2% m/v. Se colocó el cubreobjetos, se
realizó el aplastamiento del tejido por presión manual para separar las células
y se procedió a detectar células metafásicas con cromosomas dispersos,
claramente visibles al microscopio óptico, para analizar el cariotipo de la
especie. Las imágenes cariológicas se obtuvieron con la ayuda de un microscopio MOTIC, lo cual permitió
seleccionar 20 células que mostraran cromosomas bien esparcidos, para proceder
a medir la longitud de los brazos, determinar el índice centromérico y la relación de brazos, y clasificar de acuerdo
con la nomenclatura de Levan et al. (1964).
RESULTADOS
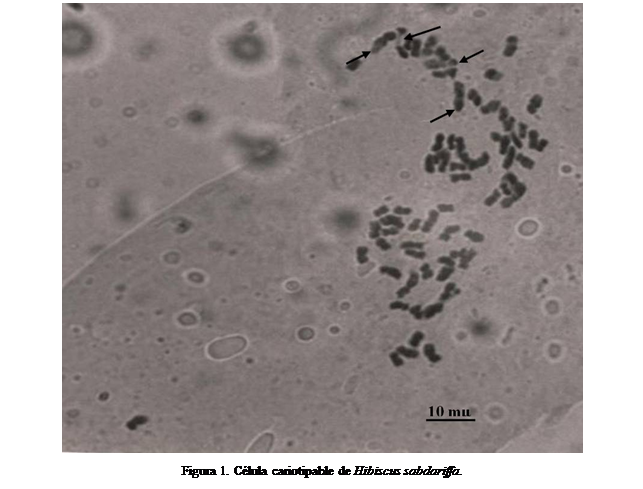
La
observación de los cromosomas somáticos mostró 2n = 72 (Figura 1). El tamaño de
los cromosomas osciló entre 1,58 y 4,36 µm. De los 36 pares de cromosomas, seis
son metacéntricos en el punto medio, 26 metacéntricos en la región media y
cuatro submetacéntricos, observándose constricciones secundarias en los brazos
cromosómicos de los pares 34 y 35. Estos resultados permiten proponer la
fórmula cariotípica 12M+52m+8sm, indicando un cariograma simétrico por la
predominancia de cromosomas metacéntricos (Figura 2), de acuerdo a
Stebbins (1971).

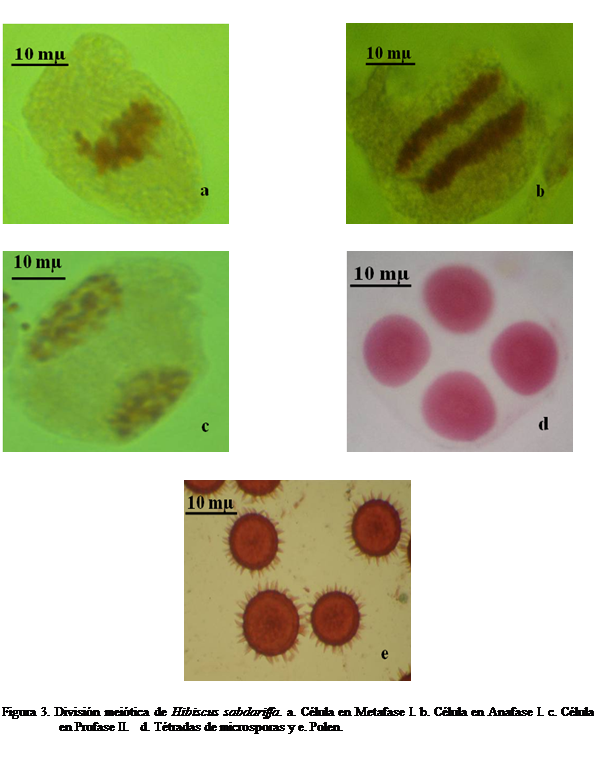
Los resultados
obtenidos del análisis de las fases meióticas se muestran en el Cuadro 1 y
células en metafase I, anafase I, telofase I, profase II, tétradas y polen se
muestran en las Figuras 3a-e. En los análisis realizados a las fases de la
meiosis se puede inferir que el porcentaje de células normales está entre
|
Cuadro 1. Análisis de la microporogénesis de Hibiscus
sabdariffa L. colectado en dos localidades del Municipio Maturín, estado
Monagas, Venezuela. |
|||||||||||||
|
Meiosis I |
Diacinesis |
Metafase |
Anafase |
||||||||||
|
Localidad |
N |
A |
% |
N |
A |
% |
N |
A |
% |
||||
|
E. E. UDO |
203 |
9 |
97,13 |
210 |
8 |
96,33 |
218 |
2 |
99,09 |
||||
|
Bajo Gua. |
237 |
4 |
98,34 |
229 |
7 |
97,03 |
100 |
0 |
100,00 |
||||
|
Meiosis 2 |
Telofase |
Profase |
Tétradas |
||||||||||
|
Localidad |
N |
A |
% |
N |
A |
% |
N |
A |
% |
||||
|
E. E. UDO |
215 |
5 |
87,72 |
209 |
6 |
97,21 |
243 |
7 |
98,22 |
||||
|
Bajo Gua. |
286 |
3 |
98,96 |
285 |
7 |
97,60 |
291 |
9 |
96,90 |
||||
|
Índice Meiótico |
E. E.
UDO |
97,20% |
Bajo
Gua. |
96,89% |
|||||||||
|
E. E. UDO: Estación Experimental de Bajo Gua. : Parcelamiento del Bajo Guarapiche. N= Células normales; A=
Células anormales; %= Porcentaje de células normales. |
|||||||||||||
DISCUSIÓN
Como puede observarse para
ambos sitios de colección el porcentaje de células normales fue mayor en
relación con el de las células anómalas. También el índice meiótico fue alto,
lo que demuestra que los materiales evaluados presentan estabilidad en el
proceso meiótico. Estudios realizados con nueve especies de Syzygium cumini
indican que el comportamiento de la microporogénesis de esa especie es
considerada normal debido a que el índice meiótico está por encima del 91% y la
viabilidad del polen fue mayor de 93% (Pinto y Battistin, 2004). Estos resultados, al compararse con los de H.
sabdariffa, indican que la especie presenta un alto porcentaje de células
normales durante la meiosis y se infiere que un alto porcentaje de su polen es
viable, debido al alto porcentaje de germinación que presentaron las semillas.
Esta especie es reportada por poseer un número cromosómico de n= 18; n= 36; 2n=36
y 2n=72 y además se plantea que presenta 72 cromosomas por se tratar de una
especie tetraploide (Menzel y Wilson 1966, Menzel et al. 1986). En el presente estudio se contaron 36 bivalentes en
las diacinesis, confirmando un 2n=72 cromosomas. Naznin et al. (2006), aplicando fluorescencia a una variedad de H. sabdariffa, mostraron la presencia de
72 cromosomas todos metacéntricos y no reportan constricciones secundarias en
ninguno de los brazos. Sin embargo, el material de H. sabdariffa analizado en esta investigación mostró 72
cromosomas, metacéntricos en el punto
medio, metacéntricos en la zona media y submetacéntricos, además de dos pares
cromosómicos con constricciones secundarias.
AGRADECIMIENTO
Al Consejo de Investigación de
LITERATURA
CITADA
Adamson, W. C. and J. E.
O'Bryan. 1981. Inheritance of photosensitivity in
roselle, Hibiscus sabdariffa. The Journal of
Heredity 72: 443-444.
Dickel, M. L.; S.
M. Kuze Rates and M. Rejane Ritter, M. 2007. Plants popularly used for loosing
weight purposes in Porto Alegre, South Brazil. Journal of Etnopharmacology. 109 (1): 60-71.
Goldblatt, P. and
D. E. Johnson. 1975-1978. Index to plant chromosome numbers. Missouri Botanical
Garden Press. 553 p.
Goldblatt, P. and
D. E. Johnson. 1979-1980. Index to plant chromosome numbers. Missouri Botanical
Garden Press. 427 p.
Goldblatt, P. and
D. E. Johnson. 1984-1985. Index to plant chromosome numbers. Missouri Botanical
Garden Press. 264 p.
Goldblatt, P. and
D. E. Johnson. 1988-1989. Index to plant chromosome numbers. Missouri Botanical
Garden Press. 238 p.
Goldblatt, P. and
D. E. Johnson. 1990-1991. Index to plant chromosome numbers. Missouri Botanical
Garden Press. 267 p.
Goldblatt, P. and
D. E. Johnson. 1998-2000. Index to plant chromosome numbers. Missouri Botanical
Garden Press. 297 p.
Levan, A.; K. Fredga and A. Sandberg. 1964. Nomenclature for centromeric
position on chromosomes. Hereditas 52: 201-220.
Menzel, M. and F.
D. Wilson. 1966. Hybrids and Genome Relations of Hibiscus sabdariffa, H.
meeusei, H. radiatus and H. acetosella. Amer. J. Bot. 53 (3):
270-275.
Menzel, M.; K.
Richmond, C. Contolini and P. Huang. 1986. New intergenomic hybrids among some
African diploid species of Hibiscus sect. Furcaria. Amer. J. Bot.
73 (2): 304-409.
Naznin, H.; A. Nazmul, A. A. Fakhruddin, B. Rabeya and S. A. Sheikh.
2006. Differential Fluorescent Banding and Isozyme Assay
of Hibiscus cannabinus L. and H. sabdariffa L. (Malvaceae). Cytologia 71 (2): 175-180.
Pinto L., A. e A. Battistin. 2004. Microsporogenesis
de nove acessos de Syzygium cumini (L.) Skeels Myrtaceae oriundos do
Rio Grande do sul Brasil. Rev. Fac. Zootec. Vet. Agro. Uruguaiana, 11 (1):
192-205.
Stebbins, G. L. 1971. Chromosomal Evolution in Higher Plants.Edward
Arnold (Publishers) Ltd., London. 216 p.
Tolulope O., M. and
J. B. Teixeira R. 2007. Commonly used tropical medicinal plants
exhibt distinct in vitro antioxidant activities against hepatotoxins in
rat liver. Experimental
and Toxicologic Pathology 58 (6): 375-460.
Wilson, F. D. 1999. Revision of Hibiscus
section Furcaria (Malvaceae) in Africa and Asia. Bull. Nat. Hist. Mus.
Lond. (Bot.). 29 (1): 47-79.
Wilson, F. D. and M. M. Menzel. 1964. Kenaf (Hibiscus cannabinus), roselle (Hibiscus
sabdariffa). Econ. Bot. 18: 80-91.
Página diseñada por Prof. Jesús Rafael Méndez Natera
TABLA DE CONTENIDO DE LA REVISTA CIENTÍFICA UDO
AGRÍCOLA



