Revista Científica UDO Agrícola Volumen 9.
Número 2. Año 2009. Páginas: 383-392
Caracterización e incidencia de Ralstonia solanacearum Smith en plantas de Musa AAB en el Sector “El
Roble”, Sur del Lago de Maracaibo, Venezuela
Characterization and incidence
of Ralstonia solanacearum
Smith in Musa AAB plants at Sector
“El Roble” South of Maracaibo Lake, Venezuela
Yarira VIVAS1, Isabel URDANETA1,
Sairo RANGEL1 y José HERNÁNDEZ ![]() 2
2
Universidad Nacional Experimental Sur de Lago
"Jesús María Semprún", municipio Colón, estado Zulia, Venezuela. 1Laboratorio
de Fisiología Vegetal y 2Laboratorio de Biotecnología.
E-mail:
hernandezj@unesur.edu.ve ![]() Autor para
correspondencia
Autor para
correspondencia
|
Recibido: 30/06/2008 |
Fin
de primer arbitraje: 16/03/2009 |
Primera
revisión recibida: 10/06/2009 |
|
Fin de segundo arbitraje: 25/08/2009 |
Segunda revisión
recibida: 08/12/2009 |
Aceptado: 27/12/2009 |
RESUMEN
Ralstonia solanacearum es
el agente causal del marchitamiento sistémico conocido como ¨Hereque¨ (HRQ),
enfermedad bacteriana que en Venezuela
amenaza la producción de plátano Hartón (Musa AAB). La investigación se realizó en una finca de
Palabras clave: Ralstonia solanacearum, Musa
AAB, Hereque, caracterización e incidencia.
ABSTRACT
Ralstonia solanacearum is the causing agent of the systemic wilt known
as “Hereque”
(HRQ), a bacterial disease that threats the Harton Musa AAB production in Venezuela. This
research was developed within a 300 h farm at “El Roble”, the limit zone of Municipios Alberto Adriani and
Colón, between Mérida and Zulia States, at the South of Maracaibo Lake, in
endemic zone. The purpose of the characterization of R. solanacearum in Harton
plantain Musa AAB was to correlate
the incidence of HRQ with the values of precipitation from December 2007 to
March 2008. Because of that, a randomized experimental blocks design (pobos) was
established. A portion of ill tissue (leave, corm, and culms) was taken from
the affected plants (HRQ). Then it was planted in a Kelman
selective medium and replicated in an alcohols and carbohydrates medium.
Additionally, a Gram stain was applied, as well as a 40 and 100x smear, and
inoculants infiltrations in healthy crops of bacteria cultivated in vitro 2,5x105 x ml (BC)
and extracts of ill plants non dissolved (EPE). The bacterium is negative Gram,
of reddish colonies in the middle of the tetrazolio,
which split in tow mannitol, sorbitol, maltose and
lactose. The evidence indicates that it is R.
solanacearum, breed 2, biovar
3. The inoculations with BC showed a diminishing in the pathogenicity, and
plants inoculated directly with EPC showed classic symptoms of wilt between
days 10 and 14. The incidence was related to the precipitation rates, so, the
HRQ showed an average of up to 4,22% of incidence
during the maximum rains. At the same time, the statistic analysis showed that R. solanacearum remains
latent in Harton Musa
AAB plantations.
Key
words: Ralstonia solanacearum,
Musa AAB, Hereque,
characterization and incidence.
INTRODUCCIÓN
Los cultivos de plátano y banano es la actividad
frutícola de mayor relevancia a nivel nacional (Nava, 1989) y la quinta del
mundo en lo que a cultivos se refiere
(FAO, 2006; Frison y Sharrock,
1988). El Sur del lago de Maracaibo es
una fértil llanura aluvial que concentra unas
La enfermedad bacteriana ha sido reportada como una de
las más antiguas y estudiada por los fitopatólogos (Rorer, 1911), en la actualidad los avances científicos han
permitido la secuenciación completa de su genoma (Salanoubat
et al., 2002) permitiendo demostrar
una versátil variabilidad genética (Poussier et al., 2003; Yu
et al., 2003) que le permite sobrevivir a R. solanacearum en diversas condiciones (Caruso et al.,
2005). La bacteria puede diseminarse por heridas de la planta, aguas de
escorrentía, salpicaduras, semillas infectadas, insectos, herramientas de
trabajo (Hayward, 1991; Belalcázar et al., 2004; Nava, 1989, Tackatsu, 1986). En Colombia, de donde se presume pasó a
Venezuela, la enfermedad ha causado pérdidas totales de al menos unas
Para aislar la bacteria in vitro se debe
recurrir a medios de tetrazolio (Kelman,
1954). Las técnicas de metabolismo con disacáridos y alcoholes hexosa son una
excelente estrategia para caracterizar al patógeno con relación al biovar (Hayward, 1964; French et al., 1995). Hasta ahora,
la bacteria ha sido poco estudiada en las plantaciones de plátano de la región
del Sur del lago de Maracaibo, a pesar
del impacto económico en la actividad más productiva de la cuenca y por
ser el patógeno bacteriano “modelo” para
explicar los mecanismos biológicos que gobiernan la patogenicidad
en las plantas. El presente reporte
científico tuvo como objeto: caracterizar la bacteria in vitro, y
monitorear la incidencia del patógeno en campo, aunado a su posible relación
con las épocas lluviosas en
MATERIALES Y MÉTODOS
Procedencia del material vegetal y
diseño experimental
El estudio se realizó en la finca “El Roble” sector “
Incidencia de la enfermedad
La incidencia (ICD) fue monitoreada
desde Diciembre del 2007- a marzo 2008, las evaluaciones se realizaron
mensualmente discriminando las plantas de Hartón sanas y contabilizando las que
mostraban síntomas evidentes de marchitamiento HRQ (amarillamiento,
flacidez de la hoja bandera, anillo en el cormo, secreción al corte),
Aislamiento bacteriano de plantas de
Hartón Musa AAB y caracterización de R. solanacearum
En la plantación, por cada bloque (pobo) fueron
muestreadas de manera aleatoria 3
plantas con síntomas del HRQ y se
tomaron muestras por triplicado de
diferentes órganos (hoja, seudotallo, cormo e hijo).
Posteriormente a las 6 horas, las muestras se llevaron al laboratorio y
almacenadas por separado en la nevera a -20 °C, luego se pesó
Metabolismo con alcoholes y disácaridos
Las colonias rojizas con borde crema resultantes en el
medio con TTC fueron traspasadas a diferentes medios basales con azul de bromotimol AZB con adición de: maltosa y lactosa
(disacáridos); manitol y sorbitol (alcoholes hexosa) por 96 horas a ± 27 °C
(French et al., 1995); con el fin de
determinar el biovar se empleó la metodología de Buddenhagen et al.,
1962 en relación al viraje de color
indicativo del metabolismo ácido de los alcoholes y carbohidratos. Como
control negativo de las placas se empleó una cepa activa de Pseudomonas fluorecens.
Para disertación de la significación estadística (p ≤
0,05) en los diferentes órganos de la planta (hoja, seudotallo,
cormo e hijo) se empleó en matriz no paramétrica binaria, por positivo (+
amarillo) o negativo (- turquesa) sustituyendo con 0 y 1 en el programa
estadístico SPPS v.15
Prueba de patogenicidad
Una vez realizada la fase de caracterización de las
bacterias, se procedió a infiltrar a las plántulas de plátano “Hartón” sanas
con concentración del aislado de R. solanacearum 2,5x105x UFC
ml (BC), enriquecidas en medio King por
unas 72 horas procedentes de las colonias medio Kelman,
al mismo tiempo se inoculó con “extracto reciente” de plantas
enfermas (EPE) dilución 10-1,
la inyección con aguja hipodérmica se realizó a razón de 0,5 ml. en
el pecíolo de la hoja anterior a la “bandera”, e incubando por 5 días para
reproducir los síntomas clásicos del marchitamiento en plantas mantenidas en un
umbráculo.
RESULTADOS Y DISCUSIÓN
Dinámica en el porcentaje de plantas
afectadas por “Hereque” bajo las condiciones de cultivo en la finca “El Roble”
(diciembre 2007-marzo 2008).
En los 3 pobos durante las evaluaciones realizadas en
campo se observó que la incidencia de plantas afectadas por “Hereque” osciló
entre 0 y 7,63% (Cuadro 1), esta proporción de la enfermedad varió poco
durante el tiempo en que se tomaron los
registros. En promedio, el pobo 1 mostró una mayor cantidad de plantas
afectadas, seguido del pobo 2 y el 3. La
tendencia fluctuante en el tiempo fue similar en cada pobo si es
comparado con los 3 valores promedio. A partir de las mediciones en día 0
(mediados diciembre 2007), momento en que se detectó la mayor cantidad de
plantas con síntomas de la enfermedad, el valor descendió progresivamente hasta
el día 58 en 1,69% y repuntó nuevamente el día 90 en 3,21% (Figura 1).
|
Cuadro 1. Porcentaje plantas afectadas con
“Hereque” causado por Ralstonia solanacearum en 3 pobos de plátano Hartón (Musa AAB), de la finca “El Roble”,
Municipio Alberto Adriani y Colón Sur del lago de Maracaibo
durante los meses de diciembre |
|||||
|
Días de observación |
Porcentaje de plantas afectadas |
|
|||
|
** Pobo 1 |
Pobo
2 |
Pobo 3 |
Promedio (días) |
Desv |
|
|
* 0 |
7,63 |
5,45 |
1,09 |
4,72 |
3,33 |
|
36 |
3,63 |
4,72 |
1,36 |
3,24 |
1,71 |
|
58 |
2,9 |
2,18 |
0 |
1,69 |
1,51 |
|
90 |
5,45 |
2,54 |
1,63 |
3,21 |
1,99 |
|
Promedio |
4,90 |
3,72 |
1,02 |
3,22 |
1,98 |
|
Desv. |
2,11 |
1,61 |
0,71 |
1,48 |
0,70 |
|
* 1ra
observación en campo. **Área de la plantación seleccionada
al azar, aproximada a |
|||||
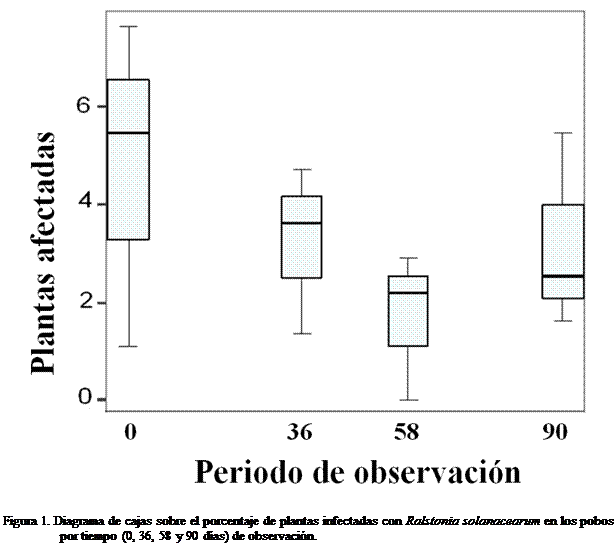
Estos resultados indican que el brote del HRQ se
mantuvo constante cerca del 4% de
incidencia sin sobrepasar el umbral económico, pero sin desaparecer, varios reportes
hasta ahora publicados indican que en la rizósfera de
las plantas la comunidad biológica influye sobre las interacciones
ecológicas que pueden favorecer o en su
defecto limitar el desarrollo de bacterias patógenas, este mecanismo
ampliamente estudiado (PGPR) promueve en
las plantas mecanismos de resistencia sistémica inducida (Kloepper
et al., 1993) o provocando antibiosis
con otros microorganismos (Parck et al., 2007). Por su parte, los reportes en Colombia (Gómez et al., 2006), indican una gran
severidad en los brotes de R. solanacearum en
las diferentes zonas productoras, destacan que la diseminación del patógeno
dentro del cultivo, es favorecida por el manejo agronómico (Hayward, 2006), la
dinámica de los hospederos (malezas) y
los vectores (Belalcázar et al., 2004), además de las condiciones ecológicas aditivas que
inciden en la agresividad del patógeno (Islam y Toyota, 2004).
Relación de la incidencia de R. solanacearum
con los valores mensuales de precipitación
Los datos de precipitación registrados por la estación
meteorológica digital del INIA-Chama arrojan los siguientes valores de mm. por cada mes:
diciembre
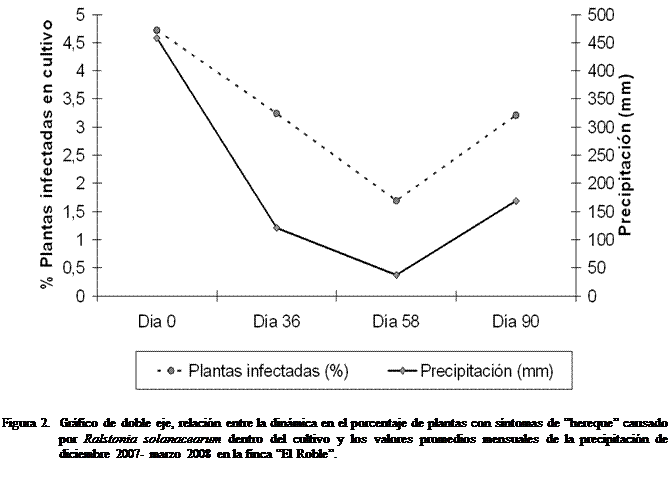
La incidencia
del HRQ fluctuó de manera significativa
en los bloques o “pobos” según el Anava
(Cuadros 2 y 3), detalla además que, en definitiva durante las mediciones a los
días 0, 36 ,58 y 90 en todos los bloques
varió (en promedio) pero no marcó una tendencia significativa (p-valor 0,48),
estos resultados sugieren que los nuevos brotes, o cantidad de plantas con
síntomas de la enfermedad se mantuvieron sin un alza importante pero con cierta
expectativa de incremento a las variables eco fisiológicas principalmente la
precipitación.
|
Cuadro 3. Prueba de homogeneidad de varianzas para Días y Pobos. |
||||
|
|
Estadístico de Levene |
Grados de Libertad 1 |
Grados de Libertad 2 |
Significación |
|
Días |
1,062 |
3 |
8 |
0,418 |
|
Pobos |
3,589 |
2 |
9 |
0,071 |
|
Cuadro 2 Análisis de varianza para el porcentaje de
plantas afectadas por Ralstonia solanacearum en función de los periodos (días) de
evaluación en campo. |
|||||
|
Fuente |
Suma de cuadrados tipo III |
Grados de Libertad |
Media cuadrática |
F |
Significación |
|
Modelo correg. |
169,501(a) |
6 |
28,250 |
19,077 |
0,001 |
|
Pobo |
31,693 |
2 |
15,846 |
10,701 |
0,001 |
|
Días |
13,773 |
3 |
4,591 |
,905 |
0,111 |
|
Error |
8,885 |
6 |
1,481 |
|
|
|
Total |
178,386 |
12 |
|
|
|
|
A R2 = 0,950 (R2
corregida = - 0,90) (p ≤ 0,05). |
|||||
Caracterización de Ralstonia solanacearum en plantas con síntomas de
“Hereque” en la finca “El Roble”
En el
Cuadro 4, se puede detallar un total de
144 placas sembradas con R. solanacearum: 136 Gram positivas y 8 Gram negativas en
los diferentes órganos del plátano Hartón. En plantas con síntomas de la
enfermedad, la bacteria actúa de forma sistémica en los tejidos, encontrándose
tanto en hoja, seudotallo, cormo, colino e incluso en
plantas asintomáticas dentro de los pobos infectados con HRQ. Las pruebas en
medios con disacáridos y alcoholes hexosa proporcionaron indicio del biovar caracterizado al que corresponde la cepa aislada de
las plantas de la finca “El Roble”, el cual, se relaciona al biovar 3 de la raza 2 que afecta al genero
Musa.
|
Cuadro 4.
Identificación del Biovar de Ralstonia solanacearum con
empleo de disacáridos y alcoholes hexosa, en los órganos de la planta de
plátano hartón, Musa AAB en la
finca “El Roble”, límite del Municipio Alberto Adrianí
(Mérida) y Municipio Colón (Zulia), Sur del lago de Maracaibo. |
|||||||||||
|
Órgano |
Presencia de colonias rojizas: Ralstonia sp. |
Metabolismo: medios con hidratos de carbono y
alcoholes hexosa |
|
||||||||
|
Medio basal tetrazolio |
Maltosa |
Sorbitol |
Lactosa |
Manitol |
BIOVAR |
||||||
|
|
+ |
- |
+ |
- |
+ |
- |
+ |
- |
+ |
- |
|
|
Pobo
1 |
|
|
|
|
|
|
|
|
|
|
|
|
Hoja** |
9 |
0 |
3 |
|
3 |
|
3 |
|
3 |
|
3 |
|
Seudotallo* |
9 |
0 |
3 |
|
2 |
1 |
3 |
|
3 |
|
3 |
|
Cormo* |
9 |
0 |
3 |
|
2 |
1 |
3 |
|
3 |
|
3 |
|
Colino* |
9 |
0 |
3 |
|
2 |
1 |
3 |
|
3 |
|
3 |
|
Control
† |
11 |
1 |
|
|
|
|
|
|
|
|
|
|
Pobo
2 |
|
|
|
|
|
|
|
|
|
|
|
|
Hoja** |
9 |
0 |
3 |
|
3 |
|
3 |
|
2 |
1 |
3 |
|
Seudotallo* |
8 |
1 |
3 |
|
2 |
1 |
3 |
|
3 |
|
3 |
|
Cormo* |
9 |
0 |
2 |
1 |
3 |
|
3 |
|
2 |
1 |
3 |
|
Colino* |
8 |
1 |
3 |
|
3 |
|
3 |
|
2 |
1 |
3 |
|
Control
† |
10 |
2 |
|
|
|
|
|
|
|
|
|
|
Pobo
3 |
|
|
|
|
|
|
|
|
|
|
|
|
Hoja
** |
8 |
1 |
3 |
|
3 |
|
3 |
|
3 |
|
3 |
|
Seudotallo* |
9 |
0 |
3 |
|
2 |
1 |
3 |
|
2 |
1 |
3 |
|
Cormo** |
9 |
0 |
3 |
|
3 |
|
3 |
|
3 |
|
3 |
|
Colino* |
9 |
0 |
3 |
|
2 |
1 |
3 |
|
3 |
|
3 |
|
Control
† |
10 |
2 |
|
|
|
|
|
|
|
|
|
|
Total |
136 |
8 |
35 |
1 |
30 |
6 |
36 |
0 |
32 |
4 |
|
|
†
Planta asintomática dentro de la plantación con reporte de brotes de “Hereque”. ** Significativo (p ≤ 0,01) * Significativo (p ≤ 0,05) con datos transformados |
|||||||||||
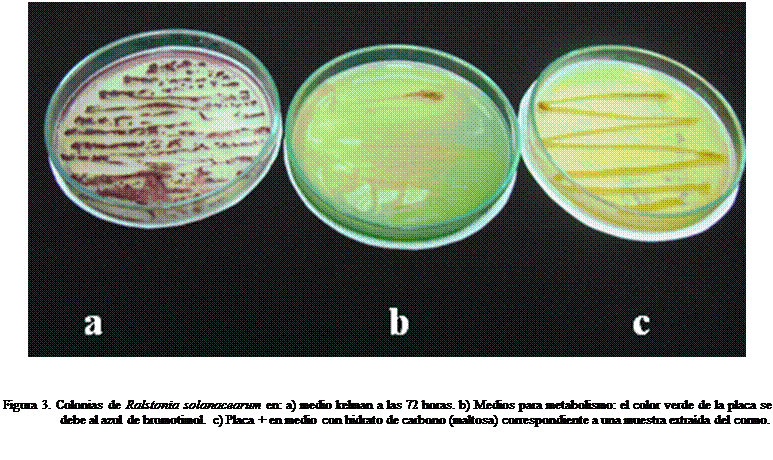
Las
pruebas en maltosa, sorbitol, lactosa y manitol dieron positivas en la mayoría
de las muestras tornándose las colonias
rojas a amarillas (Figura 3b y 3c). Por otro lado el control del medio con tetrazolio en siembra con Pseudomonas fluorescens un organismo cercano,
resultó negativo (Figura 3a), lo que demuestra la selectividad del medio. Resultados similares reportan investigadores
(Gómez et al., 2006; Denny y Haywart, 2001;
García et al., 1999; French et al., 1995; Kelman, 1954) que
trabajaron con una similar metodología para aislar e identificar los biovares de la bacteria, en
papa y musáceas respectivamente.
c b a a
Pruebas de patogenicidad de la bacteria en
plátano hartón
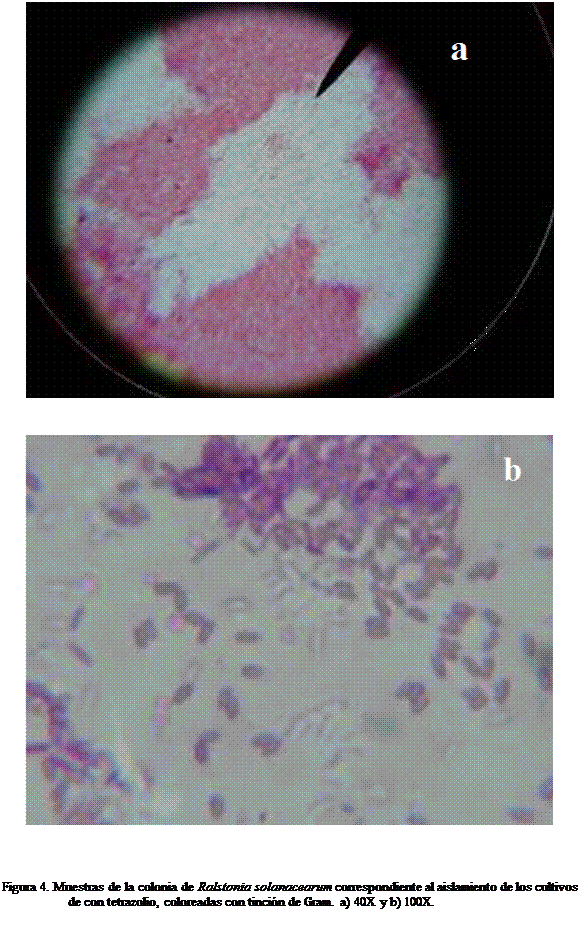
El color de las colonias en medio basal con tetrazolio después de las 72 horas postsiembra
de la bacteria tiende a presentar una coloración rojiza (Kelman,
1954) (Figura 3a, Figura 4a y 4b) la tinción de Gram clasifica a la colonia como Gram negativa, propio de muchas bacterias fitopatógenas.
R. solanacearum en su mayoría una vez que invade el tejido reside en los espacios
intercelulares con otros microorganismos (Hickichi et al., 2007; Sinohara
et al., 2005) y proliferan de manera
rápida invadiendo el citosol de la célula e
interactuando con su hospedante (French, 2006; Brencic
y Winams, 2005; Stackawicz,
2001) por sistemas de secreción tipo III y IV a través de la membrana y los
flagelos (González y Dreyfus,
2003; Valls et al., 2006; Liu et al., 2001;
Alfano y Coller, 1997) este mecanismo biológico
evidencia que Ralstonia
secreta proteínas que alteran la
fisiología de la célula de una gran gama de hospedantes incluyendo a Musa AAB (Bundenhagen,
1964).
Inoculación de la bacteria en plántulas
de plátano Hartón
Las colonias de R.
solanacearum aisladas de plantas enfermas en medio
selectivo con tetrazolio y sometidas a crecimiento en
medio King (activación) fueron infiltradas en plántulas sanas con poco éxito,
trabajos realizados por Gómez et al.,
(2006) reporta una concentración de 1x 108 UFC para reproducir la
enfermedad en condiciones de invernadero, sin embargo, cuando se transfirió el
extracto fresco de plantas enfermas
(EPE) Dilución 10-1 a plántulas sanas se observó la presencia de los
síntomas de marchitamiento a los 10 días acentuándose progresivamente hasta el
día 12 (Figura 5c), el marchitamiento gradual se percibió por primera vez en la
hoja infiltrada. Estos resultados indican que la patogenicidad
de la bacteria es inhibida por el ambiente in
vitro y la variabilidad genética tornándolas “avirulentas”
(Castillo y Greenberg, 2007; Robertson et al.,
2004) por otro lado French et al.,
(2006) alerta sobre esta propiedad de las colonias cultivadas y repicadas en
medios kelman, sugiriendo que la bacteria ocasiona
daño a la planta solo si interactúan los factores que la incitan a ser
patogénica a su hospedante.

40X 100X C4 C3
CONCLUSIONES
Los síntomas en las plantas enfermas de plátano Hartón
(Musa AAB) de la finca “El Roble” son
ocasionados por una cepa patogénica de R.
solanacearum, raza 2, biovar
3.
Se pudo demostrar que el porcentaje en la incidencia
de la enfermedad está correlacionado con los valores de precipitación
reportados para el periodo en que se realizaron las observaciones, la dinámica
entre el aumento de plantas con “Hereque” y los promedios de precipitación
mensual fue coincidente; en épocas lluviosas se
encuentra mayor cantidad de plantas afectadas.
Durante las observaciones en los 3 pobos, la
incidencia de la enfermedad se promedió baja, en el total de la plantación,
entre diciembre (2007) y marzo (2008), el brote de “Hereque” no sobrepasó el
umbral económico, no obstante, se manifestó como un riesgo latente, constante y
progresivo en el tiempo. La evidencia estadística propone que R. solanacearum
es perseverante en cada sector o “pobo” de la finca.
En plantas con síntomas de la enfermedad la presencia
de la bacteria es sistémica, se puede encontrar en hojas, pseudotallo,
cormo e hijos de manera simultánea, inclusive en plantas aparentemente sanas,
demostrando una gran dinámica en los mecanismos biológicos de R. solanacearum.
R. solanacearum
cuando crece y es mantenida o replicada varias veces en medios de cultivo con tetrazolio atenúa su grado de patogenicidad
y, de esta forma al ingresar en plantas sanas se comporta de manera “avirulenta”.
LITERATURA
CITADA
Alfano,
J. and A. Collmer. 1997. The Type III (Hrp)
Secretion Pathway of Plant Pathogenic Bacteria in: Trafficking Harpins, Avr Proteins, and Death. Journal of Bacteriology 179 (18):
5655-5662.
Allen,
C.; P. Prior and A. Hayward. 2004. Bacterial wilt disease and
the Ralstonia Solanacearum.
Species complex. St. Paul (Minnesota): APS Press.
Arenas, A.; D. López; D. Álvarez; G.
Llano y J. Loke. 2005. Efecto de prácticas ecológicas
sobre la población de Ralstonia solanacearum Smith, causante del Moko
del plátano. Fitopatologia Colombiana 28 (2): 76-80.
Belalcazar, S.; F. Rosales y L. Pocasangre.
2004. El “Moko” en el plátano y banano y el rol de las
plantas hospederas en su epidemiologia. Memorias de
Brencic,
A. and S. Winnams. 2005. Detection of and
response to signals involved in host-microbe interactions by plant-associated
bacteria. Microbiology and Molecular Biology Reviews 69 (1): 155-194.
Buddenhagen, I. W. 1961. Bacterial kilt
of bananas: History and known distribution. Tropical Agriculture 38: 107-121.
Buddenhagen,
I. W.; L. Sequeira and A. Kelman. 1962. Designation
of races in Pseudomonas solanacearum. Phytopathology 52: 726. (Abstract).
Buddenhagen,
I. W. and A. Kelman. 1964. Biological and
physiological aspects of bacterial wilt caused by Pseudomonas solanacearum. Annu.
Rev. Phytopathol. 2: 203-230.
Caruso, P.; J. Palomo, E. Bertolini, B. Álvarez,
M. López and E. Bioscan. 2005. Seasonal variation
of Ralstonia solanacearum
Biovar 2 populations in a Spanish river: Recovery
of stressed cells at low temperatures. Applied and Environmental Microbiology
71 (1): 140-148.
Castillo, J. and J.
Grennberg. 2007. Evolutionary dynamics
of Ralstonia solanacearum.
Applied and Environmental Microbiology 73 (4): 1225-1238.
Centro Internacional de Agricultura Tropical (CIAT). 2003. Memorias del Curso Manejo
integrado de la enfermedad del Moko del plátano.
CIAT, Cali, Junio
Delgado, E. y R. Paiva.
2001. Estudio del efecto de
Delgado,
M.; A. García, J. Nava, G. Carroz y F. Barboza. 1998. Diagnóstico técnico-socioeconómico de la zona
platanera subregión Sur del Lago de Maracaibo. Informe Técnico CORPOZULIA-FUSAGRI.
Denny, T. and A. Hayward.
De
Oliveira. E.; S. Silva, V. De Mello, S. Gasparotto and L. Rires de Boher. 2000. Evaluación de Musa spp. para
la resistencia a la enfermedad de Moko (Ralstonia solanacearum,
raza 2). Infomusa 9 (1): 19-20.
Food and Agriculture Organization (FAO). 2006. Datos agrícolas faostat. Disponible en línea en: http://faostat.fao.org/faostat/colletions?subset=agricultura&lenguaje.
Última visita 18/09/2008.
French,
E. 2006. Interaction between strains of Ralstonia solanacearum, its host and the
environment. CIP sección 10. 11 p.
French, E.; L. Gutarra,
P. Alley and J. Elphinstone. 1995. Culture media for Ralstonia solanacearum isolation, identification
and maintenence. Fitopatologia
Peruana 30 (3): 126-130.
Frison,
E. and S. Sharrock. 1988. The economic, social
and nutritional importance of banana in the World. Bananas and food security/Les productions bananieres: UN enjeu èconomique majeur pour la sècuritè alimentaire. International symposium, Douala, Cameroon, 10-14 November 1988.
INIBAP, Montpellier, France. p. 21-35.
García, R.; A. García y L. Delgado.
1999. Marchitez bacteriana del tomate
causada por el biovar 2-a, de Ralstonia solanacearum,
en algunas localidades del estado Mérida-Venezuela. Revista Forestal Venezolana 43 (2): 183-189.
Gómez. E.; E. Álvarez y
G. Llano. 2006. Identificación y caracterización de cepas de Ralstonia solanacearum,
raza 2, agente causal del moko de plátano en
Colombia. Fitopatología Colombiana 28 (2): 71-75.
González, B. y G. Dreyfus.
2003 Sistemas de secreción de proteínas
en las bacterias Gram negativas: biogénesis flagelar y translocación de factores
de virulencia. Reporte tecnico. UNAM, Facultad de Medicina.
Grey, B. and T. Steck. 2001. The viably
but nonculturable state of Ralstonia solanacearum may be involved in
long-term survival and plant infection. Applied and Environmental Microbiology
67 (9): 3866-3872.
Kloepper, J. W.; S. Tuzun, L. Liu and G. Wei. 1993. Plant
growth-promoting rhizobacteria as inducers of
systemic disease resistance. In “Pest
Management: Biologically based technologies”. R. D. Lumsden and
J. L. Waughn, Eds. p. 156-165. American Chem. Soc. Books, Washington, DC.
USA.
Hayward,
A. C. 1964. Characteristics of Pseudomonas solanacearum. J. Appli. Bacteriol. 27:
265-277.
Hayward,
A. C. 1991. Biology and epidemiology of bacterial wilt caused
by Pseudomonas solanacearum.
Annual Review of Phytophatology, 29: 64-87.
Hayward, A. C. 2006. Pudrición de las
frutas de banano causada por Ralstonia solanacearum, raza 2. Materias de nomenclatura,
transmisión y control. Infomusa 15 (1): 7- 11.
Hikichi, Y.; T. Yoshimochi,
S. Tsujimoto, R. Shinohara, K. Nakaho,
A. Kanda, A. Kiba and K. Ohnishis.
2007. Global regulation of patogenicity mechanism os Ralstonia solanacearum.
Plant Biotechnology 24: 149- 154.
Islam, T. and K. Toyota. 2004. Effect of
moisture conditions and pré-incubation at low temperature
on bacterial wilt of tomato caused by Ralstonia solanacearum. Microbes of Environments 19 (3): 244-247.
Kelman, A. 1954. The relationship of pathogenicity in Ralstonia solanacearum
to colony. appearance on a tetrazolium medium. Phytopathology (44): 693.
Liu,
H.; Y. Kang, S. Genin, M. Schell and T. Denny.
2001. Twitching motility of Ralstonia solanacearum requires a type IV pilus
system. Microbiology 147: 3215-3229.
Ministerio de Agricultura y Tierras (MAT).
1997. Censo Agrícola.
Dependencia Santa Bárbara del Zulia.
Nava, C. 1989. Problemática del cultivo de plátano en
Venezuela: Memorias IX Reunión ACORBAT. Mérida. Venezuela. p. 643-653.
Park, K.; D. Paul, Y. K.
Kim, K. W. Nam, Y. Lee, H. Choi and S. Lee. (2007).
Induced Systemic Resistance by Bacillus
vallismortis EXTN-1 Suppressed Bacterial Wilt in
Tomato Caused by Ralstonia solanacearum. Plant Pathol.
J. 23 (1): 22-25.
Poussier,
S.; P. Thoquet, M. Trigalet,
S. Barthet, D. Meyer, M. Arlat
and A. Trigalet. 2003. Host plant-dependent phenotypic reversion of Ralstonia
solanacearum from non-pathogenic to pathogenic
forms via alterations in the
phcA gene. Molecular
Microbiology 49 (4): 991-1000.
Robertson, A.; W. Wetchter, T. Denny, B. Forthum and D. Kluepfel. 2004. Relahionship between avirulence
gene (avrA) Diversity en Ralstonia solacearum and bacteria wilt incidence.
Molecular Plant-Microbe Interactions 17 (12): 1376-1384.
Rorer,
J. B.
Salanoubat, M.; S. Genin, F. Artiguenave, J. Gouzy, S. Mangenot, M. Arlat, A. Billault, P. Brottier, J. C.
Camus, L. Cattolico, M. Chandler, N. Choisne, C. Claudel Renard, S. Cunnac, N. Demange, C. Gaspin, M. Lavie, A. Moisan, C. Robert, W. Saurin, T. Schiex, P. Siguier, P. Thébault, M. Whalen, P. Wincker, M. Levy, J. Weissenbach and C. A. Boucher. 2002. Genome sequence of the plant
pathogen Ralstonia solanacearum. Nature
415: 497-502.
Sáez, V. y C. Rivas. 1992. Zonificación
agroclimática de cultivos en la región Sur del Lago de Maracaibo (Estado
Zulia). MARNR. 108 p.
Sinohara,
R.; A. Kanda, K. Ohnishi, A. Kiba and Y. Hickichi. 2005. Contribution of folate
biosynthesis to Ralstonia solanacearum
proliferation in intercellular spaces. Applied and Environmental Microbiology
71 (1): 417–422.
Staskawicz,
B. 2001. Genetics of plant-pathogen interaction specifying
plant disease resistance. Plant Physiology 125: 73-76.
Stover, R. H. 1972. Banana, Plantain and Abaca Disease.
Commonwealth Mycological Institute, Kew, England. 316 p.
Takatsu, A. 1986. Ricos e consequencias da diseminacao do moko para outras regioes do
Brasil. p. 54-
Thwaites,
R.; S. Eden Green and R. Black. 1999. Diseases caused by bacteria. In: Diseases of Banana, Abacá and Enset. Editor David R.
Jones. p. 213-238.
Trujillo, G. 1998. Fundamentos de bacterias fitopatógenas. Revista Alcance de
Valls, M.; S. P. Genin and C. Boucher.
2006. Integrated regulation of the type iii secretion system and other
virulence determinants in Ralstonia solanacearum. Plos Pathogens
2 (8): 798-807.
Yu, Q.; M. Alvarez, P. Moore, F. Zee, M. Kim, A. Silva, P. Hepperly
and R. Ming. 2003. Molecular diversity of Ralstonia solanacearum isolated from gingerin
Hawai. Bacteriology 93 (9): 1124- 1130.
Página diseñada por Prof. Jesús Rafael
Méndez Natera
TABLA DE CONTENIDO DE LA REVISTA CIENTÍFICA UDO
AGRÍCOLA



