Revista Científica UDO Agrícola Volumen 9.
Número 2. Año 2009. Páginas: 327-332
Cultivo de
microesquejes de parchita (Passiflora
edulis Sims f. flavicarpa Deg.)
Microcutting culture of
passionfruit (Passiflora edulis Sims f. flavicarpa Deg.)
Maribel
RAMÍREZ VILLALOBOS ![]() 1, Teresa Edith VARGAS2
y Eva DE GARCÍA2
1, Teresa Edith VARGAS2
y Eva DE GARCÍA2
1Laboratorio de Cultivo de Tejidos, Instituto de Investigaciones
Agronómicas, Departamento de Botánica. Facultad de Agronomía, Universidad del
Zulia. Apartado 15205. ZU4005. Maracaibo, estado Zulia, Venezuela y 2Laboratorio
de Biotecnología Vegetal, Centro de Botánica Tropical, Instituto de Biología
Experimental. Facultad de Ciencias. Universidad Central de Venezuela. Apartado
47114. Los Chaguaramos, Caracas 1041, Venezuela. E-mails:
mcramire2008@yahoo.com y mcramire@cantv.net ![]() Autor para
correspondencia
Autor para
correspondencia
|
Recibido: 30/05/2008 |
Fin
de primer arbitraje: 05/03/2009 |
Primera
revisión recibida: 27/05/2009 |
|
Fin de segundo arbitraje: 17/07/2009 |
Segunda revisión recibida: 30/09/2009 |
Aceptado: 05/10/2009 |
RESUMEN
La fruta de la parchita
(Passiflora edulis Sims f. flavicarpa Deg.) es de gran
importancia por sus múltiples usos como fruta fresca y en la agroindustria, y
por su jugo que es rico en minerales (calcio y fósforo) y vitaminas (A y C).
Este trabajo tuvo como objetivo evaluar el
efecto de la benciladenina (BA) y de agentes gelificantes sobre la brotación de
microesquejes de parchita. Las concentraciones de BA correspondieron a 0 y 2
mg/L y los agentes gelificantes agar-agar (7 y 9 g/L) y gelrite (2 g/L).
Transcurridos treinta días de cultivo todos los tratamientos produjeron 100% de
explantes brotados y enraizados, encontrándose diferencias significativas
(P<0,05) sólo en el número de brotes por explante. El cultivo de
microesquejes en medio nutritivo con 2 mg/L de BA y solidificado con 7 g/L de
agar-agar presentó el máximo número de brotes por explante (5,9). Los
microesquejes presentaron alta respuesta de brotación, lo que muestra el
potencial de este explante para el establecimiento de un sistema de propagación
clonal in vitro de la parchita.
Palabras clave:
Benciladenina, agar-agar, gelrite, microesquejes, brotación.
ABSTRACT
Passionfruit (Passiflora edulis Sims f. flavicarpa
Deg.) is of great importance by its multiple uses as fresh fruit
and in agroindustry, because its juice is rich in minerals (calcium and
phosphorus) and vitamins (A and C). The objective of the present work was to
evaluate the effect of the benziladenine (BA) and the solidifying agents, on
the sprout of passionfruit
microcuttings. The two concentrations of BA corresponded to 0 and 2 mg/L and
the solidifying agents were agar-agar (7 and 9 g/L) and gelrite (2 g/L). After
thirty days of culture in all the treatments explants produced 100% of sprouted
and rooted explants, being significant differences (P< 0.05) only in the
number of buds by explants. Microcuttings growing culture medium with 2 mg/L of
BA and solidified with 7 g/L of agar-agar displayed the maximum number of
sprout for explant (5, 9). Microcuttings showed a high efficient sprouting
demonstrated the potential of this explant for the establishment of a system
for in vitro clonal propagation of
passionfruit.
Key words: benziladenine,
agar-agar, gelrite, microcuttings, sprouting.
INTRODUCCIÓN
Passiflora
edulis Sims f. flavicarpa Deg.(Parchita) nativa de Brasil es una
variedad botánica de
La parchita en especial es un cultivo de gran
importancia económica y social en países tropicales y subtropicales del mundo
debido a que representa fuente de alimento, empleo y divisas, y por sus
múltiples usos como frutal, ornamental y propiedades medicinales (Nhut et al., 2007). Este especie ha sido
utilizada como sedativo, diurético, antidiarreico, estimulante, tónico, así
como tratamiento para la hipertensión, síntomas menopáusicos, cólicos de
infantes en Sur América (Dhawan et al.,
2004). Los extractos acuosos de las
hojas y fracciones derivadas (residuo acuoso y butanólico) han mostrado acción
anti-inflamatoria en modelos experimentales in
vitro y ex vivo (Pizzetti et al., 2007). En estos extractos
también se ha verificado la actividad antioxidante in vitro y ex vivo, la
cual se ha correlacionado con compuestos fenólicos (Rudnicki et al., 2007).
Los principales países productores de parchita son
Brasil, Colombia, Ecuador y Perú, los cuales aportan el 90% de la producción
mundial. Venezuela es otro país considerado importante con una superficie de
1000 ha y producción entre 15.000 y 20.000 t/año (Schwentesius y Gómez, 2005).
Esta producción se encuentra distribuida en los estados Zulia, Mérida, Barinas,
Cojedes, Aragua, Carabobo, Apure, Táchira, Monagas y Yaracuy, y está destinada
para la industria de jugos y concentrados, que tienen gran aceptación en el
mercado nacional. El cultivo de la parchita en Venezuela se ha incrementado en
los últimos años, debido al aumento de la demanda de la fruta y a la notoriedad
como cultivo de exportación, lo que ha motivado que muchos productores se
interesen en su siembra (Pérez et al.,
2005).
La parchita es una de las frutas más apetecidas y
apreciadas por su excelente sabor y aroma, tanto para consumo fresco como para
la agroindustria de jugos, concentrados, refrescos, vinos, helados, dulces,
entre otros. La cáscara del fruto (50% del peso total) deshidratada se utiliza
como suplemento alimenticio animal, y las semillas contienen 10% de proteína y
20% de aceite comestible (Avilán et al.,
1992). El jugo de la fruta es rico en hidratos de carbono (2,4 g/100 ml), calcio
(5 mg/100 ml), fósforo (17 mg/100 ml), vitamina A (648 mg/100 ml), vitamina C
(20 mg/100 ml) y vitamina B2 (0,1 mg /100 ml), y además presenta cualidades
farmacológicas como sedativo y antiespasmódico (Ruggiero et al., 1996).
La mayoría de las plantaciones comerciales de parchita
se establecen con plántulas obtenidas de semillas, lo cual genera variabilidad
genética (Avilán et al., 1992; Pérez et al., 2005). Esta situación aunada a
la vida útil de producción del cultivo, que es muy corta debido a la presencia
de plagas y enfermedades (Avilán et al.,
1992), crea la necesidad de la micropropagación de cultivares seleccionados
sobresalientes con alto rendimiento libres de enfermedades (Isutsa, 2004),
mediante un manejo integrado que podría incluir la microinjertación (Monteiro,
2009).
La
aplicación de la biotecnología en los programas de mejoramiento genético de la
parchita requiere de metodologías específicas que permitan regenerar plantas in vitro, la eliminación de patógenos, la
micropropagación rápida de líneas superiores y la transformación de plantas.
Adicionalmente, estas metodologías contribuirían en la implementación de bancos
de germoplasma evitando la extinción de muchas especies, cuyo hábitat se
encuentra amenazado (Rodríguez y Perea, 2001). El cultivo de microesquejes es
un método sencillo, natural y seguro, sin problemas de mutaciones, debido a que
permite la formación de un tallo con hojas y yemas en sus axilas a partir de la
estimulación del desarrollo de la yema o las yemas que se encuentran presentes
en el nudo del explante original (Hartmann y Kester, 2001).
Los sistemas de cultivo de tejido dependen del
equilibrio de una serie de factores tales como reguladores del crecimiento, la
luz, la temperatura, el pH, los nutrientes, el agente gelificante, entre otros
(Monteiro et al., 2000; Hartmann y
Kester, 2001; Azadi et al., 2007). En
otras especies se ha encontrado que los agentes gelificantes tienen un marcado
efecto sobre la brotación y el enraizamiento (Zsabados et al., 1993; Azadi et al.,
2007).
Las citoquininas tienen gran importancia económica
sobre todo en la industria de la micropropagación, la cual está basada en la
capacidad de las citoquininas, solas o en combinación con las auxinas para
promover la brotación de las yemas axilares (Segura, 2000). Varios trabajos en
parchita reportan el efecto benéfico de las citoquininas en la formación de
brotes en explantes cultivados in vitro
(Casarrubias et al., 2001; Isutsa,
2004). Dada la importancia de la parchita para el país en esta investigación se
evaluó el efecto de la benciladenina y agentes gelificantes sobre la brotación
de microesquejes de parchita cultivados in
vitro.
MATERIALES Y MÉTODOS
En esta investigación se utilizaron 60 plántulas de
parchitas (Passiflora edulis Sims f. flavicarpa Deg.) de cuatro
meses de edad cultivadas en macetas bajo condiciones de umbráculo en el
Laboratorio de Biotecnología Vegetal del Instituto de Biología Experimental,
Universidad Central de Venezuela. De cada plántula se recolectó el brote
terminal de
Luego bajo condiciones asépticas, en la cámara de
flujo laminar, se realizaron tres enjuagues con agua destilada esterilizada y
se procedió a cortar microesquejes semiduros, de un centímetro de largo y con
una yema axilar, correspondientes entre la tercera y sexta posición con
respecto al ápice del brote. La siembra de los explantes se hizo en frascos de
vidrio (
Se utilizó un diseño
experimental totalmente al azar con cinco repeticiones y seis explantes como
unidad experimental. A los 30 días de cultivo se evaluaron las variables de
estudio porcentajes de explantes contaminados (PEC), viables (PEV), brotados
(PEB) y número de brotes (mayores de
RESULTADOS Y DISCUSIÓN
En esta investigación se obtuvo 91,3% de explantes
viables, libres de contaminación y sin problemas de ennegrecimiento u oxidación
de los tejidos, a los 30 días de cultivo. En todos los tratamientos se obtuvo
100% de explantes brotados y enraizados, sin embargo se encontraron diferencias
significativas (p ≤ 0,05) para el número de brotes por explante (Figuras
1 y 2). El cultivo de microesquejes en medio MS con 2 mg/L de BA y solidificado
con 7 g/L de agar-agar permitió el máximo número de brotes por explante (Figura
1). Este tratamiento también se caracterizó por alcanzar 100% de explantes
brotados a los siete días de cultivo, mientras que en los otros tratamientos
dicha inducción ocurrió aproximadamente a los quince días.
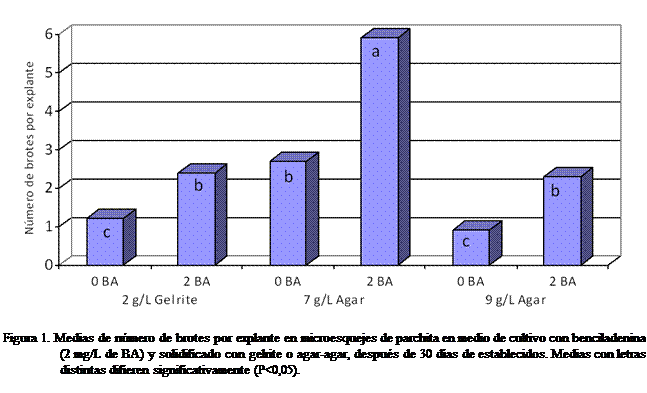

Los microesquejes cultivados en medio MS sin BA y
solidificado con 7 g/L de agar-agar mostraron bajo número de brotes por explantes,
respuesta muy parecida a la de aquellos microesquejes en medios con BA y
solidificados con 2 g/L de gelrite ó 9 g/L de agar-agar. El alto porcentaje de
explantes brotados y enraizados logrado en todos los tratamientos de esta
investigación evidenció que los microesquejes de parchita son explantes ideales
para la micropropagación de esta especie. La alta respuesta de brotación
obtenida se relaciona al regulador del crecimiento BA, que promueve la división
celular y la proliferación de yemas, entre otros (Taiz y Zeiger, 2002, Raven et al., 2005).
Existen pocas investigaciones en microesquejes de
parchita, algunas de ellas señalan el potencial de este tipo de explante para
la multiplicación in vitro de dicha
especie, en medio de cultivo: Nitsch con 2 mg/L de cinetina (Moran, 1978), MS
más 1 a 2 mg/L de BA (Biasi et al.,
2000), MS con 3 mg/L de BA (Monteiro et
al., 2000) y MS con 2 a 3 mg/L de BA (Rodríguez y Perea, 2001). Sin embargo
estos trabajos no presentan porcentajes de microesquejes viables, brotados y
enraizados. En otras Passifloras como P.
alata se reporta un 82 % de microesquejes con brotes en medio WPM (Mc Cown
y Lloid) suplementado con 2 mg/L de BA (Rodríguez et al., 2007).
En esta investigación todos los microesquejes de
parchita desarrollaron varios brotes y produjeron raíces en el medio nutritivo
MS (1962) con o sin BA (2 mg/L) (Figura 1). En otros tipos de explantes de
parchita como segmentos internodales se ha logrado la formación de brotes
cuando se cultivaron en MS con 1 a 2 mg/L de BA y enraizaron en medio sin
reguladores de crecimiento (Biasi et al.,
2000). En yemas apicales del vástago se indica la formación de brotes múltiples
al implantar las yemas en medio MS más 5 mg/L de BA (Isutsa, 2004), o bien en
0,45, 1,13 y 4,5 mg/L de BA y el enraizamiento de los microesquejes en MS con o
sin BA, pero añadiéndole 0,35 mg/L de AIA, (Faria y Segura, 1997).
El efecto favorable de las citocininas sobre la
formación de vástagos en parchita también se ha observado para yemas axilares (43%
de brotación de las yemas) cultivadas en medio MS con 2 mg/L de cinetina
(Moran, 1978), en cotiledones de parchita en medio MS suplementado con 2,25
mg/L de BA y agua de coco al 10% (12,1 brotes/explante) (Hall et al., 2000) y en secciones de hojas en
medio MS con 0,6 mg/L de BA (44% de explantes con brotes) (Otahola, 2000) y en
MS con 1 y 1,5 mg/L de BA (47,5 y 60% de las secciones foliares) (Trevisan y
Mendes, 2005).
Es posible que en el tratamiento de 2 mg/L de BA y 7
g/L de agar-agar evaluado en parchita permitiera una incorporación más rápida
de la benciladenina y los componentes del medio de cultivo en los explantes.
Los medios de cultivo con o sin BA solidificados con 9 g/L de agar-agar ó 2 g/L
de gelrite presentaron bajo número de brotes por explante (Figura 1). Al
comparar estos resultados con los reportados en otras investigaciones en
parchita, se encontró que no hay datos relacionados con el efecto de agentes
gelificantes sobre la brotación de los explante. En otras especies como la rosa
(Rosa hybrida cv. `Rafaela`) se ha
obtenido un mayor número de brotes por explantes cuando se disminuye la
concentración de agar a 4,4 g/L (Azadi et
al., 2007); y en yuca (Manihot
esculenta) el gelrite, comparado con el agar, permitió un mayor crecimiento
en microesquejes (Zsabados et al.,
1993).
CONCLUSIÓN
El cultivo de microesquejes de parchita en medio
nutritivo MS (1962) con 2 mg/L de BA y solidificado con 7 g/L de agar-agar
permitió a los treinta días de cultivo in
vitro 100% de explantes brotados y enraizados, y 5,9 brotes por explante.
Los microesquejes presentaron alta respuesta de brotación, lo que muestra el
potencial de este explante para el establecimiento de un sistema de propagación
clonal in vitro de la parchita, así
como su uso para la microinjertación.
LITERATURA CITADA
Avilán, L.; F. Leal y D. Bautista. 1992.
Manual de Fruticultura. Principios y
manejo de la producción. Segunda Edición. Editorial América C. A. Caracas,
Venezuela. 1467 p.
Azadi, P.; E.
Khosh, E. Beyramizadeh and H. Bagheri. 2007. Optimization of factors affecting
in vitro proliferation and rooting of Rosa
hybrida L. cv. `Rafaela´. International Journal of Agricultural Research 2:
626-631.
Biasi, L.; M.
Falco, A. Rodriguezand and B. Mendes. 2000. Organogenesis
from intermodal segments of yellow passion fruit (Passiflora edulis f. flavicarpa).
Scientia Agricola (Piracicaba, Braz.) 57: 661-665.
Bisalacchi, H.; C. Severin, M. Gattuso, A. Aguirre,
O. Di Sapio y S. Gattuso. 2008. Cultivo a campo de Passiflora caerulea L. micropropagada: estudios histológicos y
químicos. BLACPMA 7: 257-263.
Casarrubias,
G.; M. Delgado, J. Vara, R. Suárez y J. Rascado. 2001. Propagación in vitro de maracuyá (Passiflora edulis var. flavicarpa) utilizando diferentes
concentraciones de auxinas, citoquininas y giberelinas. Horticultura Mexicana
8: 87.
Dhawan, K.; S. Dhawan and A. Sharma. 2004. Passiflora: a review update. Journal of
Ethnopharmacology 94: 1–23
Faria, J. and J. Segura. 1997. Micropropagation of
yellow passionfruit by axillary bud proliferation. HortScience 32: 1276-1277.
Guzzo, F.; S. Ceoldo, F. Andreetta and M. Levi. 2004. In vitro culture from mature seeds of Passiflora species. Scientia
Agricola (Piracicaba, Braz.) 61:
108-113.
Hall,
R.; R. Drew, C. Higgins and R. Dietzgen. 2000. Efficient organogenesis of an
Australian passionfruit hybrib (Passiflora
edulis x Passiflora edulis fv. flavicarpa) suitable for gene delivery.
Australian Journal of Botany 48: 673-680.
Hartmann, H. y D. Kester. 2001. Propagación de Plantas.
Principios y Prácticas. Octava Reimpresión. Editorial Continental. México. 760
p.
Isutsa,
D. 2004. Rapid micropropagation of passion fruit (Passiflora edulis Sims.) varieties. Scientia Horticulturae 99:
395-400.
Monteiro, A.; E. Higashi, A. Gonçalves
and A. Rodríguez.
Monteiro, L. 2009. Técnicas de cultivo in vitro e microenxertia ex
vitro visando a eliminação do Cowpea Aphid-Borne Mosaic virus em
Maracujazeiro-Azedo. http://bdtd.bce.unb.br/
tedesimplificado/tde_busca/arquivo.php?codArquivo=976. (15/03/2009).
Moran,
M. 1978. Multiplication
végétative, in vitro, des bourgeons
axillaires de Passiflora edulis var.
flavicarpa Degener et de P. mollisima Bailey. Fruits 33: 693-699.
Murashige, T. and F. Skoog.
1962. A revised medium for rapid growth and bioassays with tobacco tissue.
Physiologia Plantarum 15: 473-497.
Nhut, D.; B. Khiet, N. Thi, D. Thuy, N. Duy, N. Hai and
P. Huyen. 2007. High frequency shoot formation of yellow passion fruit (Passiflora edulis f. flavicarpa) via thin cell layer (TCL) technology. In: 417-426. Protocols for
micropropagation of Wood tres and fruits. Editor Springer Netherlands. Part 2.
http://springerlink.com/context/ v36414616283k7u0/(17/3/2009).
Otahola, V. 2000. Regeneración de plantas de parchita (Passiflora edulis f. flavicarpa) a partir del cultivo de discos de hojas. Bioagro 12:
71-74.
Pérez, C. 2005. Técnicas Estadísticas con SPSS 12.
Aplicaciones al análisis de datos. Madrid. Editorial Pearson Prentice Hall, Pearson
Educación, S.A., 802 p.
Pérez, S., M.
Delis y L. Rosales. 2005. Prepare sus viveros de parchita: asegure plantas
sanas y de calidad, de rápido establecimiento y desarrollo del cultivo. Revista
Digital CENIAP Hoy 7, Aragua Venezuela. url: www.ceniap.gov.ve/ceniaphoy/
articulos/n7/arti/perezd/arti/perez d.htm (17/3/2009).
Pizzetti, J.; A. Montanher, S. Zucolotto, E. Schenkel and T. Frode.
2007. Evaluation of the anti-inflammatory efficacy of Passiflora edulis. Food Chemistry 104: 1097-1105.
Raven, P.; R. Evert and S. Eichhorn. 2005. Biology of plants. Seventh
edition. New York. W.H. Freeman and Company Publishers. 686 p.
Rodríguez, M.; C. Severín, G. Giubileo, M. Gattuso, L. Pulido, O. Di
Sapio y S. Gattuso. 2007. Cultivo in
vitro de Passiflora alata, una
forma de conservación genética. Actas de Horticultura 48: 69-72.
Rodríguez, R. y M. Perea. 2001.
Morfogénesis in vitro de Passifloras.
In: p. 177-183. Biotecnología
Agrícola. Un enfoque hacia el mejoramiento de plantas. M. Perea Dallos (ed.).
Editora Guadalupe LTDA, Colombia.
Rudnicki, M.; M. de Oliveira, T. Pereira, F. Reginatto, F. Dal-Pizzol
and J. Fonseca. 2007. Antioxidant and antiglycation properties of Passiflora alata and Passiflora edulis extracts. Food
Chemistry 100: 719–724.
Ruggiero, C.; A. São José, C. Volpe, J.
De Oliveira, J. Durigan, J. Baumgartner, J. Da Silva, K. Nakamura, M. Ferreira,
R. Kavati e V. Pereira. 1996. Maracajá para exportação: Aspectos técnicos da
produção. Ministerio da Agricultura, do Abastecimento e da Reforma Agrária.
Programa de Apoio à produçãoo e exportação de frutas, hortaliças, flores e
plantas ornamentais. EMBRAPA – SPI, Brasil. 64 p.
Schwentesius, R. y M. Gómez. 2005.
Mercado mundial del maracuyá. Revista sobre desarrollo sustentable en México y
América Latina. http://vinculado.org/mercado_maracuya.html (17/3/2009).
Segura, J. 2000. Introducción al
desarrollo. Concepto de hormona vegetal. In:
p. 305-323. J. Azcón y M. Bieto (Eds). Fundamentos de fisiología vegetal.
Primera Edición. McGraw-Hill/Interamericana de España, S.A.U. Edicions
Universitat de Barcelona.
Taiz, L. and E. Zeiger. 2002. Plant
physiology. Third Edition. Sinauer Associates, Inc. Publishers, Sunderland Massachussets. 690 p.
Trevisan, F. and B. Mendes. 2005. Optimization of in vitro organogenesis in passion fruit Passiflora edulis f.
flavicarpa. Scientia Agricola
(Piracicaba Braz.) 62 : 346-350.
Zsabados, L.; V. Núñez, L. Tello, G. Mafla, J. Roa y W.
Roca. 1993. Agentes gelatinizadores en el cultivo de tejidos. In: 79-93. Cultivo de tejidos en la
agricultura. Fundamentos y aplicaciones. W. Roca y L. Mroginski (eds). Centro
Internacional de Agricultura Tropical (CIAT) No. 151. Calí, Colombia.
Página diseñada por Prof. Jesús Rafael
Méndez Natera
TABLA DE CONTENIDO DE LA REVISTA CIENTÍFICA UDO
AGRÍCOLA



