Revista Científica UDO Agrícola Volumen 9.
Número 2. Año 2009. Páginas: 414-420
Temperatura base in vitro de Colletotrichum gloeosporioides Penz aislado de frutos de aguacate (Persea americana Mill.) cv. Hass en
Michoacán, México
In
vitro base temperature of Colletotrichum gloeosporioides
Penz isolated from avocado (Persea
americana Mill.) fruits cv. Hass in Michoacán, México
José Luciano MORALES GARCÍA![]() 1, María del Pilar RODRÍGUEZ GUZMÁN2,
Hilda Susana AZPÍROZ RIVERO3 y Martha Elena PEDRAZA SANTOS1
1, María del Pilar RODRÍGUEZ GUZMÁN2,
Hilda Susana AZPÍROZ RIVERO3 y Martha Elena PEDRAZA SANTOS1
1Facultad
de Agrobiología “Presidente Juárez” Universidad Michoacana de San Nicolás de
Hidalgo, México, 2Instituto de Fitosanidad, Colegio de
Postgraduados. Especialidad en Fitopatología. 56230, Montecillo, Texcoco,
México y 3Instituto Nacional de Investigaciones Forestales,
Agricolas y Pecuarias (INIFAP). Campo Experimental Valle de México. km 18,5
Carretera Los Reyes-Lechería, Chapingo, Texcoco, México. E-mails: jluciano@umich.mx y
jluciano@prodigy.net.mx ![]() Autor para
correspondencia
Autor para
correspondencia
|
Recibido: 31/01/2009 |
Fin
de primer arbitraje: 13/03/2009 |
|
Primera
revisión recibida: 11/08/2009 |
Aceptado: 12/08/2009 |
RESUMEN
Entre
los factores fitopatológicos que más limitan la exportación, se encuentran la
antracnosis y la roña, distribuidas en todos los municipios de Michoacán,
México, donde se cultiva aguacate. El objetivo fue determinar la temperatura base a partir de la cual se desarrolla el hongo C. gloeosporioides bajo condiciones de
laboratorio y su relación con las infecciones que se presentan en frutos de
aguacate en el campo. Los cultivos monoconidiales se derivaron de aislamientos
de frutos de aguacate con síntomas de antracnosis, colectados en diferentes
municipios e incubados a 4, 7, 8, 9, 10, 13, 15, 16, 18, 24, 27, 30 y 40 °C. Se
seleccionaron cinco frutos, en cada uno se registró el número de infecciones
nuevas. La temperatura base de Colletotrichum
gloeosporioides cultivado en PDA fue de
Palabras clave:
Hongo, tasa de crecimiento,
antracnosis
ABSTRACT
Among the phytophatological factors constraining
export are anthracnose and scab, distributed in all municipalities in
Michoacan, Mexico, where avocados are grown. The objective was to determine the
base temperature from which the fungus Colletotrichum
gloeosporioides develops under laboratory conditions and its relationship
to infections occurring in avocado fruits in the field. Monoconidial cultures
were derived from isolates of avocado fruits with anthracnose symptoms,
collected in different municipalities and incubated at 4, 7, 8, 9, 10, 13, 15,
16, 18, 24, 27, 30 and 40 ° C. Five fruits were selected and the number of new
infections was recorded in each fruit. The base temperature of C. gloeosporioides grown on PDA was 8 °C
(growth rate, r = 0.015), its optimum grow was at 24 °C (r = 0.24) followed by
16 and 18 °C (r = 0.18) and 27 ºC (r = 0.17). Fungus did not grow at 4 and 40
°C. In the field, there were no fruit injuries when the mean temperature was
below 14 °C, the same happened when the temperature exceeded 18.9 °C. It was
also observed that mean temperatures over 15 °C increased the number of
injuries and between 15.4 and 17.9 °C showed the greatest number of injuries.
Key words: Fungus, growth
rate, anthracnose
INTRODUCCIÓN
Entre los factores fitopatológicos que más limitan la
exportación, se encuentran la antracnosis y la roña, distribuidas en todos los municipios
de Michoacán, México, donde se cultiva aguacate (USDA, 1997; Lázaro, 1985; Morales y Vidales, 1994; Téliz, 1999).
El hongo Colletotrichum gloeosporioides afecta al
fruto en cualquier etapa de su desarrollo, traslado, almacenaje y comercialización.
Una humedad relativa de 85-90%, temperaturas de 18-
Los umbrales inferior y superior para el desarrollo de
una especie son dos parámetros base para determinar el efecto de la temperatura sobre el crecimiento y desarrollo
de los organismos (Wilson y Barnett, 1983). Por esta
razón es de gran importancia la
determinación de la temperatura base del cultivo y/o del patógeno en estudio
epidemiológico (Dieckmann, 1992). Un ejemplo de este aspecto es el modelo
basado en los días grado que se
desarrolló para predecir la
aparición de las primeras lesiones de
tizón temprano (Alternaria solani)
en follaje de papa en dos áreas productoras en Colorado, E.U.A. El
modelo, basado en la acumulación de días
grados arriba de
Dos modelos basados en el cálculo de días grados se
desarrollaron para predecir la aparición en la primavera de la primera
infección sistémica de Pseudoperonospora
humili en retoños de lúpulo (Humulus lupulus L), en plantaciones comerciales de grupos de cultivares
en el Valle Yakima de Washington. Uno de los modelos se basó en el total de días-grado acumulados cuando
la temperatura ambiental estaba sobre 6.5 °C. Un segundo modelo se desarrolló
considerando la misma temperatura (
El objetivo fue determinar la temperatura base a partir de la cual se desarrolla el hongo C. gloeosporioides bajo condiciones de
laboratorio y su relación con las infecciones que se presentan en frutos de
aguacate en el campo.
MATERIALES Y MÉTODOS
Colletotrichum
gloeosporioides se aisló en medio de
cultivo papa dextrosa agar (PDA) de frutos de aguacate con síntomas de
antracnosis. Cinco cultivos monoconidiales se seleccionaron por su color y
velocidad de crecimiento. Las cápsulas de Petri con cada uno de los cinco
monoconidiales se incubaron a 13 diferentes temperaturas: 4, 7, 8, 9, 10, 13, 15,
16, 18, 24, 27, 30 y
Posteriormente, se procedió a homologar todas las
tasas de crecimiento al modelo monomolecular debido a que la mayoría de las
curvas se ajustaron a este modelo, para ello se utilizó el parámetro Rho (tasa absoluta media ponderada) el cual permitió
encontrar las tasas (r) equivalentes. Luego estas se sometieron a un análisis
de varianza y a la prueba de separación múltiple de medias de Tukey con la
finalidad de definir su significación.
La homologación de las tasas de crecimiento se realizó
a través de parámetro Rho (ρ)
(Richards, 1959; Campbell y Madden, 1990):
![]()
Donde: r = tasa de cambio de cada modelo, m = 0 para el modelo Monomolecular, m = 1
para el modelo de Gompertz, m = 2 para el modelo Logístico.
Para encontrar la tasa de cambio equivalente de cada
modelo, se despejó r de la formula anterior:
![]()
((mx2) + 2) . (Rho) = r
Por lo tanto:
r M = ((mx2) + 2) . (Rho)
En un huerto de
aguacate ubicado en San Juan Nuevo, Michoacán, se seleccionaron cuatro árboles,
de cada uno de ellos se seleccionaron cinco frutos al azar por cada uno de los
puntos cardinales (20 frutos/árbol), colocándoles una cinta de plástico para
identificar al fruto con un número
y registrar la ubicación del árbol y del
fruto en el árbol. De cada fruto se registró el número de infecciones nuevas
marcándolas con un marcador rojo indeleble a fin de no confundirlas con las que
aparecerían en el siguiente muestreo. En dicho huerto se colocó una estación
climática automatizada (Weather Monitor II - Davis Instruments), la cual se
programó para monitorear el ambiente cada hora y registrar las medias diarias.
Las variables climáticas registradas fueron temperatura máxima, media y mínima, precipitación, velocidad y dirección
del viento. Para fines de este estudio se usaron las medias mensuales de las
variables climatológicas. El monitoreo de C.
gloeosporioides se realizó usando una trampa volumétrica de esporas con
registro para siete días, ubicándola en
medio de cuatro árboles y cerca de una fuente de corriente eléctrica
(Gadoury and MacHardy, 1983 modificada por
Morales, 1996). Las esporas se capturaron en una mica adherible de
RESULTADOS Y DISCUSIÓN
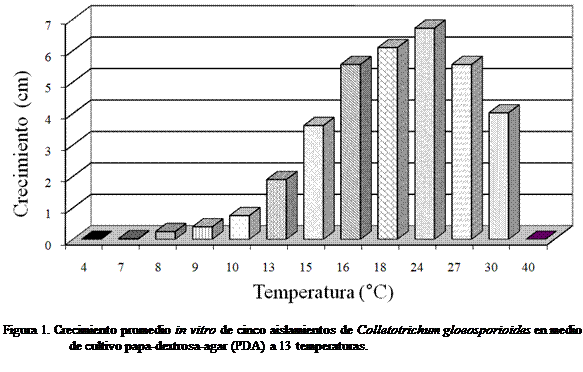
La temperatura mínima de
crecimiento de C. gloeosporioides en
medio de cultivo PDA fue de 8 °C (tasa
de crecimiento r = 0,015). El hongo creció 1 mm al cuarto día después de haber sido
sembrado a 7 °C, y no mostró ningún
desarrollo después; a 8 °C mantuvo un crecimiento lento pero constante. La
mayor tasa de desarrollo (r = 0,24) fue a 24°C seguido de 16°C y 18°C (r = 0,18), y de 27°C (r = 0,17). El
hongo no creció a 4°C
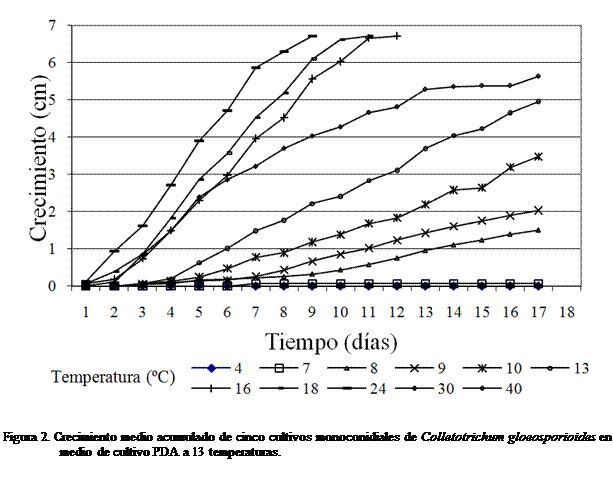
y 40°C (Figura 1). A 24°C uno de los cinco
monoconidiales cubrió la cápsula, lo cual sucedió a los nueve días y en ese
momento se determinó el promedio para los cinco monoconidiales; el mismo
procedimiento se siguió para todas las temperaturas. A 18°C el hongo cubrió la
cápsula los 12 días; a 16°C
y 27°C
fue a los 13 días, mientras que a 30°C el hongo no logró llenar la cápsula. De los aislamientos que se
colocaron a temperaturas de 16, 18, 24
y 27°C al menos uno de los monoconidiales llenó
la cápsula, mientras que el resto a pesar de que se dejaron hasta 18 días, no
lo hicieron (Figura 2 y Cuadro 1).
|
Cuadro 1. Tasa promedio de crecimiento (rM) de cinco
monoconidiales de Colletotrichum
gloeosporioides a 13 temperaturas en medio de cultivo PDA y días que el
hongo tardó en cubrir el área de una caja Petri. |
||
|
Temperatura (°C) |
Tasa de Crecimiento
(Rm) |
Tiempo (Días en cubrir la cápsula) |
|
4 |
0,0 |
− |
|
7 |
0,0006 |
− |
|
8 |
0,0153 |
+18 |
|
9 |
0,0799 |
+18 |
|
10 |
0,0745 |
+18 |
|
13 |
0,0726 |
+18 |
|
15 |
0,1397 |
+18 |
|
16 |
0,1838 |
13 |
|
18 |
0,1759 |
12 |
|
24 |
0,2418 |
9 |
|
27 |
0,1714 |
13 |
|
30 |
0,0916 |
+18 |
|
40 |
0,0 |
− |
|
rM = Tasa de incremento promedio obtenida después de haber
seleccionado y homologado las diferentes curvas de crecimiento al modelo
Monomolecular. −
= no hubo crecimiento y +
= más de 18 días |
||
Los cinco monoconidiales de C. gloeosporioides mostraron variaciones
de crecimiento a la misma temperatura, aún cuando se trata de la misma especie
pero aislados de diferentes localidades del estado de Michoacán; se observó
consistencia en el aislamiento MC 42 como el más rápido y el MC 5 como el de
más lento crecimiento en cada una de las cuatro temperaturas contrastantes (Figura 3).
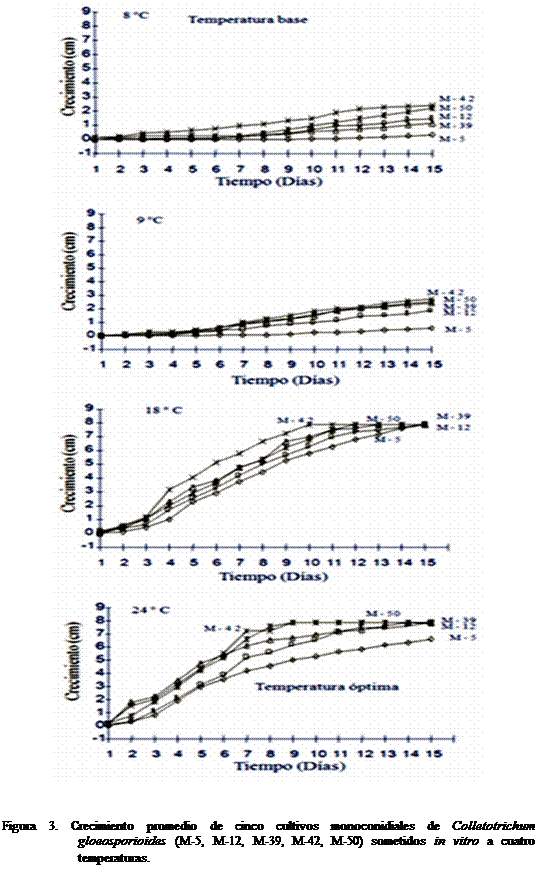
El análisis temporal de las curvas
de crecimiento de los cinco aislamientos monoconidiales del hongo a 13
temperaturas en medio de cultivo PDA dio como resultado que de los 65 cultivos,
43 tuvieron un ajuste estadístico con el
modelo Monomolecular, correspondiendo principalmente a las temperaturas de 7,
8, 9, 10, 13 y 30°C ;
16 se ajustaron al modelo Gompertz y
correspondieron a las repeticiones bajo las temperaturas de 15, 16, 18, 24, 27
y 30°C ; y 6 se ajustaron al modelo Logístico,
correspondiendo a temperaturas de 15, 16, 24 y 27°C . Unas curvas de
crecimiento de algunos de los monoconidiales expuestos a 15, 16, 24 y 27°C se ajustaron
al modelo Gompertz y otras al Logístico.
Para comparar las tasas de crecimiento de los modelos seleccionados todas las tasas
se homologaron a un solo modelo, el más frecuente que en este caso fue el
Monomolecular. Las tasas de crecimiento no se pueden comparar directamente si corresponden a
diferentes modelos, debido a que esto daría resultados imprecisos (Kranz,
1974). El modelo monomolecular fue el que mejor explicó el comportamiento de la
mayoría de las curvas obtenidas.
En el presente estudio no hubo un sólo modelo que
ajustará a todas las curvas de crecimiento, lo cual puede ser resultado en parte a la variabilidad genética
del hongo.
Los resultados de estos análisis mostraron cuatro
grupos: el primer grupo, correspondió a
|
Cuadro
2. Tasas de crecimiento in vitro a
13 temperaturas de cinco cultivos monosporicos de Colletotrichum gloeosporioides
aislados de frutos de aguacate. |
||
|
Temperatura (°C) |
Tasa de Crecimiento (Promedio) |
Ámbito † |
|
24 |
0,2419 |
a |
|
16 |
0,1838 |
ab |
|
18 |
0,1760 |
ab |
|
27 |
0,1716 |
ab |
|
15 |
0,1397 |
ab |
|
30 |
0,0952 |
bc |
|
9 |
0,0788 |
bc |
|
10 |
0,0745 |
bc |
|
13 |
0,0726 |
bc |
|
8 |
0,0153 |
c |
|
7 |
0,0006 |
c |
|
4 |
0,0000 |
c |
|
40 |
0,0000 |
c |
|
†
Diferentes letras indican una diferencia estadística significativa según
Tukey (p ≤ 0,05). |
||
En campo se encontró que los frutos presentaron el mayor
número de lesiones cuando las temperaturas medias fluctuaron de
|
Cuadro 3. Número de esporas y de lesiones de antracnosis en frutos de
aguacate cv. Hass detectadas durante 1997 en un huerto comercial ubicado en
San Juan Nuevo, Michoacán, se indican las temperaturas medias mensuales, la
precipitación pluvial, así como las tasas de crecimiento de Colletotrichum gloeosporioides a
diferentes temperaturas in vitro. |
|
|||||||
|
|
Condiciones Ambientales |
Condiciones in vitro |
|
|||||
|
Mes |
Lluvia (mm) |
Temperatura media (º C) |
Número de lesión |
Número de esporas |
Temperatura (°C) |
Tasa de crecimiento |
||
|
Enero |
48,2 |
11,9 |
0 |
162 |
4 |
0,0 |
||
|
Febrero |
15 |
14 |
0 |
131 |
7 |
0,0006 |
||
|
Marzo |
0,0 |
15,9 |
2 |
244 |
8 |
0,0153 |
||
|
Abril |
5,8 |
16 |
11 |
211 |
10 |
0,0745 |
||
|
Mayo |
10,8 |
18,4 |
4 |
243 |
13 |
0,0746 |
||
|
Junio |
489,3 |
18,9 |
6 |
392 |
15 |
0,1397 |
||
|
Julio |
384,1 |
18,5 |
8 |
304 |
16 |
0,1838 |
||
|
Agosto |
431,3 |
17,9 |
17 |
625 |
18 |
0,176 |
||
|
Septiembre |
491,9 |
17,8 |
21 |
595 |
24 |
0,2419 |
||
|
Octubre |
291,7 |
16 |
15 |
1413 |
27 |
0,1716 |
||
|
Noviembre |
3,3 |
15,4 |
12 |
785 |
30 |
0,0952 |
||
|
Diciembre |
0,0 |
12,7 |
0 |
576 |
40 |
0,0 |
||
El análisis de regresión indicó que no existe una
relación positiva entre el número de esporas y la temperatura, debido a que el coeficiente
de determinación fue de menos de 0,3 en todos los casos (temperatura máxima r 2
= 0,10; media r 2 = 0,18; mínima r 2 = 0,26), ni para lesiones (temperatura máxima r 2 =
0,004; media r 2 = 0,00; mínima r 2 = 0,01). Por lo
tanto la temperatura poco influye de forma independiente en la liberación de
esporas y en la presencia de las lesiones. No obstante en el análisis gráfico
de las variables involucradas en el patosistema, se observó también que la
temperatura máxima y mínima no tienen relación con la severidad de la
enfermedad y la liberación de esporas, pero sí se observó una influencia de la
temperatura media, por esta razón, en el presente estudio solo se tomó en
cuenta esta temperatura. Las poblaciones más altas de esporas de C. gloeosporioides se presentaron en los
meses de junio-diciembre, mientras que las poblaciones más bajas fueron de
enero - mayo esto coincidió con el mayor y menor número de lesiones en los
frutos marcados para este fin, a excepción
de diciembre, enero y febrero en donde debido a las bajas temperaturas
no se registraron lesiones; se nota que en los meses de diciembre a mayo, el
número de lesiones fueron bajas no obstante siempre hubo liberación de esporas.
En los meses de junio y julio hubo pocas lesiones aun cuando la liberación de
esporas y las lluvias fueron altas, esto probablemente se deba a que las
primeras lluvias son absorbidas por el terreno seco y la vegetación debido a
que se viene de un periodo seco y quizás, la humedad no sea suficiente para que se formen lesiones. De
diciembre a febrero las temperaturas bajas aparentemente fueron el factor que
limitó el desarrollo de las lesiones (Cuadro 3). En marzo y abril se registró
una elevada liberación de esporas; sin embargo, solo en abril se incrementó el
número de lesiones, esto debido probablemente a un riego pesado en el huerto
debido a que en estos meses no se registró una precipitación importante.
La estación climática no registró la humedad relativa,
que probablemente interactúa con la temperatura y explicaría mejor la relación
de las lesiones en fruto con los factores ambientales. El desarrollo in vitro de C. gloeosporioides de
CONCLUSIONES
La temperatura
base de crecimiento in vitro de Colletotrichum gloeosporioides fue
de 8 °C. A
LITERATURA CITADA
Campbell
L. C. and V. L. Madden. 1990. Introduction to plant disease epidemiology. John
Wiley and Sons, New York. 532 p.
Coakley,
S. M.; L. R. McDaniel and G. Shaner. 1985. Model for predicting severity of Septoria tritici blotch on winter wheat.
Phytopatology 75: 1245-1251.
Dieckmann,
M. 1992. Use of climatic parameters to predict the global distribution of Ascochyta blight on chickpea. Plant
Disease 76: 409-412.
Franc,
G. D.; M. D. Harrison and L. K. Lahman. 1988. A simple day-degree model for
initiating chemical control of potato early blight in Colorado. Plant Disease
72:851-854.
Gadoury,
D. M. and W. E. MacHardy.
Kranz, J. 1974. The role and scope of mathematical
analysis and modeling in epidemiology. In
Epidemics of Plant Diseases: Mathematical Analysis and Modeling (ed. J. Kranz). Springer New York. p. 7-54.
Lázaro,
B. V. 1985. Incidencia de la antracnosis (Colletotrichum
gloeosporioides, Penz) en aguacate cv. Hass almacenado en
refrigeración y su relación con el manejo cultural de las huertas en Uruapan, Michoacan. Tesis
de Licenciatura UNAM. Cuautitlán Izcalli, Estado de México. 75 p.
Madden, L. V. 1980. Quantification of
disease progression. Prot. Ecol. 2: 159-176.
Morales G., J. L. 1996. Caracterización
cultural, morfologica, patogenica y molecular de Colletrotrichum gloeosporioides
Penz. causante de la antracnosis del aguacate en Michoacán. Tesis de Maestría
Colegio de Postgraduados, Montecillos,
México 96 p.
Morales
G., J. L. 1997. Memorias del VI Curso de aprobación fitosanitaria en el manejo
del aguacate. Facultad de Agrobiología “Pte Juárez”-SAGAR-CIAM-UMSNH. Uruapan,
Michoacán. Septiembre. 290 p.
Morales G., J. L. y A. F. J. Vidales.
1994. Enfermedades del aguacate en Michoacán. Folleto para productores Núm. 24.
SARH-INIFAP-CIPAC- Uruapan, Michoacán, Mexico. 19 p.
Richards,
F. J. 1959. A flexible growth function for empirical use. J. Exp. Bot. 10: 290-300.
Téliz, O. D. 1999.
El aguacate y su manejo integrado. Mundi prensa México, S.A. de C.V. 215 p.
United
States Department of Agriculture (USDA). 1997. Docket No. 94-116-5. Final rule:
Hass avocados from Mexico. Federal Register USA. 102 p.
Wilson,
L. T. Y Barnett, W. 1983. Degree-Days: An aid in crop and pest management.
California Agriculture 37: 4-7.
Página diseñada por Prof. Jesús Rafael
Méndez Natera
TABLA DE CONTENIDO DE LA REVISTA CIENTÍFICA UDO
AGRÍCOLA



