Revista Científica UDO Agrícola Volumen 9.
Número 2. Año 2009. Páginas: 393-402
Micobiota endofítica
asociada al cultivo del mango ‘Haden’ (Mangifera indica
L.) en el oriente de Venezuela
Endophytic fungi in mango ‘Haden’ (Mangifera indica L.) grown at Venezuela eastern
Victoria MORALES
RONDÓN ![]() y Mariela RODRÍGUEZ GONZÁLEZ.
y Mariela RODRÍGUEZ GONZÁLEZ.
Inmstituto Nacional de Investigaciones
Agrícolas (INIA). Centro de Investigaciones Agrícolas del Estado Zulia. Zona
Industrial, Km.7 carretera vía Perijá, Maracaibo, Venezuela. Emails: vmorales@inia.gob.ve y
victoriaemr@hotmail.com ![]() Autor para correspondencia
Autor para correspondencia
|
Recibido: 29/04/2009 |
Fin de primer arbitraje: 03/08/2009 |
|
Primera revisión recibida: 07/09/2009 |
Aceptado: 18/09/2009 |
RESUMEN
Se
presentan los resultados de la distribución organográfica (ramas, hojas,
inflorescencias y frutos) de hongos endófitos en plantas de mango ‘Haden’ en un
ciclo de producción. El diagnóstico se realizó en cuatro plantaciones
comerciales ubicadas en la región oriental de Venezuela. Los hongos se recuperaron empleando la
técnica de la triple esterilización.
Todos los hongos identificados son reconocidos fitopatógenos
del mango. Las siguientes especies fueron identificadas: Fusarium decemcellulare, Lasiodiplodia theobromae, Pestalotiopsis sp., Cladosporium sp. y Colletotrichum gloeosporioides.
La distribución de L. theobromae
y Cladosporium
sp. fue continua y
sistemática, sin registrar variaciones a lo largo del período, detectándose
tanto en órganos vegetativos como reproductivos. F. decemcellulare y Pestalotiopsis sp.
fueron recuperados en órganos vegetativos. C. gloeosporioides
fue aislado de los pedúnculos de las frutas. Conidias
de L. theobromae
y Cladosporium
sp. fueron detectadas dentro
de las anteras junto con los granos de polen. Estos resultados indican que la
colonización endofítica por hongos comúnmente
patógenos puede representar una importante ruta para el
desarrollo de enfermedades relevantes en el cultivo del mango ‘Haden’ como son
la muerte regresiva, antracnosis y escoba de brujas ocasionadas por L. theobromae,
C. gloeosporioides
y F. decemcellulare,
respectivamente.
Palabras
clave: Hongos endófitos, hongos fitopatógenos, Mangifera indica.
ABSTRACT
In this work is presented the distribution on
mango ‘Haden’ trees (branches, leaves, flowers and fruits) of endophytic fungi during a production cycle. The diagnosis
was made at four mango ‘Haden’ commercial orchards located at eastern region of
Venezuela. The fungi were recorded employing triple sterilisation
specific method for endophytes fungi. All the
isolated fungi are recognized pathogens of mango. The following species were
identified Fusarium decemcellulare, Lasiodiplodia theobromae, Pestalotiopsis sp., Cladosporium
sp. and Colletotrichum gloeosporioides.
The distribution of L. theobromae and Cladosporium sp. was continuous and systematic, without
registering variations interphases as much detecting on vegetative as
reproductive organs. F. decemcellulare and
Pestalotiopsis sp. were recovered in vegetative
organs. C. gloeosporioides
was isolated in fruits pedicels. L. theobromae and Cladosporium sp. conidia were even detected within anthers
along with the pollen grains. These results it is come off that the endophytic colonization is an important route for the
development of diseases in the mango ‘Haden’ as dieback or decline, anthracnose
and floral malformation cause by L. theobromae, C. gloeosporioides y F.
decemcellulare, respectively.
Key
words: fungi, endophytes, phytopathogens,
Mangifera indica.
INTRODUCCIÓN
El mango (Mangifera indica L.)
ha sido cultivado por más de 4 mil años en la India de donde es originario y
desde donde fue introducido al Continente Americano por los europeos (Hoyos,
1994); encontrando condiciones climatológicas adecuadas para su adaptación, a
tal grado que con el paso de los años es uno de los componentes paisajísticos
más comunes, sin contar que nuestro continente es el segundo productor del
mismo (FAO, 2006).
Si bien no tiene la relevancia económica de las
musáceas y los cítricos, el mango representa una fuente de ingresos para un
buen número de fruticultores que se dedican a su
cultivo pues constituye un medio de obtener divisas en los mercados nacionales
e internacionales (Leal y Avilán, 1997).
En 1951 se
inició la introducción de varios cultivares de mango injertado provenientes de
Florida (U.S.A), incluyendo plantas del cultivar ‘Haden’, para conformar la
colección de materiales genéticos del Centro Nacional de Investigaciones
Agropecuarias (CENIAP-FONAIAP) en la ciudad de Maracay donde comenzaron a ser evaluados
sistemáticamente, sirviendo además como material de propagación. En la década
de los ’80 se observó la expansión del cultivo del mango en el oriente de
Venezuela, prevaleciendo en el ánimo de
muchos productores de esta región el establecimiento de plantaciones
comerciales con variedades injertadas de las cuales distinguió ‘Haden’ tanto
por sus excelentes cualidades de palatabilidad como por las referencias de su
alta productividad. Transcurridos diez años de establecidas las plantaciones,
los productores aspiraban cosechar volúmenes importantes de frutos considerando
que a esta edad las plantaciones se
encontrarían en la fase de plena producción de su ciclo de vida (Avilán et al., 1992); sin embargo, las expectativas de los
productores venezolanos de mango ‘Haden’ se vieron frustradas por los bajos
niveles de producción registrados en sus plantaciones los cuales resultaban
notablemente inferiores a los 10.000 kg/ha, que es el valor promedio en los
principales países productores de la franja tropical (Galán, 1999). Según datos
tomados del MAC (1997) y de BOLPRIAVEN (2009) que se presentan en el Cuadro 1,
puede observarse como a partir del año 2001 los volúmenes de producción y la
superficie cosechada de mango en Venezuela se reducen en casi un 50 %. Estas
cifras dan cuenta que si bien los rendimientos se han mantenido constantes
aunque bajos, tal caída en los volúmenes de producción ha devenido por
reducción en la superficie cosechada, lo que permite inferir que un importante
número de plantaciones han podido ser eliminadas o abandonadas por su baja
productividad.
|
Cuadro 1. Estadísticas de producción del rubro
mango en Venezuela (1992-2006). |
|||
|
Año |
Volúmenes de Producción (Tm) |
Superficie Cosechada (ha) |
Rendimientos (kg/ha) |
|
1992 |
562500 |
141750 |
8847 |
|
1993 |
510786 |
128718 |
8095 |
|
1994 |
546313 |
137671 |
8730 |
|
1995 |
534056 |
134582 |
8971 |
|
1996 |
545968 |
137584 |
9171 |
|
1997 |
569060 |
143403 |
9329 |
|
1998 |
540702 |
136257 |
8773 |
|
1999 |
525635 |
132460 |
8783 |
|
2000 |
516913 |
130262 |
8408 |
|
2001 |
297548 |
74982 |
5093 |
|
2002 |
291897 |
73558 |
5095 |
|
2003 |
272476 |
68664 |
4729 |
|
2004 |
258520 |
65147 |
4711 |
|
2005 |
ND |
74941 |
5558 |
|
2006 |
ND |
74426 |
5826 |
Un estudio de la problemática del cultivo del mango
‘Haden’ en Venezuela señalan al escaso cuajado de los frutos, la formación de
frutos partenocárpicos y severas afecciones
fitopatológicas como las principales causas de los bajos rendimientos
(Rodríguez y Morales, 2006).
Enfermedades fungosas como agallas o escoba de brujas,
antracnosis y declineo han sido reportadas como las
principales afecciones fitopatológicos que interfieren negativamente en la
producción del mango en Venezuela (Avilán et al., 1992; Rondón et al., 1983).
Es conocida la
presencia de una micobiota que permanece en los
tejidos de sus plantas hospederas sin causarle ningún tipo de enfermedad, esta micobiota
está conformada por hongos sistémicos denominados “endófitos” (Saikkonen et al., 1998). Los espacios intercelulares y las conexiones apoplásticas
son el principal nicho de estos hongos. Los nutrientes que por los haces
vasculares circulan le brindan el alimento necesario para su desarrollo (Allen et al., 1999).
La definición
original de los hongos endófitos como aquellos microorganismos no agresivos que
viven dentro de los tejidos vegetales se ha ampliado para incluir aquellos
microorganismos que en alguna etapa de su ciclo de vida permanecen
asintomáticos dentro del hospedero (Petrini, 1986, 1991).
Diversos
estudios demuestran que en ciertas ocasiones la condición saprofítica
del hongo endófito que habita en especies arbóreas, se trasmuta en efectos
negativos cuando su hospedero presenta desórdenes nutricionales o estrés hídrico
convirtiéndose en patógenos (Schulz y Boyle,
1999; Schulz et
al., 1999). De allí que muchas de las
especies de hongos endófitos reportados sean también reconocidos fitopatógenos. ¿ Qué factor es
determinante para que un hongo inicie un proceso infectivo o una colonización endofítica ?, es una interesante pregunta tanto para fitopatólogos como fisiólogos vegetales (Zabalgogeazcoa, 2008).
En este trabajo se presentan los resultados de un
estudio diagnóstico que permitió la detección e identificación de hongos
endófitos en plantas de mango ‘Haden’ cultivado en cuatro plantaciones
comerciales del oriente del país y sus implicaciones fitosanitarias.
MATERIALES
Y MÉTODOS
Características
agro-ecológicas de la zona de estudio
Esta investigación se realizó en
cuatro plantaciones de mango (Mangifera indica
L.) del cultivar `Haden´ ubicadas entre los estados Monagas y Anzoátegui. Las
plantaciones se encontraban en las siguientes unidades de producción: Agrofinca “La
Gloria”, Agrofinca “Rabanalito”
y Agropecuaria “La Lomita” ubicadas en la carretera nacional Urica-Maturín del estado Monagas y Agrofinca
“Sharom” ubicada en la carretera nacional
Anaco-Ciudad Bolívar del estado Anzoátegui. La
edad de las plantas oscilaba entre 6-15 años.
El área de influencia de las
unidades de producción en el oriente de Venezuela se encuentra a una altitud
promedio de 195 msnm y corresponde a una zona de vida del tipo bosque seco
tropical que se caracteriza por presentar
Material colectado
La recolección de las muestras se realizó durante un
ciclo productivo en las fases de crecimiento vegetativo, floración, fructificación y postcosecha en un período que abarcó los meses desde
octubre hasta abril. En cada una de las
plantaciones se seleccionaron al azar 12 plantas de apariencia sana. Para los
análisis microbiológicos se tomaron muestras de los siguientes órganos: ramas de los últimos
flujos de crecimiento y hojas en las fases de prefloración,
floración y fructificación, inflorescencias en la fase de floración y frutos
hechos en la fase de fructificación a razón de 3 órganos/punto cardinal/planta/fase.
Análisis
microbiológicos
Los aislamientos de hongos
endófitos se realizaron a partir de segmentos de los órganos vegetales
colectados sin signos evidentes de alguna enfermedad (apariencia sana). De los
entrenudos y yemas de las ramas jóvenes, y pedúnculos de los frutos se cortaban
secciones entre 10-
Para la purificación y
mantenimiento de todos los aislamientos, los hongos fueron transferidos a otras
cápsulas y tubos con PDA, y replicados
cada 3 semanas. Todos estos procesos se realizaron en una cámara de flujo
laminar para minimizar el riesgo de contaminación.
Para la observación de
estructuras en los cultivos puros se prepararon montajes sobre láminas
portaobjetos con una gota de azul de algodón en el centro de la lámina,
transfiriendo con aguja de disección estéril porciones de las colonias. También
se realizaron observaciones directas de las colonias bajo lupa estereoscópica.
Se prepararon monturas tipo Riddel las cuales
consistían en inocular con aguja de disección estéril pequeños cubos de agar
(aproximadamente 1 cm3) dispuestos sobre láminas portaobjetos, luego
estos cubos eran cubiertos con la lámina cubre-objetos y este sistema se
colocaba sobre papel de filtro estéril y humedecido dentro de una cápsula de
Petri estéril la cual se cultivaba a temperatura ambiente y en condiciones de luz
natural durante un lapso de 10-15 días. Al cabo de este tiempo se descartaba el
cubo de agar y se colocaba sobre un nuevo porta-objeto una gota de azul de
algodón el cual se cubría con el cubre-objeto separado del cubo; igualmente el
porta-objeto separado del cubo era teñido con azul de algodón cubriéndose con
un nuevo cubre-objeto (Casas-Rincón, 1994). De esta forma se
obtenían dos montajes a partir de un Riddel para
realizar las observaciones.
Todas las láminas preparadas se
observaron al microscopio de luz (x100, x400 y x1000 con aceite de inmersión),
tomándose las respectivas fotografías (microscopio trinocular
marca Nikon). Las características de las colonias
eran observadas bajo lupa estereoscópica (marca Nikon)
a x10 y x50.
La identificación de los hongos
se realizó mediante la utilización de claves taxonómicas especializadas (Barnett y Hunter, 1972; Booth,
1971 y 1977; Ellis, 1976; Gantner, 1974; Nelson et al.,
1983; Sutton, 1980) y consulta con micólogos especializados.
La ocurrencia de un hongo se
registraba como positiva si era detectado en al menos una muestra o segmento de
órgano.
Para el análisis estadístico se empleó el programa de
computación SAS System. La prueba estadística llevada a cabo para el
análisis de estos datos fue Chi-cuadrado (prueba no paramétrica) para analizar la
relación entre las variables presencia o ausencia de cada uno de los hongos
endófitos detectados por plantación y por órgano (hojas, ramas, flores y
frutos) empleando el procedimiento FREQ
(SAS, 2000).
RESULTADOS Y DISCUSIÓN
Como se presenta en el
Cuadro 2, cinco especies de hongos anamórficos (Deuteromycotina: Hyphomycetes y Coelomycetes) fueron recuperados como endófitos a partir de
órganos vegetativos y reproductivos: Colletotrichum gloeosporioides (Penz.) Penz. & Sacc., Fusarium decemcellulare
Brick (W & R, G, B, J), Lasiodiplodia theobromae
(Pat.) Grifford & Maubl., Pestalotiopsis sp. Stey., y Cladosporium sp.
Link.
|
Cuadro
2. Hongos endófitos aislados de distintos órganos de plantas de mango ‘Haden’
cultivado en cuatro plantaciones comerciales del Oriente de Venezuela. |
||||
|
Plantación |
Tallo (yemas y entrenudos) |
Hojas (láminas foliares) |
Flores (gineceos y anteras) |
Frutos (pulpa y pedúnculo1) |
|
La Gloria |
Fusarium decemcellulare Cladosporium sp. |
- |
- |
- |
|
La Lomita |
Cladosporium
sp. |
L. theobromae |
Cladosporium sp |
- |
|
Rabanalito |
Lasiodiplodia theobromae Pestalotiopsis sp. |
L. theobromae |
L. theobromae |
Colletotrichum gloeosporioides1 |
|
Sharom |
F. decemcellulare Cladosporium sp |
- |
Cladosporium sp |
- |
Estas especies también
fueron recuperadas como endófitos en plantaciones de mango ‘Haden’ establecidas
en la Planicie de Maracaibo (Morales y Rodríguez, 2006) e incluso han sido reportadas
por otros autores tanto en mango (Johnson
et al., 1992) como en otras
especies leñosas como roble, ericaceas, haya, pinos y
castaño (Collado et al., 1999; Okane et al.,
1998; Sahashi et al., 1999; Strobel et al., 1997; Washington et al., 1999). Aún más, han sido reportadas como agentes
patógenos causantes de enfermedades en mango (Avilán et al., 1992; Cartagena y Vega, 1992; Johnson
et al.,1991; Lim y Khoo, 1985; Mabbett, 1998; Manicom, 1989; Noriega, et al.,1999; Ploetz y Prakash, 1997; Ploetz et al.,1996; Ribiero, 1980;
Rondón et al., 1983; Schaffer et al.,1988; Varma et al., 1974).
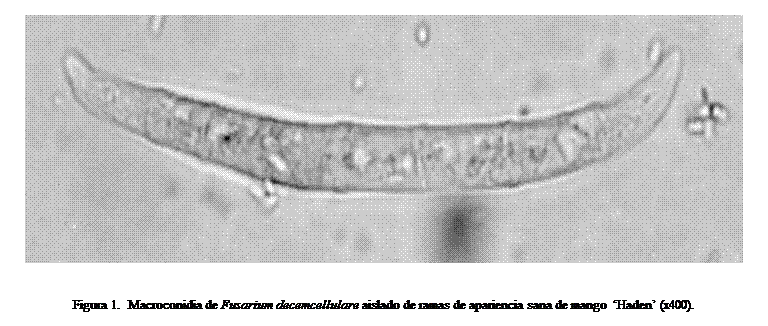
F.
decemcellulare (Figura 1) fue detectado en muestras provenientes de dos
plantaciones (Cuadro 2). Su ocurrencia se detectó en un 3,10 % de todas las muestras
analizadas. La distribución organográfica de este hongo difirió
significativamente (F=7,062; p=0,029*) hallándose en muestras de entrenudos y
yemas en un 55,79 % y en un 44,21 % en las hojas. F. decemcellulare ha sido reconocido como agente causal de una
de las más importantes enfermedades en el mango en Venezuela conocida como
“agallas” o “escoba de brujas” (Rondón et al., 1983). Sin embargo, en este
estudio no se observó tal enfermedad en ninguna de las plantaciones evaluadas,
a diferencia de muchas otras ubicadas en la altiplanicie de Maracaibo donde
está severamente presente esta enfermedad (Morales y Rodríguez, 2006). Otras
especies del género Fusarium han sido
identificadas como agentes causales de tal enfermedad. Aislamientos hechos en plantas enfermas han permitido
identificar a F. subglutinans,
F.
moliniforme y F. sacchari,
como agentes causales (Ploetz, 1993; Summanwar et al.,
1966; Varma et
al., 1974). En un estudio realizado en mango cv Keitt se
aisló F. subglutinans
como agente causal de agallas en las panículas (Ploetz,
1993);
se concluyó que para el desarrollo de la enfermedad era necesario que la
población del hongo en condiciones endofíticas
alcanzara un umbral de infestación requerido para el desarrollo de los síntomas.
Igualmente, un estudio realizado en plantaciones de mango ‘Haden’ en México
identificó a F. subglutinans
como agente causal de agallas y con la capacidad de permanecer
asintomáticamente en las plantas como endófito (Noriega et al., 1999). Los autores de este trabajo indicaron además la
obtención de resultados confusos al procurar completar los postulados de Köch, observando una influencia de las condiciones
ambientales y fisiológicas para el desarrollo de la enfermedad después de la
inoculación (Noriega et al., 1999).
L. theobromae (Figura 2) fue detectado sólo en 2 plantaciones del oriente
del país (Cuadro 2), aislándose en un 2,33 % del total de muestras analizadas.
Resultó persistente como endófito tanto en la fase vegetativa como
reproductiva de las plantas. En su
distribución organográfica se encontraron diferencias altamente significativas
(F=14,83; p=0,001***). Se hizo frecuente con un 52,94 % en las hojas, con un
41,80 % en los entrenudos y yemas; y con una baja frecuencia 5,26 % en los
órganos florales. Conidios de esta especie fueron detectados dentro de las
anteras junto con los granos de polen (Figura
3), lo que permite inferir una vía adicional de propagación. Esta
ocurrencia también se registró en órganos florales de mango ‘Haden’ cultivado
en la Planicie de Maracaibo (Morales y Rodríguez, 2006). Estos resultados ubican a L.
theobromae
como el hongo endófito de más amplia distribución, ubicuidad y frecuencia en
las plantaciones de mango ‘Haden’ del país (Morales, 2002). L. theobromae ha
sido señalada como el agente causal de la enfermedad denominada “muerte
regresiva” o “declineo” en mango en diversos
países productores como Puerto Rico (Alvarez y López, 1971), El Salvador (Acuña y White, 1977) y Malasia (Mabbett, 1998). En Florida se reporta la misma asociación entre
esta enfermedad y L. theobromae
aunque no exclusiva sino en compañía de otros hongos (Ploetz et al.,
1996).
Ploetz y Prakash (1997)
reportaron la imposibilidad de reproducir los síntomas en condiciones de
inoculación artificial, por lo que se asume que este hongo se mantiene como
endófito e intensifica su ataque cuando las plantas están en estado de
debilidad. En la India también reconocen la trascendencia de la colonización endofítica de este hongo en el posterior desarrollo de
enfermedades postcosecha en los frutos de mango (Mascarenhas et al.,
1995).
En este estudio no se observaron síntomas de “muerte regresiva” en ninguna de las
plantaciones evaluadas.


C. gloeosporioides (Figura 4) fue aislado en un 4,26 % de las muestras estudiadas,
provenientes de una sola de las fincas evaluadas (Cuadro 2). Se encontraron diferencias significativas en su distribución
organográfica (F=7,493; p=0,024*). El mismo fue detectado como endófito solo en
los pedúnculos de algunos frutos ya hechos y sin síntomas de
“antracnosis”. Esta enfermedad del mango
cuyo agente causal es C. gloeosporioides, constituye una de las más importantes a nivel mundial debido a
que afecta severamente tanto órganos vegetativos como reproductivos y ocasiona
importantes pérdidas postcosecha al causar pudrición
en los frutos (Avilán et al., 1992; Litz, 1997; Mabbett, 1998; Galán, 1999); de allí que su control tanto pre como
post-cosecha amerite especial atención.

Pestalotiopsis sp. (Figura 5) fue
aislado como endófito en un 0,39 % de todas las muestras analizadas, siendo detectado
sólo en una de las fincas evaluadas (Cuadro 2). En cuanto a su distribución
organográfica se encontraron diferencias altamente significativas (F=11,214;
p=0,004**) debido a que se aisló únicamente de los entrenudos y yemas de las
ramas. Este género ha sido reportado como agente causal de manchas grises en
hojas y puntas de ramas en mango y merey, aunque esta enfermedad no se
considera de relevancia (Mabbett, 1998). Ha sido aislado como endófito a partir de hojas,
puntas de ramas, inflorescencias y pedicelos en plantas de mango (Johnson et al., 1992). Igualmente
se ha encontrado como endófito en plantaciones de pino, donde produce un
compuesto anticancerígeno del tipo taxol (Strobel et al., 1997).

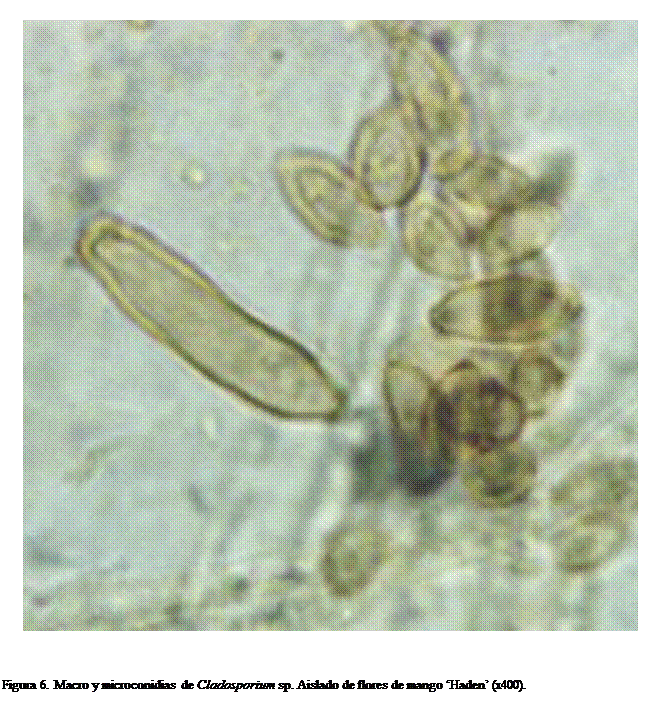
Cladosporium sp. (Figura 6)
fue detectado en tres de las plantaciones evaluadas en el oriente del país (Cuadro
2). Su ocurrencia se determinó en un 3,10 % del total de muestras analizadas,
de las cuales 58,93 % correspondieron a órganos florales (gineceos y anteras) y
41,07 % a entrenudos y yemas; obteniéndose así diferencias significativas en
esta distribución organográfica (F=7,07; p=0,029*). Fue el único hongo que
prevaleció consistentemente en la fase reproductiva. Al igual que L. theobromae,
conidios de este hongo fueron detectados dentro de las anteras junto con los
granos de polen (Figura 7). Cladosporium spp. no han sido reportadas hasta
el presente como patógenos importantes del mango, sino mas
bien como oportunistas. De hecho, es conocida su presencia cosmopolita en
distintos órganos de las plantas superiores y materiales de origen vegetal
tanto como parásito como saprobio (Barnett y Hunter, 1972) siendo reconocido como un importante
contaminante de ambientes y medios de cultivo.
No obstante, la especie C. cladosporioides
ya ha sido reportada como endófito de mango en Australia (Johnson et al., 1992), lo cual soporta su identificación como tal.

Las
observaciones antes expuestas indican la ocurrencia de hongos en condición endofítica; así como una distribución organográfica que
sigue un patrón de colonización sistemático y continuo, debido a que los
hongos recuperados no son aislados de algún órgano en particular (excepto Pestalotiopsis sp.). Observaciones
de este tipo se han registrado para algunas especies caducifolias donde se ha
hallado un patrón de distribución espacial extendido de su micobiota
endófita (Sahashi et al.,
1999).
El conocimiento de la fenología del
cultivo es muy importante para el diagnóstico debido a que la susceptibilidad
del cultivo al daño causado por patógenos puede variar de acuerdo con su estado
de desarrollo. Durante el desarrollo vegetativo, la mayor parte de la energía
de la planta se dirige al follaje. En este período, el daño por hongos
patógenos al área foliar no es tan crítico, porque la planta tiene tolerancia a
la pérdida de hojas y capacidad para renovarlas recuperando así el tejido
fotosintético perdido. Sin embargo, infecciones que arriben a la etapa
reproductiva pueden devenir en enfermedades, debido a que la energía de la
planta está dirigida hacia la floración y fructificación, y su sistema de
defensa está disminuido pudiéndose originar así más riesgos de pérdidas en la
producción (Ploetz
y Prakash, 1997). De allí la importancia de
monitorear estos procesos a lo largo de una escala de tiempo considerable, pues
representan una clave para la comprensión de las pautas ecofisiológicas
en la interacción huésped-hospedero, y para determinar la fase crítica en la
que los huéspedes dejan de ser endófitos para convertirse en patógenos.
CONCLUSIONES
- La colonización endofítica
puede considerarse como una importante ruta para el desarrollo de enfermedades
fungosas en el mango ‘Haden’, debido a que los principales hongos fitopatógenos asociados a este frutal pueden ocurrir como
endófitos y prevalecer asintomáticamente.
- L. theobromae y Cladosporium sp. ocurrieron como los principales hongos endófitos en
términos de distribución organográfica, prevalencia y frecuencia en las
plantaciones estudiadas en el oriente de Venezuela.
- La
presencia de F. decemcellulare como
endófito indica que deberán mantenerse importantes controles sanitarios y
excelentes condiciones de riego y fertilización para evitar la aparición de
“escoba de brujas” en las plantaciones del oriente del país considerando que
esta especie es el agente causal de esta severa enfermedad.
- La ocurrencia de los principales hongos fitopatógenos del mango ‘Haden’ como endófitos en ramas
jóvenes y yemas de plantas asintomáticas, imponen la necesidad de verificar la
sanidad de estos órganos en los programas de injertación
en los viveros, debido a que se podría favorecer la propagación de nuevas
plantas potencialmente enfermas.
- La presencia de hongos endófitos en órganos
jóvenes de plantas de mango ‘Haden’, pueden entorpecer el desarrollo de
actividades de propagación in vitro
en los cuales se emplean medios de cultivo que favorecen el crecimiento de la micobiota endófita.
AGRADECIMIENTOS
Los autores desean expresar su
agradecimiento a los especialistas Teresa Iturriaga de la Universidad “Simón
Bolívar” y a Franklin Escalona de la
Universidad del Zulia por su contribución en la identificación de los hongos
aislados en esta investigación.
LITERATURA CITADA
Acuña, H. y B. White. 1977. La muerte regresiva del
mango (Mangifera indica L.) en El Salvador. Proceedings
of the American Society of Horticulture Sciences, Tropical Region 21: 15-16.
Allen,
E.; A. Eom, Z. Maynard, L. Mejía
and R. Gallery. 1999. Sustainable cocoa the fungal community
component. A contributed integrated pest management paper.
Smithsonian Tropical Research Institute (Panamá).
Alvarez,
L. and J. López. 1971. Gummosis, dieback and
fruit rot disease of mango (Mangifera indica L.) caused by Botryodiplodia
theobromae in Puerto Rico. J. Agric. Univ. of Puerto Rico 55: 435-450.
Avilán, L.; F. Leal y D. Bautista. 1992. Manual de
fruticultura. 2da. edición. Editorial
América, Caracas, Venezuela.
Barnett,
H. and B. Hunter. 1972. Illustrated genera of imperfect fungi. Burgess
Publishing Company, USA. 241p.
Bolsa de Productos e Insumos Agropecuarios de Venezuela C. A. (BOLPRIAVEN). 2009.
Bolsa de Productos e Insumos Agropecuarios de
Venezuela S.A.C.A. Base de datos agroalimentaria.
www.bolpriaven.com. Última visita 20/01/2009.
Booth, C. 1971. The genus Fusarium. CAB, England.
Booth, C. 1977. Fusarium: laboratory guide to the identification of major
species. CAB, England.
Cartagena, J. y D. Vega. 1992. Manejo fitosanitario de
enfermedades y plagas del mango. Boletín de Sanidad Vegetal 05. Instituto
Colombiano Agropecuario (ICA).
Casas-Rincón, G. 1994. Micología General. Ediciones de
la Universidad Central de Venezuela (UCV), Caracas.
Collado, J.; G.
Platas, I. González and F. Peláez. 1999. Geographical and seasonal influences on
the distribution of fungal endophytes in Quercus ilex. New Phytol., 144: 525-532.
Ellis, M. B. 1976. More dematiaceous hyphomycetes.
CAB, England.
Ewel, J.; A. Madríz y J. Tosi. 1976. Zonas de vidas de Venezuela. 2da. ed.
Ministerio
de Agricultura y Cría MAC, Fondo Nacional de Investigaciones Agropecuarias
FONAIAP. Editorial Sucre. Caracas, Venezuela. p. 265.
Food
and Agriculture Organization (FAO). 2006. Statistical Production
Yearbook 2005-2006. Food and Agriculture Organism of United
Nations (ONU). Roma. www.fao.org. Ultima visita 20/01/2009.
Galán-Saúco, V. 1999. El
cultivo del mango. Ediciones Mundi-Prensa, Madrid.
Gantner, A. 1974. The natural classification of
the fungi. Straus & Cramer, Germany.
Hoyos, J. 1994. Frutales en Venezuela. Fundación La Salle, Caracas,
Venezuela.
Johnson,
G.; A. Cooke, A. Mead and I. Wells. 1991. Stem end rot of mango
in Australia: causes and control. Acta Hort., 219:
288-295.
Johnson,
G.; A. Mead, A. Cooke and J. Dean. 1992. Mango stem end rot
pathogens - Fruit infection by endophytic colonisation of the inflorescence and pedicel. Annals Appl. Bio. 120: 225-234.
Leal,
F. y L. Avilán. 1997. Situación de la fruticultura en Venezuela: un análisis. Rev. Fac. Agron. UCV
(Venezuela), 23 (1):1-30.
Lim,
T. and K. Khoo. 1985. Disease and disorders
of mango in Malasya. Tropical
Press, Kuala Lumpur (Malasya).
Litz, R. 1997. The mango. CAB International, USA.
Mabbett, T. 1998. Plagas y enfermedades del mango.
Agricultura de las Américas, Mayo/Junio: 8-13.
Manicom, B. 1989. Blossom
malformation of mango. S. Afr. Mango Grower’s Assoc. Year Book, 10:
11-12.
Mascarenhas, P.; A. Behere, A. Sharma and S. Padwal-Desai. 1995. Post-harvest
spoilage of mango (Mangifera indica) by Botryodiplodia
theobromae. Mycol.
Res., 100 (1): 27-30.
Ministerio de Agricultura y Cría (MAC).
1997. Anuario Estadístico Agropecuario años 1961-1997, Tomos del 1 al 36.
Caracas, Venezuela.
Morales, V. 2002. Distribución y
prevalencia de hongos endófitos y patógenos en mango ‘Haden’ cultivado a
diferentes niveles nutricionales. Tesis de Maestría. Postgrado de Fruticultura,
Universidad del Zulia. Maracaibo, Venezuela. 72p.
Morales, V. y M. Rodríguez. 2006. Hongos endofitos en plantaciones de mango ‘Haden’ de la Planicie
de Maracaibo, Venezuela. Rev. Fac. Agron. (LUZ). 23 (3):
273-284.
Nelson,
P.; T. Toussoun and W. Marasas. 1983. Fusarium species: an illustrated manual for identification.
The Pennsylvania State University Press, USA.
Noriega,
D.; D. Téliz, G. Mora, J. Rodríguez, E. Zavaleta, G. Otero and C. Campbell. 1999. Epidemiology
of mango malformation in Guerrero, México, with traditional and integrated
management. Plant Disease 83 (3): 223-228.
Okane, I.; A. Nakagiri and T. Ito. 1998. Endophytic
fungi in leaves of ericaceous plants. Can. J. Bot., 76: 657-663.
Petrini, O. 1986. Taxonomy
of endophytic fungi of aerial plant tissues.
p. 175-187. In: N. Fokkema y J. Van den Heuvel (Eds.). Microbiology of the Phyllosphere. Cambridge,
University Press, UK.
Petrini, O. 1991. Fungal
endophytes of tree leaves. p. 179-197. In:
J.H.Andrews y S.S. Hirano (Eds.). Microbial
ecology of leaves. Springer Verlag, New York.
Ploetz, R. 1993. Distribution and Prevalence of Fusarium
subglutinans in mango trees affected by
malformation. Can. J. Bot. 72:7-9.
Ploetz, R.; D. Benscher,
A. Vazquez, A. Colls, J. Nagel and B. Schaffer.
Ploetz, R. and O. Prakash. 1997. Foliar, floral and soilborne
diseases, p. 54-85. In:
Litz, R (Ed). The Mango. CAB International, USA.
Ribiero, I. 1980. Seca de mangueira.
Agentes causais e estudio da molesta. In: Resúmenes del
I Simpósio Brasiliero sobre a cultura de mangueira. Sociedad Brasileira de Fruticultura, Jaboticabal, Brasil.
Rodríguez, M y V. Morales. 2006. Nutrición del mango
‘Haden’ (Mangifera indica L) en Venezuela. Resúmenes de
las Conferencias del IX Congreso Venezolano de Fruticultura (Jesús Aular Ed.). pp. 48-56. Barquisimeto, 24-27/10/2006.
Rondón, A.; R. Solórzano y M. Materan.
1983. Agallas o escobas de bruja en mango (Mangifera indica L) en Venezuela. Agron. Trop. (Venezuela), 33(1-6): 163-176.
Sahashi, N.; T. Kubono, Y. Miyasawa and S. Ito. 1999. Temporal variations
in isolation frequency of endophytic fungi of
Japanese beech. Can. J. Bot., 77: 197-202.
Saikkonen, K.; S. H. Faeth, M. L. Helander and T. J. Sullivan. 1998. Fungal endophytes: a continuum of interactions with host plants.
Annual Rev. Ecol. Syst. 29:319-343.
SAS Institute.
2000. SAS user’s
guide: statistics. Version 8.11. Statistics
American Society, Inc. USA.
Schaffer,
B.; K. Larson, G. Snyder and Ch. Sanchez. 1988. Identification of mineral
deficiencies associated with mango decline by DRIS. Hort
Science 23 (3): 617-619.
Schulz,
B. and C. Boyle. 1999. Influence of colonization of the apoplast by endophytic fungi on
the nutrient status of the plant host. In: The apoplast
of higher plants: compartment for storage, transport and reactions. Institute of Microbiology, Technical University of Braunschweig (Alemania).
Schulz,
B.; A. Römmert, U. Dammann,
H. Aust and D. Strack. 1999. The endophyte-host interaction: a balanced antagonism?. Mycol. Res. 103 (10): 1275-1283.
Strobel, G.; W. Hess, J.
Li, E. Ford, J. Sears, R. Sidhu and B. Summerell. 1997. Pestalotiopsis guepinii, a taxol-producing endophyte of the Wollemi Pine (Wollemia
nobilis). Aust. J. Bot., 45: 1073-1082.
Summanwar, A.; S. Raychaudhuri and S. Phatak. 1966. Association
of the fungus Fusarium moniliforme
Sheld. with the malformation
in mango (Mangifera indica
L). Indian Phytopathol., 19: 227-228.
Sutton, B. C. 1980.
The coelomycetes: fungi imperfecti
with pycnidia, acervuli and
stromata. CAB, England.
Varma, A.; V. Lele, S. Raychauduri, A. Ram and
A. Sang. 1974. Mango malformation: a fungal disease. Phytopathology, 79:
254-257.
Washington, W.; S.
Steward and V. Hood. 1999. Phomopsis castanea a seed-borne endophytic
in Chesnut trees. Aust. J. Bot., 47: 77-84.
Zabalgogeazcoa, I. 2008. Review. Fungal endophytes
and their interaction with plant pathogens. Spanish J. Agric. Research.,
6: 138-146.
Página diseñada por Prof. Jesús Rafael
Méndez Natera
TABLA DE CONTENIDO DE LA REVISTA CIENTÍFICA UDO
AGRÍCOLA



