Revista Científica UDO Agrícola Volumen 9.
Número 2. Año 2009. Páginas: 403-413
Efecto de la inoculación de dos tipos de
semilla de bananos con dos aislados de Trichoderma atroviride en fase de vivero sobre el desarrollo de las
plantas en campo bajo Sigatoka Negra
Effect of
inoculation of two types of banana seed with two isolate of Trichoderma atroviride on plants performance on
field under Black Sigatoka
Claudia JIMÉNEZ1, Alba Stella RIVERO2,
Luis Eduardo POCASANGRE3, Eduardo DELGADO1, Franklin E.
ROSALES4, Oscar GONZÁLEZ1 y Dimas ROMERO1
1Instituto Nacional de Investigaciones
Agrícolas INIA-Barinas. Apto 170, Barinas estado Barinas,
Venezuela, 2Facultad de Ciencias, Departamento de Biología,
Universidad de Tolima, Ibagué, Tolima, Colombia – Convenio CATIE-Utolima c/o 7170 Turrialba, Costa Rica, 3Bioversity International
Costa Rica, c/o 7170 Turrialba, Costa Rica y 4Fondo
Regional de Tecnología Agropecuaria,
FONTAGRO
E-mails:
clauji14@hotmail.com, cjimenez@iniagob.ve, asrivero@catie.ac.cr,
l.pocasangre@cgiar.org, edelgado@inia.gob.ve y
delgado_ed8@hotmail.com ![]() Autor para
correspondencia
Autor para
correspondencia
|
Recibido: 30/04/2008 |
Fin de primer arbitraje: 19/03/2009 |
|
Primera revisión recibida: 22/09/2009 |
Aceptado: 15/12/2009 |
RESUMEN
La Sigatoka negra (Mycosphaerella
fijiensis Morelet)
ocasiona enormes perdidas en la producción de banano.
El uso de fungicidas ha sido el control más eficiente de esta enfermedad
foliar. El desarrollo de estrategias innovadoras dirigidas a disminuir la
dependencia del control químico convencional, es un desafió permanente, en una
agricultura sostenible y respetuosa del ambiente. El objetivo de esta
investigación fue estudiar el efecto de protección de dos tipos de material de
siembra (cormo y vitroplantas) de banano inoculadas
con dos hongos endofíticos “promisorios” sobre la
incidencia y severidad de la Sigatoka negra en el
campo. La investigación se llevo acabo
en la finca de un productor en el Municipio Obispo, Barinas. Se utilizó un
diseño de bloques al azar, 3 repeticiones, 4 tratamientos y 36 plantas por
unidad experimental. Se utilizaron cormos y vitroplantas
de banano (cv. Gran Enano), inoculados con cepas de Trichoderma
atroviride (E1 y E2) separadamente. Se evaluó la
incidencia y severidad de la Sigatoka negra empleando
las escalas de Fouré (1985) y Gauhl
(1989), siguiendo metodología de Marín y Romero (1998). Durante todo el periodo
vegetativo se registraron las siguientes variables: estado de evolución (EE),
ritmo de emisión foliar (REF), total de hojas (TH), hoja más joven enferma
(HMJE) e índice de infección (IND). A floración, se registro
una sola lectura para las variables THF, HMJEF e INDF, además de las variables
fenológicas: días de siembra a floración (DSF), altura de la planta a floración
(APF) y circunferencia del pseudotallo a floración
(CSF). Aunque no hubo diferencias significativas entre los tratamientos, con el
E1 se observaron los menores valores de IND, INDF, HMJE y los mejores valores
de TH y REF con más de 16%, en ambas variables, por encima del testigo.
Palabras clave: Hongos endofíticos,
Trichoderma atroviride,
protección de plantas, Banano, Sigatoka Negra
ABSTRACT
Black Sigatoka (Mycosphaerella fijiensis
Morelet) causes important losses to banana
production. Use of fungicides has been the most efficient control to this
foliar disease. The development of innovative strategies to diminish
conventional chemical control dependency is a permanent challenge for a
sustainable and environmentally respectful agriculture. The objective of this
research was to evaluate mutualist endophytic fungi to control black Sigatoka
in the field. The experiment was established on a farm in Obispo, County in
Barinas. A randomized complete block design was arranged with four treatment
and 30 plants as experimental unit. Banana (cv. Grand Naine)
vitro plants and corms inoculated separately with Trichoderma
atroviride strains (E1 and E2) were utilized.
Black Sigatoka severity and incidence were evaluated
using Fouré (1985) and Gauhl
(1989) scales and following Marin and Romero (1998) methodology. During the
vegetative period, the following variables were recorded: evolution state (ES),
foliar emission rhythm (RER), total leaves (TL), youngest diseased leaf (YDL)
and infection index (IND). At flowering, only one reading was done for TLF,
YDLF and INDF, along with the following phenological
variables: period from planting to flowering (PPF), plant height at flowering
(PHF) and pseudostem circumference to flowering
(PCF). Although there were no significant differences within treatment observed, E1 shows the lowest values on IND, INDF y HMJE and the
best values on TH and REF with over 16% in both variables above the witness.
Key words: Endophytic fungi, Trichoderma atroviride¸ plant
protection, banana, black Sigatoka
INTRODUCCIÓN
La
problemática fitosanitaria en banano, se expresa principalmente en la
enfermedad foliar Sigatoka negra (Mycosphaerella fijiensis), Moko (Ralstonia solanacearum), virus del mosaico del pepino (CMV) y
virus del rayado (Metamasius hemipterus) y
en plagas, los nematodos fitopatógenos (Radopholus similis, Pratylenchus sp, Helycotylenchus y Meloidogyne sp), picudo negro (Cosmopolites sordidus), picudo rayado (Metamasius hemipterus), gusano tornillo (Castniomera humboldti).
El énfasis mayor esta dado por las plagas que afectan
el sistema radicular y al follaje, las cuales crean una inseguridad en el éxito
del cultivo afectando sensiblemente la economía de los productores
(Martínez, 1996).
En el caso de los hongos, la Sigatoka negra
causada por M. fijiensis, es considerada la
enfermedad foliar más limitante y destructiva a nivel mundial. Esta enfermedad
causa destrucción paulatina del área foliar, acompañada de una fuerte necrosis,
afectando el proceso fotosintético, haciendo que la planta llegue a la floración
con un reducido número de hojas funcionales, perjudicando el eficiente llenado
de frutos y acelerando el proceso de maduración de la fruta, lo que genera
grandes pérdidas económicas en la fase de comercialización (Guzmán, 2006; Marín
y Romero, 1998).
Para Sigatoka negra el control químico y la selección de plantas
resistentes han sido las estrategias implementadas. Sin embargo los químicos pueden contaminar el ambiente y los
pequeños productores les es imposible pagar el alto costo de estos productos y los
consumidores están muy preocupados sobre los efectos de los plaguicidas en los
productos agrícolas (Henríquez et al.,
1997). Esto crea la necesidad de investigar nuevas alternativas de control con
un enfoque preventivo, utilizando microorganismos endofíticos
y extractos botánicos eficientes que en su rol como protectante
del material de siembra que indirectamente puedan inducir resistencia, no
solamente contra nematodos, sino también en forma sistémica contra Sigatoka negra.
Los
daños causados por nematodos fitoparasitarios son
variables y están influenciados por factores bióticos y abióticos (Norton,
1978). En altas infestaciones de nematodos como R. similis y Pratylenchus spp
reducen la absorción de agua y nutrientes, se deteriora el anclaje de la planta
y se producen racimos de poco peso, se incrementa el periodo de siembra a
floración, de floración a cosecha y reduce la longevidad de la plantación
(Hutton y Chung, 1973; Decker
et al., 1973). En Venezuela los
siguientes estudios dan una idea de la importancia de los nematodos con
relación al daño y su ocurrencia (Yepez et al., 1972; Petit,
1990; Crozzoli et
al., 1993; Montiel et al., 1997;
Suarez y Rosales, 1998). Tradicionalmente el control químico ha sido lo más
utilizado para el manejo y estudios han revelado aumentos en la producción y
extensión de la vida útil de las plantaciones (Delgado y Paiva,
2001).
Los hongos endofíticos Se caracterizan por
colonizar los tejidos u órganos internos de una planta sin causar ningún tipo de
síntomas; asimismo, aquellos que le confiere una protección a la planta
hospedera contra el ataque de agentes abióticos se les denomina hongos endofíticos mutualistas (Latch et
al., 1985; Caroll, 1990). Los hongos endofíticos
son mutualistas si: (i) no causan síntomas de enfermedad en la planta
hospedera; (ii) son trasmitidos a través de las semillas, cuando esto no
ocurre, éstos deberán trasmitirse lateralmente, de planta adulta a otra; (iii) esta disperso a través de los tejidos del hospedero; (iv)
colonizan y se extienden en un hospedero definido y (v) producen metabolitos
secundarios como modo de acción de antibiosis o de naturaleza tóxica (Meneses,
2003). Existen estrategias fundamentalmente distintas para que los hongos endofíticos presenten una simbiosis con las plantas: (a)
desarrollando una infección que induce algún tipo de resistencia sistémica
mediante una biomasa sustancial interna; (b) produciendo potentes toxinas que
presentan un efecto letal hacia patógenos de la plantas y (c) mediante un mutualismo
inducido, que envuelve una simbiosis menos precisa o más difusa entre el
hospedero y el endofítico (Clay,
1998).
Existen diversas especies de hongos endofíticos
benéficos, entre ellos se encuentra el género Trichoderma,
utilizado en los últimos años como agente para el control de numerosas
enfermedades en plantas (Howell, 2003; 2002). Este
género esta integrado por un gran número de cepas que
actúan como agentes de control biológico y cuyas propiedades antagónicas se
basan en la activación de mecanismos muy diversos, en donde pueden ejercer el biocontrol de hongos fitipatógenos
indirectamente, compitiendo por el espacio y los nutrientes, modificando las
condiciones ambientales, estimulando el crecimiento de las plantas y sus
mecanismos de defensa o produciendo antibióticos; sin dejar a un lado el
control directo mediante micoparasitismo. Estos
mecanismos pueden actuar de forma coordinada y su importancia en los procesos
de biocontrol depende de la cepa de Trichoderma, del hongo al que antagoniza, del
tipo de cultivo y de las condiciones ambientales tales como la disponibilidad
de nutrientes, el pH, la temperatura o la concentración de hierro. La
activación de cada uno de los mecanismos implica la producción de metabolitos y
compuestos específicos tales como factores de crecimiento de plantas, enzimas hidrolíticas, sideróforos,
antibióticos y permeadas de carbono y nitrógeno. Estos metabolitos pueden sobreexpresarse o combinarse con cepas de biocontrol apropiadas, a fin de obtener nuevas
formulaciones que puedan ser mas eficaces en el
control de enfermedades de plantas y en la protección de frutos postcosecha (Benítez et al., 2004).
El micoparasitismo y/o antibiosis como
mecanismo de acción de las especies de Trichoderma,
por ejemplo, Howell and Stipanovic
(1983), aislaron y describieron un nuevo antibiótico denominado glovirin, desde Trichoderma
virens, que fue fuertemente inhibitorio para Pythium ultinum y
especies de Phytophthora. En cuanto a
la competencia en la rizosfera, se tiene la
producción de enzimas tales como quitinasas, glucanasas por parte de agentes biocontrol,
las cuales rompen los polisacaridos, las quitinas y
los beta-glucanos que son los responsables de darle
rigidez a la pared celular y, de este modo destruir degradando la pared y producir
la muerte del hongos patogénico (Baek et al.,
1999). Elad and Kapat
(1999), sugieren en sus estudios que el biocontrol de
T. harzianum contra B. cinerea
podría ser debido, en parte a la producción de proteasas que inactivan las
enzimas hidrolíticas producidas por B. cinerea sobre las hojas del fríjol. Las proteasas
rompen las cadenas peptídicas o los constituyentes aminoácidos de las enzimas hidrolíticas y por lo tanto, destruye su capacidad de
actuar sobre las células de la planta.
Por otro lado, la inducción de resistencia en la planta huésped, es una
de las propuestas para explicar otra forma de acción de las especies de Trichoderma. Yedidia
et al. (1999), demostró que raíces inoculadas con T. harzianum inicio una respuesta de defensa en la plántulas
de pepino, tanto en las raíces como en las hojas, esta respuesta fue marcada
debido al incremento de la actividad de peroxidasas
(con frecuencia asociada a la producción de compuestos fungitóxicos),
además, de un aumento en la actividad de quitinasas, y
la formación de aposiciones sobre la superficie interna de la pared celular; un
aumento en la actividad de las enzimas fue observado tanto en las raíces como
en las hojas, a su vez este autor mostró que la inoculación de raíces con T.
harzianum induce la activación de una serie de
proteínas relacionas con la patogenicidad, incluyendo
un número de enzimas hidrolíticas.
Howell
(2003), resalta que los mecanismos de acción en cuanto a la producción
antibiosis y enzimas por parte de especies de Trichoderma
esta fuertemente influenciado por el sustrato
sobre el cual los hongos crecen y las condiciones ambientales como la
temperatura, a su vez la presencia de otros miembros en la microflora
del suelo también podría influir en la actividad del biocontrol
por inhibición del crecimiento y desarrollo de este o en el metabolismo de
enzimas y /o antibióticos, es posible que esto no afecte completamente al
agente biocontrolador, pero, si puede limitar su
eficacia. En cuanto a los tipos de mecanismo de control estos dependen tanto
del agente, el patógeno como del huésped, a su vez que todos estos están
influenciados por la temperatura, humedad, tipo de suelo, pH, genotipo de la
planta, microhabitat y obviamente, de los otros
miembros de la microflora. Por consiguiente, definir biocontrol implica múltiples interacciones bajo diferentes
mecanismos que trabajan sinérgicamente para lograr el eficiente control de la
enfermedad en el cultivo en cuestión.
En este sentido el objetivo de esta investigación es contribuir a
mejorar la producción de banano, mediante la evaluación del efecto potencial de
hongos endofíticos
para el control de Sigatoka negra (Mycosphaerella fijiensis
Morelet).
MATERIALES Y
MÉTODOS
Ubicación del ensayo
El ensayo de banano fue
establecido en una finca de un productor cooperante; José Mencías,
la misma esta ubicada en el sector El Jobal carretera Barinas-Obispo, Barinas estado Barinas,
Venezuela, localizada a 08°32´591” latitud Norte, 70°08´809” latitud Oeste, a
una altura de
Material de siembra
Se utilizó el cultivar de banano “Gran Enano” (AAA), fueron empleados
dos tipos de semillas.
Vitroplantas
Plántulas
provenientes de cultivo in vitro en fase IV de endurecimiento, adquiridas
desde un laboratorio comercial que garantiza la calidad y sanidad del material.
Cormos
Provenientes de hijos de espada de plantas madre sanas y vigorosas,
procedentes de la misma plantación del productor. Con el fin de no afectar el
punto de crecimiento o meristemo apical, a la semilla se le dejo de 3-
Hongos Endofíticos
(HE) biocontroladores
Se utilizaron hongos endofíticos que
pertenecen a dos cepas de Trichoderma atroviride que denominaremos en lo sucesivo Endofítico uno (E1) y Endofítico
dos (E2), suministrados por el laboratorio de Nematología
del Centro de Agricultura Tropical de Investigación y Educación (CATIE), Costa
Rica. Estas cepas de HE han sido clasificadas como promisorios por su
capacidad biocontroladora contra nematodos, en
especial Radopholus similis.
Los cultivos madres de estos hongos endofíticos,
sirvieron de base para la realización de subcultivos
(medio PDA) en la preparación de suspensión de conidios.
Descripción de los
tratamientos
Los tratamientos estaban constituidos por la combinación de tres
factores: tipos de material de siembra (cormo y vitroplantas);
tratamientos a nivel radical: hongo Endofítico uno,
(E1), hongo Endofítico dos (E2), Químico (Q) y
Testigo (T). El tratamiento químico consistió en la aplicación del nematicida de uso local al momento de la siembra, a la
floración y en la dosis recomendada (Cuadro 1).
|
Cuadro 1. Tratamientos
resultantes de la combinación de semilla por tratamientos de endofíticos. |
||||
|
Semilla |
Tratamientos de nematodos |
|||
|
E1 |
E2 |
Q |
T |
|
|
Cormo (C) |
CE1 |
CE2 |
CQ |
CT |
|
Vitroplanta (V) |
VE1 |
VE2 |
VQ |
VT |
|
E1: endofítico uno; E2: endofítico dos; Q: tratamiento químico; T: testigo; CE1: endofitico uno en cormo; CE2: endofíticos
dos en cormo; VE1: endofíticos uno en vitroplantas; VE2: endofíticos
dos en vitroplantas. |
||||
Diseño del
Experimento
El diseño de
experimento fue un bloque al azar con 3 repeticiones y cada unidad experimental
estuvo constituida por 30 plantas. En el ensayo los tratamientos estaban
separados por una hilera de bordura. Este diseño permite suficientes grados de
libertad (Cuadro 2) para el error experimental y permite suficientes
repeticiones efectivas para ambos factores: 12 para tipos de semilla (4x3=12) y
6 para tratamientos (2x3). El análisis estadístico fue un análisis de la
varianza con el apoyo del sistema de análisis estadístico SAS.
|
Cuadro
2. Fuente de variación y grados de libertad para el análisis de varianza. |
|
|
Fuente de Variación |
Grados
de libertad |
|
Repeticiones |
2 |
|
Tipos de semilla |
1 |
|
Tratamiento de control |
3 |
|
Tipos x Tratamiento |
3 |
|
Error Experimental |
14 |
|
Total |
23 |
Preparación de la suspensión de esporas
Cultivos de hongos con diez días de crecimiento en medio de cultivo
PDA, fueron utilizados para la preparación de la suspensión de esporas. A estos
cultivos esporulados se les adiciono 25 ml de agua
destilada y con ayuda de una asa, se desprendió el micelio del hongo. Esta
solución fue ajustada, mediante un hematocímetro de Neubauer a la concentración de 1*106 UFC/ml.
Preparación de las semillas e inoculación de las plantas con hongos endofíticos
Se utilizaron microcormos de banano de
Preparación del terreno y labores agrícolas
Se seleccionó un terreno plano con buen drenaje y se procedió, de
acuerdo con el diseño de bloques y parcelas, a realizar el rayado,
estaquillado, ahoyado y siembra de las unidades experimentales. En cuanto al
sistema de siembra, la disposición de las plantas en el terreno se hizo en
rectángulo con
La fertilización se realizó en función del análisis físico-químico del
suelo, utilizando el programa de fertilización foliar y edáfica recomendada por
el grupo de Musáceas de INIA. Se realizaron prácticas culturales como: deshijo,
deshoja sanitaria (despunte, deslaminado o cirugía)
en función de las condiciones ambientales. Las cuales fueron iniciadas a partir
del cuarto mes de siembra en campo (Cuadro 3).
|
Cuadro
3. Fertilización aplicada en los ensayos de banano en campo (1er
ciclo). |
||
|
Cantidad
(g/planta) |
Fertilizante |
Fecha
de aplicación |
|
500 |
Compost |
Día
de siembra |
|
250 |
Urea |
1
mes en campo |
|
500 |
Compost |
3
meses en campo |
|
300 |
Nitrato
de potasio |
7
meses en campo |
Evaluación de la Sigatoka negra
Para efectos de evaluación de la protección o inducción de resistencia
contra la Sigatoka negra, cada semana se evaluó
(durante el periodo vegetativo) el estado de evolución de la enfermedad en las
hojas II, III y IV atendiendo la escala de síntomas de Fouré
(1985) en las cuatro plantas de cada uno de los tratamientos. La severidad de
la enfermedad, se evaluó en las mismas cuatro plantas por tratamiento cada dos
semanas, mediante la escala de Stover modificada por Gauhl (1989) durante el crecimiento vegetativo y una sola
lectura fue realizada al momento de la floración.
Las siguientes variables fueron registradas al mismo tiempo de la
evaluación de la severidad:
Total de hojas (TH)
Es el número de hojas de la planta en el momento de la evaluación, sin
considerar hojas agobiadas, secas o senescentes.
Hoja más joven enferma (HMJE)
Es la hoja más joven en presentar la mancha en estado 6 (Fouré 1985), que corresponde a una mancha con halo
amarillento y el centro seco de color grisáceo. Los datos recolectados para la
evaluación de las variables de infección de la Sigatoka
negra se complementaron con el uso de la metodología sugerida por Marín y
Romero (1998), los cuales integra información de datos sobre Emisión Foliar
pasada y actual, para el cálculo de Ritmo de Emisión Foliar (REF), Corrección
Candela (CC), Coeficiente de la Enfermedad (CE), Suma Bruta (SB) y Estado de
Evolución (EE). Se obtuvo el Índice de Infección (IND) a partir de la
información recolectada con la escala de Gauhl. Desde
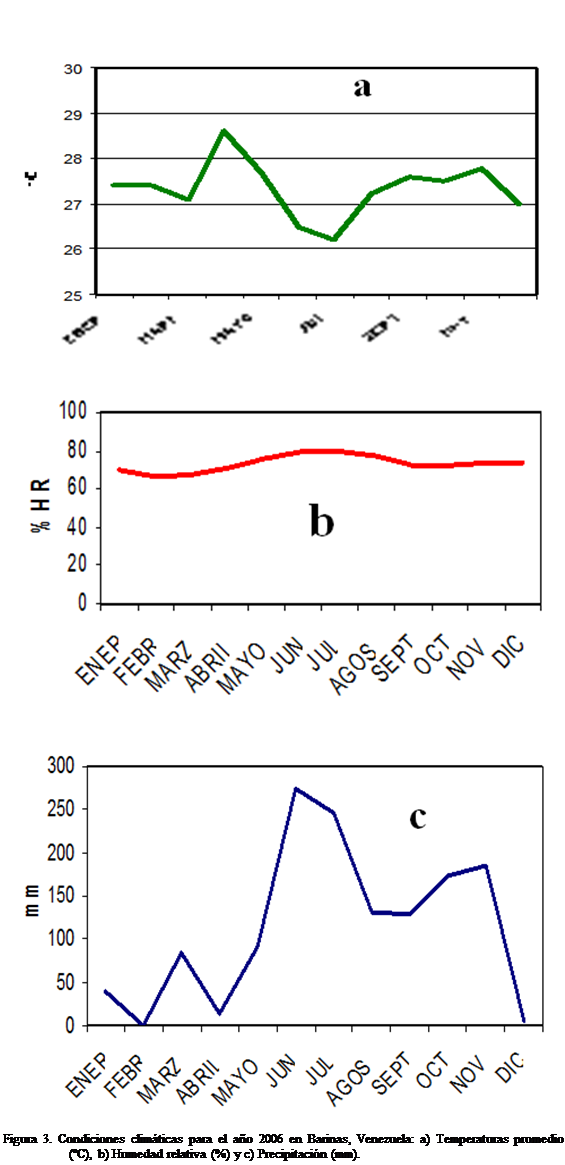
la estación agrometereológica del INIA, se
registraron las variables más estrechamente relacionadas con la epidemiología
de la Sigatoka negra, tales como: temperatura,
humedad relativa y precipitación el tiempo que duro el experimento.
Variables fenológicas y de producción para los experimentos
Estas variables fueron tomadas en las mismas cuatro plantas que fueron
evaluadas desde el inicio del estudio: días de siembra a floración (DSF),
altura de la planta a floración (APF) medida desde el suelo hasta la
intersección del pedúnculo de la inflorescencia con la última hoja emitida y la
circunferencia del pseudotallo a la floración (CPF)
tomado en la planta justo a la altura de un metro del suelo.
RESULTADOS
Y DISCUSIÓN
Efecto de la
aplicación de hongos endofíticos sobre la incidencia
y severidad de la Sigatoka negra en banano
Los hongos endofíticos
fueron inoculados a las semillas en vivero, posteriormente estas plántulas
fueron llevadas a campo 5 meses después, de acuerdo con el diseño de
experimento indicado. Se realizaron las evaluaciones correspondientes a
incidencia y severidad según lo indicado
en la metodología. Los resultados estadísticos revelan que no se encontraron
diferencias significativas en ninguna de las variables evaluadas durante la
fase vegetativa del cultivo ni para la fase de floración: Estado de Evolución
de la enfermedad (EE), Ritmo de Emisión Foliar (REF), Índice de Infección
(IND), Hoja Más Joven Enferma (HMJE) y número Total de Hojas (TH).
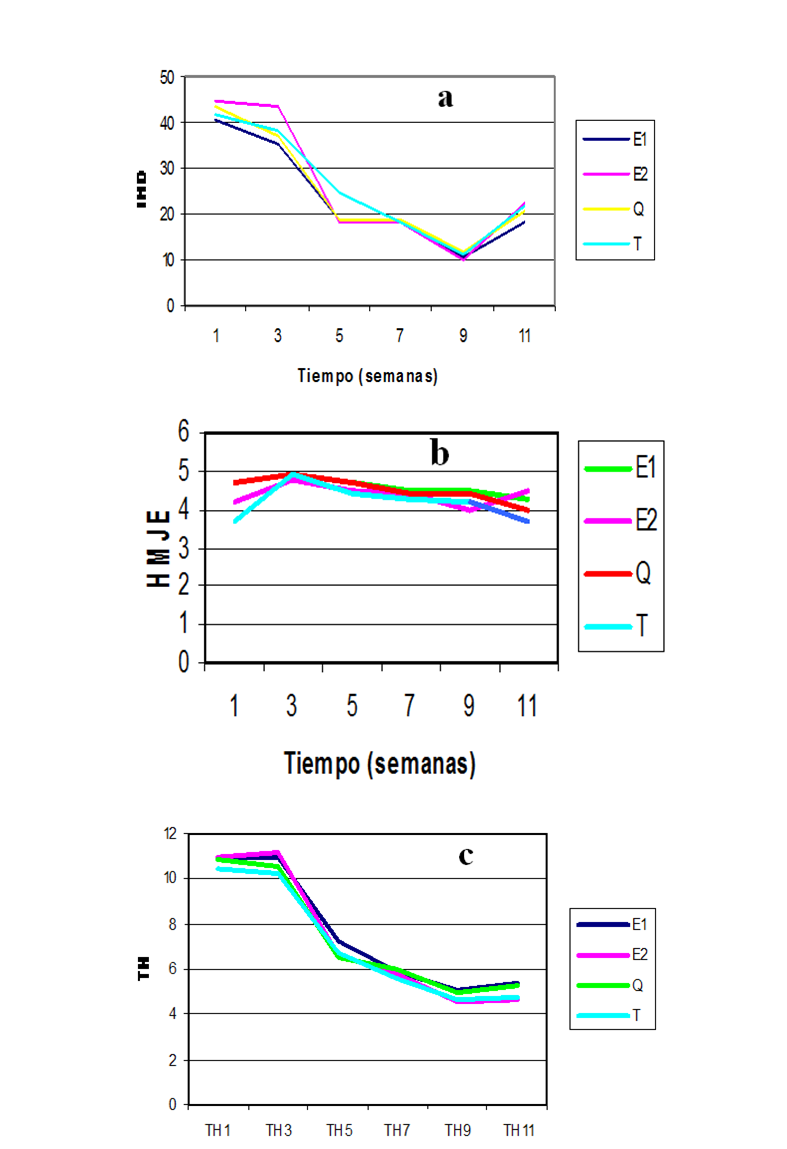
En la
Figura 1 se puede observar el comportamiento homogéneo a través del tiempo de
los tratamientos radicales sobre las variables antes mencionadas,
comportamiento que indica que no hubo un efecto significativo sobre el
crecimiento de las plantas ni sobre la protección contra Sigatoka
negra. Sin embargo, el tratamiento E2 en el tiempo logro disminuir el IND (Figura 1a), lo que indica
un efecto de control de la Sigatoka negra, no así con
la HMJE (Figura 1b), pero sí una ligera tendencia a mayor TH (Figura 1c) y con
E1 se observó una tendencia del mejor valor de REF (Figura 1d). La menor área
bajo la curva de progreso de la enfermedad fue menor en T.
Evaluación de variables fenológicas y de
cosecha para el análisis de Sigatoka negra
Las variables fenológicas
evaluadas a floración fueron las siguientes: Días de Siembra a Floración (PSF),
Altura de la Planta (APF) medido desde el suelo hasta la intersección del
pedúnculo de la inflorescencia y la última hoja emitida, circunferencia de pseudotallo a
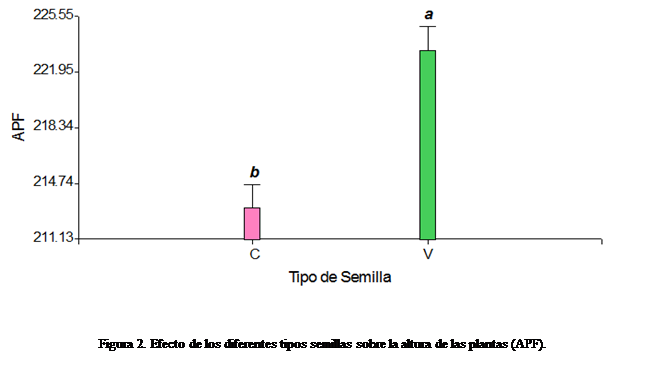
En el cuadro 4 se presenta un resumen de la
significancia y las tendencias de los
resultados en todas las variables evaluadas en las diferentes etapas: fase vegetativa,
severidad a floración, variables fenológicas y cosecha.
|
Cuadro 4. Resumen de la
significancia y las tendencias de los resultados de todas las variables
evaluadas de tratamientos aplicados a
radical y tipo de semilla en la fase vegetativa, severidad a floración
variables fenológicas y cosecha de banano 1er ciclo. |
||||
|
Variables |
Tratamiento
radical |
Significación |
Tipo de semilla |
Significación |
|
EE |
(T Q
E2 E1) |
ns |
Cormo Vitroplantas |
ns |
|
REF |
(T E1 E2
Q) |
ns |
Cormo Vitroplantas |
** |
|
IND |
(E1 Q
T E2) |
ns |
Cormo Vitroplantas |
ns |
|
TH |
(E1 Q
E2 T) |
ns |
Cormo Vitroplantas |
ns |
|
HMJE |
(Q E1
E2 T) |
ns |
Cormo Vitroplantas |
ns |
|
Tendencia |
E1
y Q |
|
Cormo |
|
|
INDF |
(E1 T
Q E2) |
ns |
Vitroplantas Cormo |
ns |
|
THF |
(E2 T E1
Q) |
ns |
Cormo Vitroplantas |
ns |
|
HMJEF |
(E2 E2 T Q) |
ns |
Cormo Vitroplantas |
ns |
|
Tendencia |
E2
Y T |
|
Cormo |
|
|
PSF |
(Q E2
T E1) |
ns |
Cormo Vitroplantas |
ns |
|
APF |
(Q T
E1 E2) |
ns |
Vitroplantas Cormo |
** |
|
CPF |
(Q T
E2 E1) |
ns |
Vitroplantas Cormo |
ns |
|
Tendencia |
Q
y T |
|
Vitroplantas |
|
|
PR |
(E2 Q
T E1) |
ns |
Vitroplantas Cormo |
ns |
|
NM |
(E2 Q
T E1) |
ns |
Vitroplantas Cormo |
ns |
|
ND |
(E2 Q
T E1) |
ns |
Vitroplantas Cormo |
ns |
|
LD2M |
(E2 Q
T E1) |
ns |
Vitroplantas Cormo |
ns |
|
GD2M |
(E2 Q
T E1) |
ns |
Cormo Vitroplantas |
ns |
|
PSC |
(E1 Q
T E2) |
ns |
Vitroplantas Cormo
|
ns |
|
AHC |
(E2 E1 Q
T) |
ns |
Vitroplantas Cormo
|
ns |
|
Tendencia |
E2
y Q |
|
Vitroplantas |
|
|
Signif:
Significación: **: Indica diferencias significativas entre los tratamientos. ns:
indica que no hay diferencias estadísticas significativas entre los
tratamientos. Letras en cursivas indican los peores resultados.
Letras subrayadas indican la tendencia del mejor tratamiento |
||||
En relación a los tratamientos radicales, aunque no
se encontraron diferencias significativas en ninguna de las variables
evaluadas, la tendencia fue encontrar los mejores resultados con el tratamiento
E1 seguido de Q en la fase vegetativa y E2 en severidad a floración, variables
fonológicas y cosecha.
Banano 2do ciclo banano
Efecto de la aplicación de los hongos endofíticos en el
control de Sigatoka negra en banano
Las evaluaciones del segundo ciclo de banano se
comenzaron el 07 de Marzo de 2006, para esta fecha todos los tratamientos presentaban
el 50% de plantas con el tamaño (1,2 – 1,5 m) y número mínimo de hojas (7) para
ser evaluadas. Se realizaron 12 lecturas de Estado de Evolución de la
enfermedad (EE) y Ritmo de Emisión Foliar (REF) y 7 lecturas de Índice de
Infección (IND), Número total de hojas (TH) y Hoja Más Joven Enferma (HMJE)
(Figura 3, 4, 5, 6).
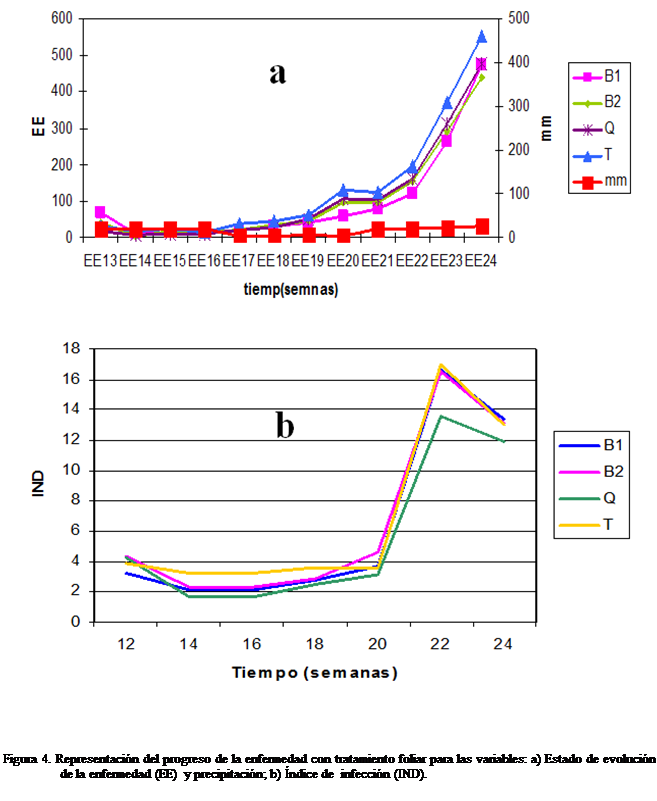
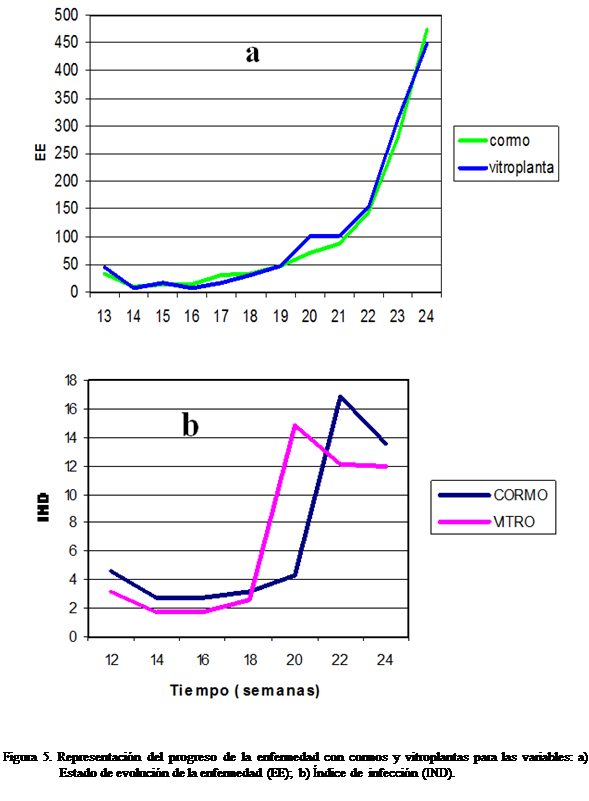
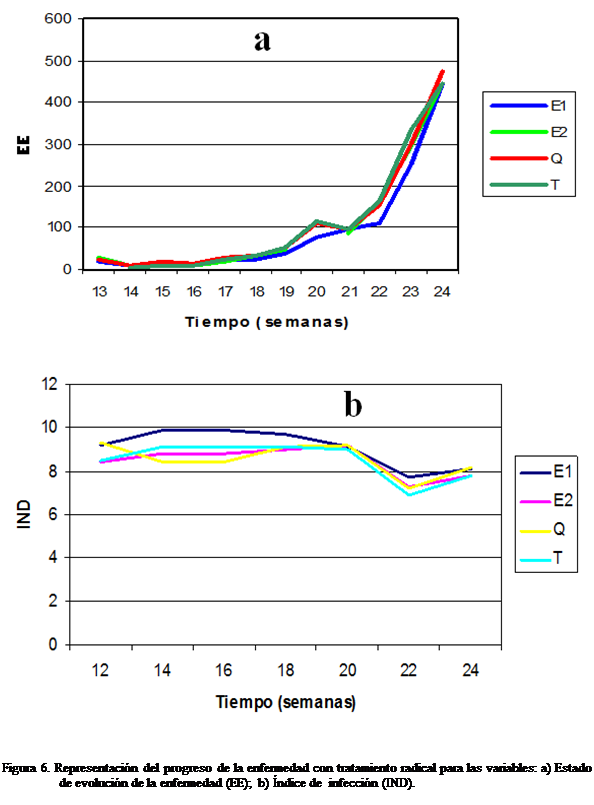
Con
relación al análisis estadístico, este arrojó que no existen diferencias
significativas en ningún, tratamiento radical ni con el tipo de semilla utilizada,
así como tampoco se encontraron diferencias en ninguna de las interacciones
analizada (Cuadro 5).
|
Cuadro 5.
Resumen de tendencias de todas las variables evaluadas de tratamientos aplicados
a nivel foliar, radical y tipo de semilla en la fase vegetativa, floración y
cosecha de banano 2do ciclo. |
||||
|
Variables |
Tratamiento radical |
Significación |
Tipo de semilla |
Significación |
|
EE |
(E1 E2
Q T) |
ns |
Cormo Vitroplanta |
ns |
|
REF |
(E2 T
Q E1) |
ns |
Vitroplanta Cormo |
ns |
|
IND |
(E1 Q
T E2) |
ns |
Vitroplanta Cormo |
ns |
|
TH |
(E2 T
E1 Q) |
ns |
Cormo Vitroplanta |
ns |
|
HMJE |
(E1 E2
Q T) |
ns |
Vitroplanta Cormo |
ns |
|
Tendencia |
E1 y E2 |
|
Vitroplanta |
|
|
Signif:
Significación: **: Indica diferencias significativas entre los tratamientos. ns:
indica que no hay diferencias estadísticas significativas entre los
tratamientos. Letras
en cursivas indican los peores resultados. Letras subrayadas indican la
tendencia del mejor tratamiento |
||||
En este ciclo del cultivo sólo se pudo evaluar la
fase vegetativa, debido a que se presentó una bacteriosis
(Erwinia sp.), por lo que hubo que eliminar la plantación. Esta bacteriosis se vio favorecida por lluvias atípicas en la
zona en los meses de Enero y Febrero (Figura 3c), unido al riego por inundación que favoreció
la diseminación de la enfermedad. Sin embargo, aunque no se encontraron
diferencias estadísticas significativas en ninguna de las variables
evaluadas, en el cuadro 8 se presenta un
resumen de las tendencias de los resultados en todas las variables evaluadas en
la fase vegetativa.
Con respecto a los tratamientos radicales, se
observó que con E1 se disminuyeron los valores de EE y de IND y se encontró la
mejor posición de la HMJE y que con E2 la mayor cantidad de TH y el mejor REF.
La tendencia de E1 en ser efectivo en el control de la enfermedad coincide con
lo señalado por la literatura quienes
indican que algunas especies de Trichoderma son capaces de inducir resistencia en la planta
de pepino hospedera; debido a que pueden dar inicio a una respuesta de defensa
como aumento en la actividad de peroxidasas que están
relacionadas a la producción de compuestos fungitóxicos,
aumento en la actividad de quitinasas, en la actividad de las enzimas en las raíces
y hojas (Yedidia et
al., 1999).
Es
importante señalar que con la aplicación de E2, se encontró mayor número de
Hojas Totales (TH) y mejor REF, lo que posiblemente indica que este endofítico tuvo un efecto estimulador en el crecimiento de
la planta como señala la literatura que dice que este tipo de hongo, es capaz
de colonizar el tejido de la planta sin causar ningún tipo de daño ni de
síntoma, interviniendo en su fisiología estimulando el crecimiento y aumentando
la resistencia al estrés causado por factores abióticos (Pocasangre
et al., 2000 y 2001). Otros
trabajos señalan que con la aplicación de T.
harzianum, se incrementa el área y longitud de la
raíz, tallo y área de la hoja, comparados con tratamientos no tratados,
presentado incremento significativo de Cu, P, Fe, Zn, Mn y Na
en las raíces de las plantas de pepino (Yedidia et al., 2001).
Es importante recordar la procedencia de los endofíticos: E1 proviene de Guatemala y E2 de Costa Rica;
países con condiciones agroecológicas distintas a las encontradas en Barinas,
razón por la que posiblemente no ejercieron un efecto significativo en el
control inducido de la Sigatoka negra ni en un efecto
significativo en estimular el crecimiento de las plantas. En relación a esto
último Howell (2003), señala que los mecanismos de
acción de la especies de Trichoderma están fuertemente influenciadas por el
sustrato sobre el cual el hongo se desarrolle y condiciones ambientales tales
como la temperatura, pH de suelo, presencia de otros microorganismos nativos de
la zona; el autor también señala que estos factores podrían influir en la
actividad biocontroladora por inhibición del
crecimiento y desarrollo de este, o podría influir también en la producción de
metabolismos de enzimas y/o antibióticos,
asimismo puede ser el caso de que no los afecte pero si limite su
eficacia en el control.
E2 manifestó una tendencia favorable y consistente
en floración y en cosecha (cuadro 5). La literatura señala que muchas especies
del género Trichoderma actúan como agentes de control
biológico debido a que presentan diferentes mecanismos de acción; micoparasitismo, compitiendo por espacio y nutrientes, estimulando el crecimiento de las plantas,
antibiosis y hasta son capaces de inducir resistencia a ciertas enfermedades;
todos estos mecanismos pueden actuar de forma coordinada dependiendo de la especie de Trichoderma, del patógeno, tipo
de cultivo, condiciones ambientales como temperatura ambiente y del suelo,
humedad, disponibilidad de nutrientes, pH del suelo etc. (Benítez et al., 2004).
CONCLUSIONES
· Los tratamientos
químicos a nivel radical (nematicidad
Carbonan, carbofuran) mostraron los mejores
resultados en la fase vegetativa, floración y cosecha.
· Con la aplicación
del hongo endofítico E2 proveniente de Costa Rica, se
encontraron los mejores resultados para ejercer control sobre Sigatoka negra en banano.
· Los cormos
presentaron las mejores características en la fase vegetativa y floración en
todas la variables evaluadas, tanto en
banano como en plátano
· Las vitroplantas mostraron los mejores valores en cosecha en
banano.
· Con la aplicación
de E1, la tendencia fue de reducir los valores de EE y de IND y con E2 estimuló
el TH y el REF.
· En el segundo ciclo
las vitroplantas presentaron los mejores valores de
IND, EE, TH, HMJE y REF
RECOMENDACIONES
·
Realizar investigaciones con cepas de hongos endofíticos nativas de la zona donde se instales los
ensayos.
·
Diseñar programas de manejos integrados donde se
incluyan los endofíticos
como elemento de protección y promotor de crecimiento en el tratamiento de la
semilla.
LITERATURA
CITADA
Baek, J.; C. Howell and
C. Kenerely. 1999. The role of extracelular
chitinase from Trichoderma virens Gv29-
Benítez, T.; A. Rincón, M. Limón and A. Codón. 2004. Biocontrol mechanisms of Trichoderma
strains. Microbioloycal 7: 249-260.
Carroll, C. G.
1990. Fungal endophytes in vascular plants:
Mycological research opportunities in Japan. Trans. Micol.
Soc. Japan. 31:103-116.
Clay, K. 1998.
Fungal endophytes of grasses: a defensive mutualism
between plant and fungi. Ecology 69: 10-16.
Decker, H.; R. Cassamayor García y
M. E. Rodríguez Fuentes. 1973. Nuevas investigaciones sobre tratamientos de
rizomas del plátano con agua caliente y nematicidas
contra nematodos parásitos. Cartas ALAF 7: 51-57.
Delgado, E. y R. Paiva.
2001. Estudio de la Sigatoka Negra (Mycosphaerella fijensis
Morelet) sobre la sostenibilidad de la producción
de musáceas en Barinas, Venezuela. Rev. Fac. Agron. (LUZ) 18:277-289.
Elad, Y. and A. Kapat. 1999. The role of Trichoderma harzianum protease in the biocontrol of Botrytis cinerea. Eur. J. Plant Pathol. 105: 177-189.
Fouré, F. 1985. Black
leaf streak disease of banana and plantains (Mycosphaerella fijiensis Morelet) study of the symptoms and stages of the disease in
Gabon. IRFA. París.
Gauhl, F. 1989.
Epidemiology and ecology of Black Sigatoka on
plantain and banana (Musa spp.) in
Costa Rica, Centroamérica. Ph D. Thesis of Systematisch
Geobotanische. Institutder Georg August Universität Göttingen and Institut für
Pflanzenpathologie und Pflanzenchutz der Georg August Universität Göttingen.
Guzmán, M. 2006. Estado actual y perspectivas futuras
del manejo de la Sigatoka negra en América Latina. In: Memorias XVII Reunión Internacional Acorbat. Joinville, SC, Brasil. Bananicultura: Un
Negocio Sostenible. E. Soprano, F. A. Tcacenco,
L. A. Lichtemberg y M. C. Silva (eds.) Editorial Epagri, Estación experimental de Itajaí,
SC, Brasil. p. 83-91.
Guzmán, M. 2002. Situación de la Sigatoka
negra en Costa Rica y opciones para el manejo de la enfermedad. Memorias ACORBAT. Cartagena, Colombia.
27 de octubre-2 de noviembre. p. 18-19.
Harman, G. E.; R. H. Howel, A. Viterbo, I. Chet and M. Lorito. 2004.Trichoderma species opportunistic, avirulent plant
simbionts. Nature Reviews Microbiology 2:43-56.
Henriques, W.; R. D. Jeffers, T. E. Lacher and R. J. Kendall. 1997. Agrochemical use on banana plantaions in Latin America; perspective on ecological
risk. Environmental Toxicology and Chemestry 16:
91-99.
Howell, C. and R. Stipanovic. 1983. Glovirin as a
new antibiotic from Gliocladium virens, and
its role in the biological control of Pythium ultimum. Can. J. Microbiol.
29: 321-324.
Howell, C. 2002.
Cotton seedling preemergence damping-off incited by Rhizopus oruzae and Phytium spp. and
its biological control with Trichoderma spp. Phytopathology 92: 177-180.
Howell, C. 2003. Mechanisms employed by Trichoderma spp in the biological control of plant
diseases: the history and evolution of current concepts. Plant Disease 87 (1):
4-10.
Hutton, D. G. and D. C.
Chung. 1973. Effect of post-planting aplications of nematicide DBCP to
plantain. Nematropica 3:45
Latch, G. C.; W. F.
Hunt and D. R. Musgrave. 1985. Ebdophytic fungi
affect growth of perennial ryegrass. N. Zeal. Journal. Agricutural
Research 28: 165-168.
Marín, D. y R. Romero. 1998. El combate de la Sigatoka negra In: Divulgación científica al servicio del
productor bananero nacional. Revista CORBANA. San José. Costa Rica. p. 104-129.
Martínez, G. 1996. The present
situation with regard to black Sigatoka in Venezuela.
Infomusa 6 (1): 16-17.
Meneses, A. 2003. Utilización de hongos endofíticos para el control biológico del nematodo
barrenador Radhopholus similis (Cobb). Tesis Mag. Sc. Biblioteca Orton, CATIE. Turrialba, Costa
Rica. 67 p.
Norton, D. C. 1978. Ecology of plant-parasitic nematodos.
Ed. John Wiley and sons. Ney Yok. 217 p.
Pocasangre, L.; R. A. Sikora, V. Vilich and P. Schuster. 2000. Survey of banana endophytic fungi from central America and secreeningfor biological control of Radopholus similis. In: M. Blanke and J. Pohlan (Eds). ISHS conference on
fruit production in the tropic an subtropics. Bonn. p. 283-289.
Pocasangre, L. A. R. Sikora y M.
Araya. 2001. Estado actual de la situación nematológica
en los bananos y plátanos en América Latina. PROMUSA. Infomusa.
10 (2): 1-12.
Yedidia, I.; N. Benhamou
and I. Chet. 1999. Induction of
defense responses in cucumer plants (Cucumis sativus L.)
by the biocontrol agent Trichoderma harzianum Appl. Environ. Microbiol. 65: 1061-1070.
Yedidia, I.; A. Srivastva,
Y. Kapulnik and I. Chet. 2001. Effect of Trichoderma harzianum on
microelement concentrations and increased growth of cucumber plants. Plant
Soil. 235-242.
Página diseñada
por Prof. Jesús Rafael Méndez Natera
TABLA DE
CONTENIDO DE LA REVISTA CIENTÍFICA UDO AGRÍCOLA



