Revista Científica UDO Agrícola Volumen 9.
Número 2. Año 2009. Páginas: 376-382
Comparación de caracteres anatómicos y morfológicos de raíces de cambur
‘Manzano’ (Musa AAB) y ‘Gran Enano’ (Musa AAA)
Comparison of
anatomical and morphological characters of roots of ‘Manzano’ and ‘Gran Enano’
bananas
Grace FORTUL, Dorian
RODRÍGUEZ, María Elena SANABRIA![]() y Rosario VALERA
y Rosario VALERA
Universidad Centroccidental “Lisandro Alvarado”;
Postgrados de Agronomía. Apartado 400. Barquisimeto, estado Lara, Venezuela.
E-mails: rdorian@ucla.edu.ve, mesanabria@ucla.edu.ve y mesanabria@yahoo.com
![]() Autor para
correspondencia
Autor para
correspondencia
|
Recibido: 27/06/2008 |
Fin
de primer arbitraje: 18/04/2009 |
Primera
revisión recibida: 16/07/2009 |
|
Fin de segundo arbitraje: 19/08/2009 |
Segunda revisión recibida: 31/08/2009 |
Aceptado: 17/09/2009 |
RESUMEN
Las plantas desarrollan en sus
órganos barreras mecánicas, entre estas el espesor, cantidad y calidad de las
ceras superficiales, grosor de la pared celular y de las células que
constituyen los tejidos protectores; que dificultan la entrada de los agentes patógenos.
Se compararon caracteres anatómicos y
morfológicos de raíces de plantas de cambur ‘Manzano’ (Musa AAB) y ‘Gran Enano’ (Musa
AAA), cultivares susceptibles y resistentes, respectivamente, al ataque de Fusarium oxysporum f. sp. cubense (raza
1)”, obtenidas de una finca ubicada en
el estado Trujillo, para analizar su relación con la resistencia o
susceptibilidad al ataque del Mal de
Panamá. Se utilizaron tres plantas de cada cultivar. Las raíces se subdividieron
en tres tercios: apical, medio y basal y se midió su grosor en cada uno con la
ayuda de un vernier digital. Se realizaron preparaciones semi-permanentes con
secciones transversales a mano alzada, la tinción fue con safranina, el montaje
con agua: glicerina (1:1) y la determinación de las variables con un
microscopio óptico Olympus Bx40 a un aumento de 500X. Se presentaron diferencias
significativas entre los cultivares, en cuanto al grosor de las raíces, pero no
entre los tercios en cada clon. Las raíces de cambur ‘Manzano’ resultaron ser
más gruesas (
Palabras clave: Tílides, Musaceae,
Fusarium oxysporum
ABSTRACT
Plants develop
mechanic barriers among which are the amount and quality of surface serum, cell
wall thickness, and width of protective tissue cells, which make difficult for
pathogenic agents to penetrate. Anatomical and morphological characters of
plant roots were compared in ‘Manzano’ and ‘Gran Enano’ banana plants,
susceptible and resistant to Fusarium
oxysporum f.sp. cubense (race 1),
respectively, obtained from a commercial farm in Trujillo state, to analyze
their relationship with their resistance or susceptibility to the Panamá disease.
Three plants per cultivar were used. Roots were subdivided in three sections: basal,
middle and apex and their thickness were measured with a vernier. Semi-permanent
preparations with free hand transversal sections of the root were obtained,
stained with safranin, mounted with water:glicerol (1:1) and observed with an
Olympus Bx40 microscope at 500X. Statistical differences were found between
cultivars with regard to root thickness, but not among root sections within
each clone. ‘Manzano’ banana roots were thicker (
Key words: Tilides, Musaceae, Fusarium wilt.
INTRODUCCIÓN
Los plátanos
y cambures pertenecen a las Musaceae, una familia con pocos géneros,
estrictamente tropicales y que corresponde al grupo de las Monocotiledóneas,
orden Zingiberales, género Musa (Simmonds, 1973; Heslop-Harrison et al., 2007). Las especies de Musaceae comestibles, se agrupan
en la sección Eumusa y tienen sus orígenes en Musa
acuminada Colla y Musa balbisiana
Colla, ambas silvestres y que por
cruzamientos ínterespecíficos han segregado caracteres, formando una amplia
gama de materiales con características de ambas. La primera fue denotada como
AA y la segunda BB, contando entonces con diferentes combinaciones genéticas de
acuerdo a su ploidía y composición genómica (Simmonds y Shepherd, 1955).
Los cambures
constituyen el principal cultivo frutícola en Venezuela, conjuntamente con el
plátano, aportando el 44% del volumen total de frutas producidas en el país
(FAOSTAT, 2006). La explotación se concentra, principalmente, en Trujillo,
Aragua, Yaracuy, Barinas, Táchira, Mérida, Miranda y Sucre y la producción está
dirigida, en su mayoría, al mercado nacional. Hasta hace pocos años, en el
estado Trujillo, se cultivaban unas
El “Mal de
Panana”, causado por el hongo Fusarium
oxysporum f. sp. cubense, conocido por sus
siglas como ‘Foc’, se presenta como un marchitamiento general de la
planta. Los síntomas iniciales se
observan en las hojas externas y bajas, las cuales exhiben un amarillamiento
progresivo que avanza rápidamente de los bordes hacia la nervadura principal.
Estos órganos en pocos días se marchitan, se secan y quiebran en la unión con
el pseudotallo, quedando colgadas; posteriormente mueren. También, en el tallo
y en el pseudotallo se observan áreas de
color rojo ladrillo como consecuencia de la enfermedad y no afecta al fruto
(Stover, 1972; Nava, 1997). Este patógeno se caracteriza por penetrar por la
raíz de las plantas e invadir los vasos del xilema y si no es bloqueado por
obstrucciones vasculares del hospedante, éste avanza dentro del cormo (Carlier et al., 2002).
Dentro de
Foc se reconocen cuatro razas, siendo tres de ellas patógenicas principalmente
en cambures. La raza 1 afecta a los clones ‘Manzano’ y ‘Cuyaco’ (‘Gros Michel’:
Musa AAA). La raza 2 es patogénica en
Topochos (Musa ABB) y tetraploides (Musa AAAA). La raza 3 es patogénica en
especies de Heliconia (Waite, 1963);
la raza 4, lo es en cultivares del subgrupo Cavendish, incluyendo a ‘Gran
Enano’ (Musa AAA), además de los
clones susceptibles de las razas 1 y 2. Inicialmente, esta raza 4 estaba
limitada, geográficamente, a las áreas subtropicales como Australia, Islas
Canarias, Sur África y Taiwán (Ploetz, 1990), pero, actualmente existe una
variante,
No se conocen métodos de control químico eficaces
contra Foc, solo el uso de variedades resistentes (Agusti, 2004). En Venezuela,
se han identificado las razas 1 y 2 con variaciones fenotípicas entre ellas
(Guédez y Rodríguez, 2004; Rodríguez et
al., 2006).
Las
plantas desarrollan características estructurales o barreras mecánicas en sus
órganos que dificultan el contacto o entrada de los agentes patógenos (Anderson
Prouty y Albersheim, 1975). Entre éstas, el espesor, cantidad y calidad de las
ceras superficiales, el grosor de la pared celular y de las células que
constituyen los tejidos protectores pueden actuar en el impedimento físico para
el establecimiento y penetración de microorganismos (Agrios, 2005).
En musáceas
se ha señalado la presencia o formación de tílides en los vasos xilemáticos de
las raíces, como una respuesta a la infección de tejidos vasculares por Foc,
evitando de esta forma el avance del patógeno por la obstrucción de los
mismos. Van der Molen et al. (1987)
estudiaron la ultraestructura de la formación de tílides en materiales de
cambures resistentes a Foc y observaron que en el lumen de los vasos de las
raíces de plantas no inoculadas con el patógeno no se formaron geles ni tílides
o cualquier otra inclusión citoplasmática; por el contrario, en plantas
inoculadas, a los cuatro días mostraban la formación de tílides, a partir de
las células parenquimáticas en contacto con sus paredes, y la presencia de
geles en el lumen del mismo, llegando a obstruirlo completamente ocho días
después de la inoculación.
Beckman
(1990) comparó el tiempo necesario para la formación de tílides en raíces de
cultivares resistentes y susceptibles de cambur y tomate, observando que los
vasos infectados de los materiales resistentes fueron obstruidos rápidamente y
en los susceptibles, el desarrollo de estas estructuras de defensa fue
retardado. Al ser las raíces de la planta de cambur el sitio primario de
infección por Foc, resulta necesaria una evaluación de manera cuidadosa de éste
órgano. Sin embargo, las investigaciones enfocadas al sistema radical de estas
son escasas, debido a la dificultad que representa excavar plantas completas,
procedimiento este que resulta molesto y lento (Sevem Ellis et al., 2003). El objetivo de esta
investigación fue comparar las características anatómicas y morfológicas de las
raíces en plantas de cambur ‘Manzano’ y ‘Gran Enano’, el primero susceptible y
el segundo resistente a la raza 1 de Fusarium
oxysporum f. sp. cúbense, y discutir la posible relación de estos parámetros ante el
patógeno.
MATERIALES Y
MÉTODOS
Material
Vegetal
El material vegetal se obtuvo de plantas de
cambur ‘Manzano’, clon susceptible, y ‘Gran Enano’, resistente a Foc, de la
misma edad y aparentemente sanas, de
Determinación
del grosor y estudio histológico de las raíces
A los tercios apical, medio y basal de
las raíces se le determinó su grosor con la ayuda de un vernier digital. Para
los estudios histológicos de las raíces se prepararon láminas semipermanentes
con secciones transversales a mano alzada. La tinción fue directa, total y
pancromática con safranina y el montaje con agua:glicerina (1:1) (Castro
Laporté et al., 1991). Las
observaciones y determinación de las variables se realizó en un microscopio
óptico Olympus Bx40 a un aumento de 400X, provisto de una escala micrométrica.
Las variables determinadas fueron: grosor de la rizodermis y de la corteza
(incluyendo exodermis y endodermis), diámetro del cilindro vascular; número de
vasos xilemáticos totales, sanos y con daños en el campo visual; se consideraron vasos
dañados aquellos con presencia de tílides, gomas o cualquier otro contenido que
los diferenciara del resto. Se realizaron
3 repeticiones por cada muestra y el análisis de varianza de los datos, el cual
se hizo con el programa Statistix,
versión 8.0 (Analytical Software), haciendo uso de una prueba factorial 22,
y el análisis de comparación múltiple de medias se realizó por la prueba de
Tukey HDS.
RESULTADOS Y DISCUSION
Determinación del grosor de los tercios apical, medio y
basal de las raíces
Se
presentaron diferencias altamente significativas (P ≤ 0,01) entre los
cultivares en cuanto al grosor de las raíces, igualmente (P ≤ 0,05) entre
los tercios para cada cultivar (Cuadro 1). Las raíces de cambur ‘Manzano’
resultaron ser más gruesas (
|
Cuadro 1. Grosor (mm) de los
tercios apical, medio y basal de las raíces de cambur ‘Manzano’ (Musa AAB) y ‘Gran Enano’ (Musa AAA). |
|
|
Cultivar |
Grosor de la raíz (mm) |
|
‘Manzano’ |
|
|
‘Gran Enano’ |
3,54 b |
|
Significación |
** |
|
Tercios |
|
|
Apical |
3,95 b |
|
Medio |
4,31 ab |
|
Basal |
|
|
Significación |
* |
|
C. V. (%) |
21,33 |
|
C. V. : Coeficiente de
variación * Significativo (p ≤ 0,05) ** Altamente significativo (p ≤
0,05). Medias con letras diferentes indican diferencias según |
|
Stover y
Simmonds (1987) señalaron que el grosor de la raíz está influenciado por la
ploidía, encontrando que para los triploides era de
En los cultivares estudiados se observó una disminución del grosor de la
raíz desde la base hacia el ápice, lo cual se explica por la formación de
nuevas células, el alargamiento de las mismas y la diferenciación de los
tejidos radicales (Lüttge et al.,
1993), es decir que por su crecimiento en longitud y el grado de
diferenciación, ocurre un aumento desde el ápice hacia la base.
Determinación del espesor de la rizodermis, la corteza y
el diámetro del cilindro central de los tercios apical, medio y basal de las
raíces.
No se observaron diferencias (p > 0,05)
entre los cultivares en cuanto al grosor de las células de la rizodermis, pero
si entre los tercios (p ≤ 0,01) y para la interacción de estos dos
factores (Cuadro 2). Esta variable se incrementó a medida que avanzó el
desarrollo del órgano, desde el ápice hasta el tercio basal en el cambur
‘Manzano’; no siendo así en el clon ‘Gran Enano’, donde éstas fueron menos
gruesas en el tercio medio. La rizodermis contribuye significativamente en la
absorción de agua y nutrientes en la planta (Draye et al., 2003), por lo que una variación en estas afectaría
directamente dicha actividad.
|
Cuadro
2. Grosor (µm) de la rizodermis, corteza y diámetro del cilindro central en
las secciones transversales de raíces de cambur ‘Manzano’ (Musa AAB) y ‘Gran Enano’ (Musa AAA). |
|||
|
Cultivares |
Grosor de la Rizodermis (µm) |
Grosor de la Corteza (µm) |
Diametro del Cilindro Central
(µm) |
|
‘Manzano’ |
3,23 |
182,55 a |
177,57 a |
|
‘Gran Enano’ |
3,15 |
147,04 b |
161,56 b |
|
Significación |
ns |
** |
** |
|
Tercio |
|
|
|
|
Apical |
3,18 b |
160,00 |
164,89 |
|
Medio |
2,94 c |
164,63 |
167,63 |
|
Basal |
3,45 a |
169,75 |
176,18 |
|
Significación |
** |
ns |
ns |
|
Cultivar x Tercio |
|
|
|
|
‘Manzano’ x Apical |
3,16 b |
178,20 |
176,61 |
|
‘Manzano’ x Medio |
3,21 ab |
178,86 |
174,76 |
|
‘Manzano’ x Basal |
3,32 ab |
190,59 |
181,33 |
|
‘Gran Enano’ x Apical |
3,21 ab |
141,80 |
153,18 |
|
‘Gran Enano’ x Medio |
2,67 c |
150,39 |
160,49 |
|
‘Gran Enano’ x Basal |
|
148,92 |
171,02 |
|
Significación |
* |
ns |
ns |
|
C. V. (%) |
21,65 |
23,49 |
29,25 |
|
C. V. : Coeficiente de
variación ns No Significativo (p >
0,05); * Significativo (p ≤ 0,05); ** Altamente significativo (p ≤
0,05). Medias con letras diferentes
indican diferencias según |
|||
En cuanto a
la corteza y al diámetro del cilindro central, se observaron diferencias (p ≤
0,01) entre los clones, pero no entre los tercios ni las interacciones.
Los valores fueron mas altos en
‘Manzano’ que en ‘Gran Enano’, esto quizás se deba a que el primer material
posee en sus núcleos un juego de cromosomas de M. balbisiana, la cual es considerada mas robusta (Champion, 1975),
lo que se traduciría en mayor tamaño de las células.
A pesar de
no haber diferencias estadísticas entre los tercios, se observó una tendencia
hacia un ligero aumento desde el ápice hacia la base, lo cual se debe a la formación de nuevos tejidos (Lüttge et al., 1993).
Determinación del número de vasos totales, sanos y con
daños en las secciones transversales de raíces
El número total de vasos conductores fue mayor
en las raíces de cambur ‘Manzano’ que en las de ‘Gran Enano’ (p ≤ 0,01),
sin embargo, los tercios intra clon no mostraron diferencias significativas
(Cuadro 3). La mayoría de los vasos se observaron sanos y en cuanto a los vasos
dañados se observó una tendencia hacia un mayor número de ellos en los del
cultivar ‘Gran Enano’, especialmente en el tercio apical; posiblemente asociado
a la característica de resistencia de este clon. En general, la cantidad de vasos
dañados fue muy baja para ambos materiales por lo que
la función de los vasos se vería muy poco afectada y los mismos seguirían
siendo activos en la conducción de agua y nutrientes (Flores-Vindas, 1999). La
presencia de las tílides en los vasos indicó la invasión de las raíces por
microorganismos, lo que demostró que las plantas no estaban completamente
sanas. Es importante mencionar que la ausencia de síntomas pudo deberse a dos
razones, que el organismo presente corresponda a Foc, pero en un estado temprano
de la infección, u otro organismo endofítico que no induce síntomas (en ambos
clones). Por otra parte, al observarse vasos dañados en ambos clones sugiere
que los organismos penetran tanto al susceptible como al resistente y que la
existencia de esas estructuras no es indicativa de la respuesta del clon
exclusivamente frente al patógeno (Figura 1).
|
Cuadro 3. Número de vasos
conductores totales, sanos y con daños en las secciones transversales de
raíces de cambur ‘Manzano’ (Musa AAB) y ‘Gran Enano’ (Musa AAA) en el campo visual (400X). |
|||
|
Cultivares |
No. Vasos totales |
No. Vasos sanos |
No. Vasos con daños1 |
|
‘Manzano’ |
|
|
1,35 b |
|
‘Gran Enano’ |
39,07 b |
36,37 b |
|
|
Significación |
** |
** |
** |
|
Tercio |
|
|
|
|
Apical |
47,71 b |
45,15 b |
2,56 |
|
Medio |
|
|
2,03 |
|
Basal |
51,17 ab |
|
1,38 |
|
Significación |
* |
* |
ns |
|
Cultivar x Tercio |
|
|
|
|
‘Manzano’ x Apical |
58.73 |
57,04 |
1,69 |
|
‘Manzano’ x Medio |
63,08 |
61,88 |
1,20 |
|
‘Manzano’ x Basal |
62,10 |
60,94 |
1,16 |
|
‘Gran Enano’ x Apical |
36,69 |
33,26 |
3,43 |
|
‘Gran Enano’ x Medio |
40,28 |
37,22 |
2,86 |
|
‘Gran Enano’ x Basal |
40,24 |
38,63 |
1,61 |
|
Significación |
ns |
ns |
ns |
|
C. V. (%) |
22,13 |
23,93 |
38,50 |
|
C. V. :
Coeficiente de variación ns No
Significativo (p > 0,05); * Significativo (p ≤ 0,05); ** Altamente significativo (p ≤
0,05). Medias con
letras diferentes indican diferencias según 1Datos transformados
mediante |
|||
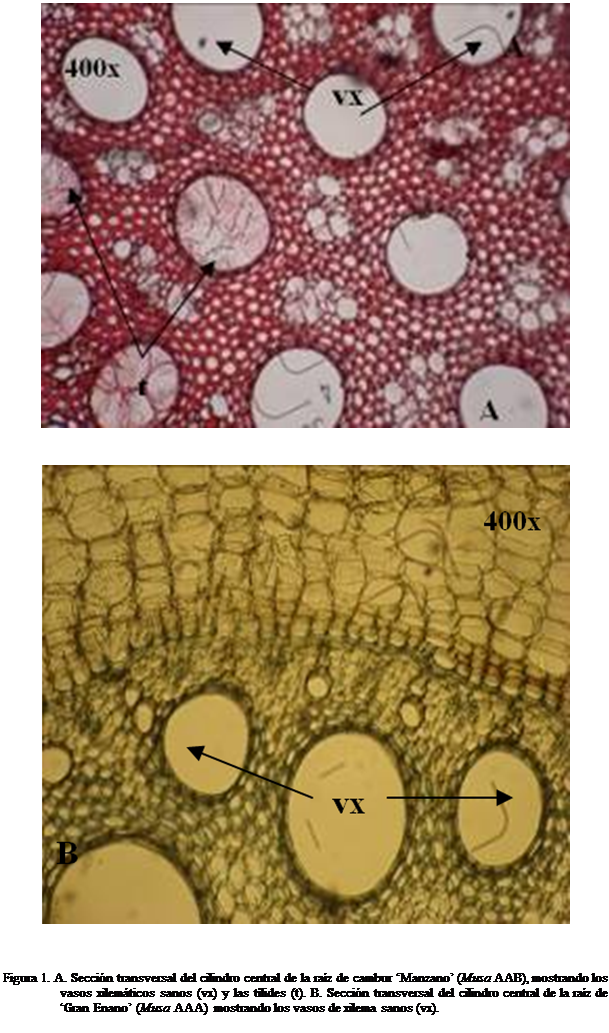
Las estructuras histológicas de
defensa observadas en las secciones transversales de las raíces de ambos
materiales también han sido reportadas en plantas invadidas por otros patógenos
como Endothia parasítica, el
cual produce una toxina llamada diaportina, que estimula la formación de
tílides en el castaño; igualmente en plantas de papa afectada por Fusarium
oxysporum se producen, aparentemente
para limitar la invasión del micelio y en el caso de alfalfa y Verticillium
albo-atrum también limitan el avance del patógeno. En la marchitez del
boniato, causada por F. oxysporum f.
sp. batatas, éstas se originan en algunas variedades, cuando el
hongo está todavía en las raicillas jóvenes y bloquean la diseminación de éste,
por lo cual hacen resistentes a esas variedades (Carlier et al., 2002).
CONCLUSIONES
Las raíces
de cambur Manzano resultaron ser más gruesas que las de ‘Gran Enano’, así
mismo, la corteza y el cilindro vascular, sin embargo, tales caracteres no
parecen estar asociados con la resistencia o susceptibilidad a Fusarium oxysporum f.sp. cubense. Se observó una tendencia a la
mayor formación de tílides en el clon ‘Gran Enano’, el cual es resistente al
hongo.
LITERATURA CITADA
Agrios, G. N. 2005. Plant
pathology. Fifth Edition.
Editorial Elsevier Academic press. 922 p.
Agusti, M.
2004. Fruticultura. Ediciones Mundi- Prensa. España. 493 p.
Anderson Prouty, A. and P. Albersheim 1975. Host pathogen
interactions. Plant physiology 56: 286-291.
Beckman, C. 1990. Host response to the pathgogen. In: Fusarium Wilt of
Banana. Ed. R.C. Ploetz. APS Press, St Paul, Minnesota.140 p.
Carlier J.; D. de Waele y
J. Escalante. 2002. Evaluación global de la resistencia de los
bananos al marchitamiento por Fusarium,
enfermedades de las manchas foliares causadas por Myscosphaerella y nematodos. Guías técnicas INIBAP.
Castro Laporté, M.; J. Guevara y A. Magallanes. 1991. Anatomía de cuatro
especies siempre verdes presentes en la zona de banco, sub-banco y bajío de la
estación Experimental Caparo (Estado Barinas). Ernstia 11 (1): 56-73.
Champion, J. 1975. El Plátano. Editorial Blume, Barcelona, España. 247 p.
Draye, X.; F. Lecompte y L. Pagés. 2003. Distribution of banana roots in
time and space: New tools for an old science. Proceedings of an International
Symposium held in San José, Costa Rica on 3-5 November 2003.
FAOSTAT. 2006. Banano, notas sobre productos básicos: situación del
mercado del banano en 2005 y comienzos de 2006. http://www.fao.org (Consultada
Enero 12, 2008).
Flores Vindas,
E. 1999. La planta: estructura y función. Libro Universitario
Regional (LUR). Tomo II. 884pp.
Guédez, C. y D. Rodriguez. 2004. Compatibilidad
vegetativa y raza patogénica de Fusarium
oxysporum f.sp. cúbense del estado Trujillo, Venezuela. Fitopatología
Venezolana 17: 30-32.
Heslop Harrison, J. and Schwarzacher, T. 2007.
Domestication, Genomics and the Future for Banana. Annals of
Botany 100: 1073-1084.
Lüttge, U.; M. Kluge y G. Bauen 1993. Botánica. Ediciones McGraw-Hill
Interamericana de España. 573pp.
Molina, A. 2006. Transcontinental diseases that
are potential threat to the banana industry in Latin America. XVII ACORBAT
International Meeting. Joinville, Brasil.
Nava, C. 1997. El plátano. Su cultivo en Venezuela. Ediciones Astro Data
S. A. Maracaibo, Venezuela. 130 p.
Paniagua,
R.; P. Nistra, M. Alvares, B. Fraiel, R. Anadón y F. Sáez. 2002. Citología e
histología vegetal y animal. Biología de las células y tejidos animales y
vegetales. 3era Edición. Editorial McGraw-Hill
Interamericana. 1002 p.
Ploetz, R. 1990. Population biology of Fusarium oxysporum f. sp. cubense.
In Ploetz RC (Ed.). Fusarium wilt of Banana. APS Pres. St
Paul, Mn, USA. P. 63-76.
Rodríguez,
D. 2000. Ocurrencia de Fusarium oxysporum
en plantaciones de cambur manzano en el estado Trujillo, Venezuela. Fitopatología
Venezolana 13: 22-24.
Rodríguez, D.; G. Martínez, N. Sanabria y B. Camacho. 2006.
Ocurrencia de la marchitez por Fusarium en Venezuela. XVII ACORBAT International
Meeting. Joinville, Brasil. p 650-652.
Sevem
Ellis, A.; M. Daneel, K. De Jager, y D. De Waele. 2003. Desarrollo de un
sistema aeropónico para el estudio de la respuesta de las raíces de banano a la
infección con Fusarium oxysporum f. sp. cubense y R. similis. INFOMUSA (FRA), 12 (1): 22-24.
Simmonds, N. y K. Shepherd 1955. The Taxonomy and Origins of the
Cultived Bananas. J. Linn. Soc. Lond., Bot. 55: 302-312.
Simmonds. N. W. 1973. Los Plátanos. Técnicas
agrícolas y producciones tropicales. Primera Edicion. Editorial Blume,
Barcelona. 539 p.
Stover, R. 1972. Banana, Plantain, and Abaca Diseases. Commonwealth
Mycological Institute, Kew, England. 316pp.
Stover, R. y N. Simmonds. 1987. Bananas. Tropical Agriculture Series.
Third edition. Longman Scientific & Technical. 468 p.
Van der Molen, G.; C. H. Beckman and E. Rodehorst. 1987. The ultraestructure
of tylose formation in banana following inoculation with Fusarium oxysporum f. sp.
cubense. Physiological and Molecular Plant Pathology 31: 185-200.
Waite, B. H. 1963. Wilt of Heliconia
spp. caused by Fusarium oxysporum f. sp. cubense race 3. Trop. Agric. (Trinidad) 40: 299-305.
Página diseñada
por Prof. Jesús Rafael Méndez Natera
TABLA DE
CONTENIDO DE LA REVISTA CIENTÍFICA UDO AGRÍCOLA



