Revista Científica UDO Agrícola Volumen 9.
Número 1. Año 2009. Páginas: 158-165
Micobiota del suelo asociada al cultivo del
plátano (Musa AAB cv. Hartón) en
bosque seco tropical del Sur del Lago de Maracaibo, Venezuela
Soil mycobiota associated to plantain cultivation (Musa AAB cv. Hartón)
in tropical dry forest in the south zone of Maracaibo Lake, Venezuela
Maryori PINEDA![]() 1,
Daniel PINEDA1, Johanna LABARCA1, Dilcia ULACIO2,
1,
Daniel PINEDA1, Johanna LABARCA1, Dilcia ULACIO2,
Claudia PAREDES1 y
Ana María CASASSA PADRÓN3
1Universidad Nacional Experimental Sur del Lago
(UNESUR). Programa Ingeniería de
E-mails: maryoli58@hotmail.com y johannalabarca@hotmail.com ![]() Autor para
correspondencia
Autor para
correspondencia
|
Recibido: 03/07/2008 |
Fin
de primer arbitraje: 23/03/2009 |
Primera
revisión recibida: 23/04/2009 |
|
Fin de segundo arbitraje: 27/05/2009 |
Segunda revisión recibida: 28/05/2009 |
Aceptado: 30/05/2009 |
RESUMEN
Con el fin de identificar la micobiota existente en
plantaciones de plátano del bosque seco tropical del sur del lago de Maracaibo,
estado Zulia, Venezuela; se analizó suelo adyacente a plantas en estado
fenológico de pre-floración, procedentes de los sectores: El Canal, Santa Rosa,
El Chivo, Las Rurales, Mata de Coco, El Paraíso, Dos Morales, Km. 18, Puerto
Concha y Janeiro. El análisis se realizó aplicando la técnica de dilución del
suelo hasta obtener una concentración de 10-3, que fue sembrada con
tres repeticiones en platos Petri con agar-agua. Una vez desarrolladas las
colonias, se observaron y contabilizaron las unidades formadoras de colonias
(UFC) de hongos por plato Petri. Los hongos se aislaron en papa dextrosa agar,
a fin de obtener el cultivo puro para su posterior identificación. De la
muestra de suelo colectados, se obtuvieron 19 aislados identificados como Aspergillus sp., Beauveria sp., Cladosporium sp.,
Colletotrichum sp., Penicillium sp., Sclerotium sp., Tilletiopsis
sp., y Trichoderma sp. La cuantificación de UFC de hongos por sector, determinó que
el sector “El Canal” fue la plantación con mayor biodiversidad. Entre los hongos aislados se identificaron tres
géneros considerados como potenciales antagonistas Beauveria sp., Tilletiopsis
sp., y Trichoderma harzianum. Ningún
hongo aislado resultó ser patógeno del cultivo de plátano. Se concluye que la
biodiversidad existente dentro de la zona evaluada es numerosa. A pesar de las
condiciones de bosque seco, estos resultados pueden ser explicados por el
criterio de selección de muestreo de unidades de producción no tecnificadas.
Los géneros de hongos considerados potenciales antagonistas podrían ser
empleados como posibles controladores biológicos de las principales plagas que
afectan el cultivo de plátano.
Palabras
clave: Micobiota del plátano, bosque
seco tropical, sur del lago de Maracaibo, antagonista.
ABSTRACT
With the purpose of
identifying the micobiotic existence in plantations of plantain in a dry
tropical forest in the south zone of Maracaibo Lake, Zulia state, Venezuela;
the soil close to the plants in phenological stage of pre flowering was analyzed,
the soil samples came from: El Canal, Santa Rosa, El Chivo, Las Rurales, Mata
de Coco, El Paraiso, Dos Morales, Km 18, Puerto Concha and Janeiro. The
analysis was done by using the soil dilution method until a 10-3 concentration was obtained; this last one was
planted with three repetitions in Petri capsules with agar-water. Once the
colonies were developed, the units of forming fungi colonies (UFC) by Petri
capsule were observed and accounted. The funguses were isolated in
potato dextrosa agar, with the purpose of obtaining pure culture for its
identification. From the soil samples, 19 isolates were collected and
identified as: Aspergillus sp., Beauveria sp., Cladosporium sp., Colletotrichum sp., Penicillium sp., Sclerotium sp., Tilletiopsis sp., and Trichoderma
sp.;
the quantification of UFC of fungus
determined that the place, El Canal, was the one with more biodiversity
comparing to other sectors. Among the isolated funguses were identified
three genders Beauveria sp., Tilletiopsis sp., and Trichoderma harzianum, which are
considered as potential antagonist. It was concluded that within the tested
zone, the existent biodiversity is numerous, in spite of counting with dry
forest conditions, this can be the result of the sample selection criteria of
non technical cropping systems and none of isolated funguses within the
investigation presented pathological qualities to the plantain cultivation. The genders of funguses considered as
potential antagonist could be used as possible biological control agents of
main pests that affect plantain crops.
Key words: Plantain mycobiota, tropical dry forest, south zone of Maracaibo Lake,
antagonist.
INTRODUCCIÓN
El plátano (Musa sp.),
es un cultivo de mucha importancia en el trópico americano y en otras zonas
tropicales del mundo, con una amplia distribución por su adaptación, tanto a
los trópicos como sub-trópicos (Cedillos et
al., 2002). Como alimento, ocupa el cuarto lugar en importancia, después
del arroz, trigo y maíz. Además es considerado un producto básico y de
exportación y una importante fuente de empleo e ingresos en numerosos países en
desarrollo. Los países latinoamericanos y del Caribe producen el 83% de los
plátanos del comercio internacional, 10 de los 12 millones de toneladas
mundiales (Castrejón et al., 2002).
La zona sur del lago de Maracaibo
representa para Venezuela una de las áreas productoras de plátano. Es la zona
con mayor superficie sembrada de este cultivo, llegando a ocupar una superficie
de 60.000 hectáreas de las cuales producen unas 400.000 toneladas, con
rendimientos de 8.000 a 10.000 kg/ha/año (García y Sosa, 1980; CIPLAT, 2004).
Sin embargo, la producción se ve limitada
esencialmente por el manejo agronómico aplicado al cultivo, principalmente por
el deficiente o mal mantenimiento de los sistemas de drenajes, aunado a los
problemas fitosanitarios (Ordosgoitti,
2004), entre los que se destacan la enfermedad conocida como sigatoka negra
causada por el hongo Mycosphaerella
fijiensis Morelet, los nematodos fitoparasíticos (García et al., 2007; Montiel et al., 1997) y el gorgojo del plátano Cosmopolites sordidus Germar (Labarca et al., 2005; Nava, 1999).
Los nematodos fitoparasíticos pueden
ocasionar pérdidas en rendimiento hasta de 30% y 50%. El daño que causan se
localiza en las raíces del cormo, interfiriendo en la absorción del agua,
nutrientes, translocación de minerales y el soporte físico de la planta,
provocando el volcamiento de las mismas, principalmente después de la fructificación
(Menjivar, 2005).
Para poder contrarrestar la acción de los
patógenos el hombre ha desarrollado distintas estrategias que van desde la
rotación de cultivos hasta la utilización de variedades de plantas resistentes
a las plagas y enfermedades, pasando por el uso de agentes químicos
fitosanitarios, sin embargo, éstos últimos contaminan acuíferos y tienen
efectos perjudiciales sobre la vida animal, humana y medio ambiente; entre los
plaguicidas presentes en el mercado, los nematicidas están catalogados como los
más tóxicos, seguidos por los insecticidas, fungicidas y herbicidas. Esta
característica de alta toxicidad, convierte a los nematicidas en los productos
más susceptibles a ser prohibidos en la agricultura, se estima que la mayoría
de los nematicidas presentes en el mercado serán cancelados en los próximos 5
años (Pocasangre et al., 2006).
Sin embargo, la necesidad de mejorar y
preservar el medio ambiente ha permitido a lo largo de estos últimos diez años
incrementar las investigaciones en función de los sistemas agroecológicos y de
las técnicas para lograr dicho fin. En la actualidad se conocen muchos
productos de origen biológico que permiten manejar las enfermedades de manera
preventiva y curativa con altos índices de eficiencia en una gran variedad de
cultivos (Pocasangre et al., 2006).
En la zona sur del lago de Maracaibo no
se han realizado investigaciones dirigidas hacia el diagnóstico e
identificación de los microorganismos presentes, principalmente hongos
antagonistas o con este potencial. En tal sentido el presente trabajo tuvo como
finalidad: A) identificar y cuantificar la micobiota del suelo en plantaciones
de plátano (Musa AAB cv. Hartón) en el
bosque seco tropical del Sur del Lago de Maracaibo, y B) cuantificar la
densidad poblacional de hongos con capacidad antagónica.
MATERIALES Y
MÉTODOS
Área de estudio
La población en estudio comprende 10 sectores correspondientes a
unidades productoras de plátano ubicadas en la zona agroecológica bosque seco
tropical: El Canal, Santa Rosa, El Chivo,
Las Rurales y Mata de Coco, correspondiente al municipio Francisco Javier
Pulgar y los sectores de El Paraíso, Dos Morales, Km. 18, Puerto Concha y
Janeiro, pertenecientes al municipio Colón. Para el muestreo de las
plantaciones se tuvieron en cuenta aquellas zonas cuyo manejo es el tradicional
no tecnificado y las superficies de las unidades de producción no excedían las
10 ha.
Recolección de
muestras
Por cada sector se realizaron tres muestreos de suelo en las distintas unidades
de producción, constituyendo un total de treinta muestras. Cada muestra estuvo
compuesta entre 10 a 15 sub-muestras que dependieron del tamaño de la unidad de
producción visitada. Se realizó un recorrido sobre el terreno en forma de
zig-zag o W, de tal manera que las plantas muestreadas se encontraron dentro
del trayecto de este plano. Por otro lado, se tomó como criterio de selección
las plantas que se encontraban en estado fenológico de pre-floración, igualando
las condiciones de los individuos muestreados, lo que disminuiría la
variabilidad de los resultados (Coraspe
et al., 2008).
Aislamiento de hongos
Se empleó la técnica de dilución hasta la
concentración 10-3, que consistió en pesar 10 gramos del suelo a los
cuales fueron agregados 200 mL de agua destilada estéril contenidos en un
erlenmeyer de 250 ml, posteriormente la mezcla fue agitada por 5 min y dejada
en reposo por 30 min; constituyendo la “solución madre”. En forma paralela, con
una pipeta de 100 mL (previamente esterilizada), se tomaron tres alícuotas de
90 mL de agua destilada estéril, las cuales fueron colocadas en forma
individual en tres envases identificados por orden sucesivo como 10-1,
10-2 y 10-3. Transcurrido el tiempo de reposo de la
solución madre, se transfirieron 10 mL de la misma al recipiente identificado
como 10-1, agitándolo continuamente por 5 min. Transcurrido este
tiempo, se extrajeron 10 mL de esta solución y fueron agregados al erlenmeyer
identificado como 10-2, repitiendo el procedimiento hasta la
dilución 10-3. Posteriormente, se colocaron 0.3 mL de la última
solución sobre la superficie del medio de cultivo utilizado agar-agua
(AA), realizando tres repeticiones por cada muestra procesada (Ulacio et al.,
1997). Los platos Petri se incubaron a temperatura ambiente (26-29 °C) hasta el
desarrollo de unidades formadoras de colonias de hongos.
Cuantificación e identificación de las
unidades formadoras de colonias (UFC) de hongos
Las UFC se
evaluaron en relación al desarrollo y crecimiento de las colonias de hongos por
plato Petri a las cuatro semanas de haber sido sembradas en AA en la dilución
de suelo 10-3. Para la cuantificación de cada UFC se tomaron en
cuentas las características macroscópicas de cada colonia tales como:
diferencias en el color, textura y topografía de éstas al momento de la
observación. Posteriormente se procedió a
aislarlas individualmente en platos Petri con papa dextrosa agar (PDA) con el
objeto de lograr cultivos puros de cada uno de los hongos. La identificación de
estos hongos se realizó bajo la técnica de observación de características
macroscópicas de las colonias y características microscópicas a través del
montaje directo en microscopio óptico observados a 400 y 1000X con la ayuda de las claves taxonómicas de Pitt y Hocking (1997).
RESULTADOS
Y DISCUSIÓN
Cuantificación de unidades formadoras de colonia (UFC) de
hongos
La distribución de las UFC de hongos se
encontraron en mayor frecuencia en el sector “El Canal” con un total de 7 UFC;
seguido de los sectores “Mata de Coco”, “Puerto Concha”, “El Chivo”, “Janeiro”
y “Santa Rosa” con 2 UFC por cada
sector; y los sectores “Km. 18” y “Las Rurales” con 1 UFC por cada uno. Los
sectores “Dos Morales” y “El Paraíso” no desarrollaron ninguna UFC durante el periodo de estudio (Figura 1). El número de UFC encontrados
en este trabajo fue bajo, si se lo compara con las UFC encontradas en cultivos de zonas calientes, como el cultivo del tabaco en el estado
Portuguesa (Ulacio et al., 1997). Las
características edafoclimáticas de cada zona de muestreo varían de un sector a
otro, aún cuando pertenecen a la misma zona de vida, lo que podría estar
condicionando el ambiente para el crecimiento micobiótico.
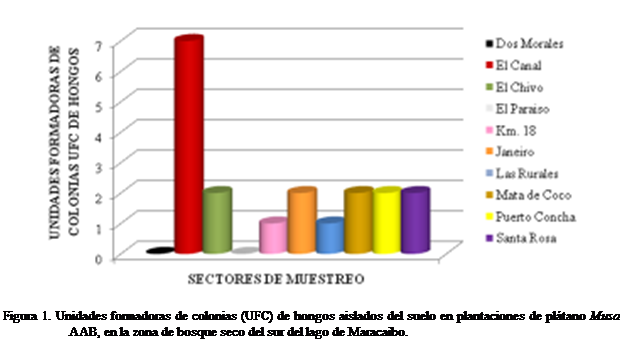
Las diferencias en cuanto al desarrollo y
crecimiento de UFC de hongos por sector muestreado, podrían ser explicadas por un lado, por la técnica de
aislamiento empleada en este estudio, que no fue capaz de captar las bajas
poblaciones de hongos; y por el otro, el manejo agronómico y las prácticas
fitosanitarias dirigidas al control de enfermedades fungosas en estos sectores.
En este sentido, Zavaleta-Mejía (2000) señala que el uso indiscriminado de
agroquímicos, reduce la biodiversidad de los agroecosistemas, causando una
mayor incidencia de plagas y enfermedades.
Identificación de la micobiota de suelo
Es
conocido que la dinámica microbial es muy importante en el suelo por su función
en la descomposición de la materia orgánica ya que no solo sirve de alimento a
los microorganismos presentes, sino que también puede influenciar en el
desarrollo de las plantas (Alexander 1980). En el Cuadro 1, se observa la
biodiversidad fúngica existente en el suelo de las plantaciones de plátano del bosque seco tropical. Se aislaron 19
hongos, los que fueron caracterizados en 8 géneros diferentes: Aspergillus sp., Beauveria sp., Cladosporium sp.,
Colletotrichum sp., Penicillium sp., Sclerotium sp., Tilletiopsis
sp., y Trichoderma harzianum. Estos resultados muestran que la biodiversidad
fúngica bajo condiciones de bosque seco se ven asociados a las condiciones
agroclimáticas imperantes en la zona de estudio como son las temperaturas
(promedio 27ºC), las precipitaciones anuales (entre 1300 a 2100 mm) y la
humedad relativa (85%) (Strauss et al.
(1986).
|
Cuadro 1. Géneros de hongos
identificados en las muestras de suelo recolectadas en plantaciones de plátano (Musa AAB cv. Hartón) ubicadas en la
zona de vida bosque seco del Sur del Lago de Maracaibo |
|
|
Hongos aislados |
Sector aislado |
|
Aspergillus sp. |
Janeiro |
|
Aspergillus sp. |
El Canal |
|
Beauveria sp. |
El Canal |
|
Cladosporium (1)
sp. |
El Chivo |
|
Cladosporium (1)
sp. |
Mata de Coco |
|
Cladosporium (2)
sp. |
El Canal |
|
Cladosporium (2)
sp. |
Santa Rosa |
|
Colletotrichum sp. |
El Canal |
|
Penicillium (1)
sp. |
Mata de Coco |
|
Penicillium (2)
sp. |
Santa Rosa |
|
Penicillium (2)
sp. |
Las Rurales |
|
Penicillum (3)
sp. |
El Canal |
|
Penicillum (3)
sp. |
Janeiro |
|
Sclerotium sp. |
Puerto Concha |
|
Tilletiopsis sp. |
Puerto Concha |
|
Tilletiopsis sp. |
Km. 18 |
|
Tilletiopsis sp. |
El Chivo |
|
Trichoderma harzianum |
El Canal |
|
Trichoderma harzianum |
El Canal |
|
(1)
(2) y (3): Corresponde a un mismo género pero con diferencias en el
crecimiento y coloración del fondo del plato Petri. |
|
Otro
aspecto observado es la diversificación del crecimiento de los hongos aislados por
sector muestreado. Una mayor biodiversidad fue encontrada en el sector “El
Canal”, registrando seis géneros distintos (Aspergillus, Beauveria,
Cladosporium(2), Colletotrichum, Penicillum(3), Trichoderma(1)).
Con dos crecimientos por cada sector muestreado se encontraron los siguientes
géneros: (Penicillum(3), Aspergillus) en el sector Janeiro;
Tilletiopsis, Cladosporium(1) en el sector El Chivo; Cladosporium(2),
Penicillum(2) en Santa Rosa; Tilletiopsis,
Sclerotium en Puerto
Concha y Penicillum(1), Cladosporium(1) en Mata de Coco.
Finalmente un crecimiento por sector se encontraron los siguientes géneros: en
Km. 18 (Tilletiopsis) y Las Rurales (Penicillum(2)).
El 100% de los géneros aislados
corresponde a hongos comunes que se desarrollan en diferentes sustratos,
frecuentemente encontrados en el suelo (Domsch et al., 1980) y ninguno de ellos ha sido señalado como patógeno del
cultivo del plátano. Sin embargo, se sabe que los géneros Cladosporium y Penicillum, son causantes
de las enfermedades conocidas como podredumbre verde, azul y gris en cítricos
(Palmanaranja, 2005). El género Colletotrichum sp., produce la
antracnosis en guanábana (Álvarez et al.,
2004) y el género Sclerotium
sp., causa daños en los
cultivos de tomate y pimentón (Ramírez et al., 1998).
Los géneros Penicillum y Cladosporium mostraron
diferencias en cuanto a la topografía,
coloración de la colonia y tinción del medio en el fondo del plato Petri; por
lo que se presume que pueden existir diferentes especies presentes en estos
géneros.
La frecuencia de colonias por género de
hongos que se pudieron aislar bajo la metodología de dilución (Figura 2)
permitió visualizar que Penicillium fue el género que dominó en el
estudio debido a que se presentó en la mayoría de las zonas muestreadas
(Janeiro, Puerto concha, El Canal, Santa rosa, Mata de Coco y Las Rurales) con
un total de 5 colonias aisladas. Cladosporium sp. fue el segundo género más frecuente con 4 aislados, le siguieron Tilletiopsis sp., con 3
aislados, Aspergillus sp.,
y Trichoderma harzianum, con 2 aislados y los géneros menos
frecuentes con 1 aislado respectivamente,
fueron los hongos Beauveria sp., Colletotrichum sp., Sclerotium
sp.
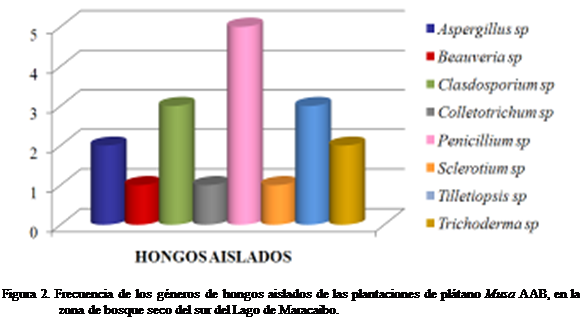
Los hongos identificados como Aspergillus, Cladosporium, y Penicillum,
presentan un amplio rango de supervivencia y una alta habilidad saprofítica competitiva
bajo diferentes condiciones (Domsch et al.,
1980). Estos se han encontrado en suelos sembrados de papa en zonas montañosas
de Mucuchíes en el estado Mérida (Ulacio et
al., 2002). El crecimiento de estos hongos en el bosque seco tropical del
sur del lago de Maracaibo, ocurrió con temperaturas promedio a los 27 ºC
(Strauss et al., 1986). Sin embargo,
del microambiente que se origina en las plataneras, se infiere que un descenso
de la temperatura (15 - 20 ºC) ocurre durante los períodos nocturnos, lo que
promueve el crecimiento de estos hongos, generando de cierta forma sus
condiciones de adaptabilidad. Por otra parte, la sombra proporcionada por la
misma planta de plátano en el contorno del suelo impide una radiación directa
sobre la superficie del suelo. Esta capacidad metabólica de adaptabilidad de
los hongos a las distintas condiciones ecológicas ya ha sido reportado por
Valencia et al., (2001).
Cuantificación de la densidad poblacional de hongos con
capacidad antagónica en muestras de suelo de plátano (Musa AAB cv. Hartón) en la zona
bosque seco del sur del lago de Maracaibo
Del aislamiento de hongos potenciales o con probadas acciones
antagonistas se obtuvieron los siguientes
géneros: Beauveria, Tilletiopsis y Trichoderma harzianum. Al evaluar estos resultados y contrastar la
densidad poblacional, se observó que el género Tilletiopsis sp., fue el
más frecuente entre los antagonistas encontrados, con 3 aislados (en los
sectores de Puerto Concha, Km. 18 y El Chivo), seguido de Trichoderma harzianum, con 2 aislados (El Canal) y Beauveria sp., con 1 aislado (El Canal).
El sector de muestreo "El Canal" fue el que presentó la mayor
biodiversidad antagónica agrupando dos géneros distintos (Beauveria sp., y Trichoderma sp.)
en un mismo sector.
De acuerdo a
Humeres (2004) Ulacio et al., (2002)
y Godoy (2007) los géneros Beauveria sp., Trichoderma
harzianum, y Tilletiopsis sp., corresponden a un grupo de hongos que
actualmente se están empleando en los sistemas de producción vegetal por su
eficiencia y capacidad antagónica en el control de otros hongos e insectos y
toleran amplios rangos de temperaturas ambientales.
Beauveria bassiana ha sido señalada como un controlador
biológico eficiente para el coleóptero Cosmopolites sordidus en el
cultivo de plátano (Jiménez, 1990); mientras que el género Tilletiopsis
sp., ha sido empleado para el control de oídios (Oidium sp.) en el
cultivo de uva (Haggag et al., 2007).
Uno de los hongos más estudiados para el
control biológico en los cultivos es Trichoderma harzianum, por
la agresividad y eficiencia de sus mecanismos de acción para el control de
hongos fitoparásitos y por la biodiversidad de ambientes donde habita
(Weindling 1932; Pineda et al., 1988; Donoso et al., 2003). En el caso
específico del plátano, se ha comprobado la eficiencia de Trichoderma
harzianum, para el control del hongo M. fijiensis causante de
la sigatoka negra (Azarte et al.,
2006) y reducción de las poblaciones de nematodos fitoparasíticos en banano
(Menjivar, 2005), lo que constituye
una puerta abierta para futuras investigaciones en condiciones in vitro y
en campo con el aislado encontrado en este estudio, para éste y otros patógenos
que afectan este cultivo.
CONCLUSIONES
·
El estudio permitió conocer la diversidad de géneros de
hongos en plantaciones de Musa AAB dentro del bosque seco tropical
del sur del Lago de Maracaibo.
·
La plantación “El Canal” presentó la mayor biodiversidad de
UFC. Se obtuvieron 19 aislados de hongos identificados como Aspergillus sp., Beauveria sp., Cladosporium sp.,
Colletotrichum sp., Penicillium sp.,
Sclerotium sp., Tilletiopsis sp., y Trichoderma harzianum.
·
Se tipificaron los crecimientos de los géneros Penicillum y Cladosporium.
·
Del total de aislados obtenidos, los géneros Beauveria sp., Trichoderma harzianum y Tilletiopsis
sp. fueron identificados como potenciales antagonistas
siendo Tilletiopsis sp. el género más
frecuente en las zonas de muestreo.
·
A partir de los resultados obtenidos, se puede señalar que
existe una numerosa biodiversidad de hongos en la zona de vida bosque seco
tropical asociada al cultivo del plátano. Este hecho puede deberse al criterio de selección de unidades
de producción con manejo tradicional no tecnificado.
RECOMENDACIONES
· Evaluar la eficiencia como controladores biológicos de
las principales plagas que afectan el cultivo de plátano a los hongos aislados
en la zona con los de uso comercial de esta categoría, a fin de medir los
niveles de eficacia, adaptabilidad y control, en relación a las principales
plagas que afectan el cultivo de plátano en esta zona.
· Estudiar la micobiota presente en plantaciones de
plátano en la zona de vida bosque húmedo tropical.
· Evaluar el impacto causado por el uso de plaguicidas más
comunes en la zona de vida bosque seco tropical del sur del lago de Maracaibo y
su influencia sobre la micobiota del suelo aislada.
AGRADECIMIENTO
El presente estudio forma parte del proyecto de
investigación titulado: “Evaluación del Trichoderma
harzianum como controlador biológico de las principales plagas del plátano Musa AAB en la zona Sur del Lago”
adscrito a la Coordinación de Investigación y Posgrado de la Universidad
Nacional Experimental Sur del Lago (UNESUR). Así mismo, al personal del Laboratorio
de Fundamentos Fitopatológicos de la Universidad Centro Occidental Lisandro
Alvarado.
LITERATURA CITADA
Alexander, M. 1980. Introduction to soil microbiology. Second edition.
John Wiley and sons. New York.
Álvarez, E.; C. Ospina, J. Mejía y G. Llano. 2004. Caracterización
morfológica, patogénica y genética del agente causal de la antracnosis (Colletotrichum
gloeosporioides) en guanábana (Annona muricata) en el valle del
Cacuca. Revista de Fitopatología Colombiana 28: 4-8.
Azarte, J.; A. Casimiro, M. Domínguez y O. Santos. 2006. Antagonismo del Trichoderma
spp., sobre Mycosphaerella fijiensis
Morelet, agente causal de la sigatoka negra del plátano (Musa sp.) in vitro e invernadero. Revista Mexicana de
Fitopatología 24 (2): 98-104.
Castrejón, R.; A.
Cadena, J. Aviera y D. Olmos. 2002. Paquete tecnológico para el cultivo de
plátano. Revista CESAVECOL. Colombia. Edición especial. p. 2-72.
Cedillos, M. y D.
Berríos. 2002. Guía técnica del cultivo de plátano. Manual del Centro Nacional
de Tecnología Agropecuaria y Forestal (CENTA) El Salvador. p. 2-34.
Centro Internacional del Plátano (CIPLAT). 2004. Informe técnico
económico anual de la Finca Monte Rico. Corporación para el desarrollo de la
región Zuliana (CORPOZULIA). Pueblo nuevo (El Chivo), Estado Zulia.
Mimeografiado.
Coraspe, H. y S.
Tejera. 1996. Procedimiento para la toma de muestras de suelos. Revista Fonaiap
Divulga Nº 54. Suelos y fertilización. p. 7-10.
Domsch, K. M. G. and A.
Traute Heidi. 1980. Compendium of soil fungi. Volumen 1. Academy press. London.
Donoso, A. y M. Soledad. 2003. Control biológico de Fusarium spp., en tomate (Lycopersicon esculentum Mill.) mediante
antagonistas fungosos. Trabajo especial de grado para optar al título de
Ingeniería Agrónoma, Facultad de Ciencias Agronómicas, Universidad de Chile.
Chile. Mimeografiado.
García L.; H. Cárdenas, J. Labarca, L. Chávez, A. M. Casassa Padrón y L.
Sandoval. 2007. Evaluación del daño causado por nematodos fitoparásiticos
asociados a raíces de plátano (Musa
AAB cv. Hárton), tratadas con Trichoderma
harzianum y nim (Azadirachta indica),
en el municipio Francisco Javier Pulgar, Estado Zulia, Venezuela. Nematropica
37 (2): 156.
García J. y L. Sosa. 1980. Caracterización de los
síntomas producidos por la ausencia de elementos nutritivos en el cultivo del
plátano (Musa AAB), cv. Hartón. Memorias II Encuentro Nacional de
Investigadores en Plátanos y Cambures. SVIA-FONAIAP-LUZ. Maracaibo, Estado
Zulia. p. 24-45.
Godoy, J.; R. Valera, C. Guédez, L. Cánsales y C. Castillo.
2007. Determinación de temperatura y
humedad óptima para la germinación y esporulación de cinco aislamientos de Beauveria
bassiana. Revista Facultad de
Agronomía (LUZ). Volumen 24 (3): 415-425.
Haggag, M., M.
Saker, A. Ibrahin 2007. Biocontrol activity
and molecular characterization of three Tilletiopsis
spp., against grape powdery mildew. Plant. Prot. 49: 39-56.
Humeres, C. 2004.
Evaluación de la capacidad biocontroladora de dos cepas nativas de Trichoderma spp., sobre aislados de
hongos basidiomycetes asociados a muerte de brazos en kiwi. Trabajo de Grado.
Universidad de Talca. Facultad de Ciencias Agrarias. p. 45.
Jiménez, J. 1990.
Determinación de la efectividad de Beauveira
bassiana, Metarhizium
anisopliae y Pheidole megacephala en
el control de Cosmopolites sordidus
en banano. Informe final de la investigación INISAV. p. 24.
Labarca, J.; M. Marín y
J. García. 2005. Factores técnicos relacionados con la calidad de exportación
de plátano (Musa AAB) cv Hartón. Trabajo especial de convalidación.
Programa de Maestría en Fruticultura, División de Estudios para Graduados,
Facultad de Agronomía, Universidad del Zulia.
Maracaibo, Estado Zulia. Venezuela. Mimeografiado.
Menjivar, R. 2005. Estudio
del potencial antagonista de hongos endofíticos para el biocontrol del nematodo
barrenador Radopholus similis (Cobb) Thorne, en plantaciones de banano
en Costa Rica. Trabajo de Grado. Centro Agronómico de Investigación y
Enseñanza. Escuela de Posgrado. p. 15-81.
Montiel, A.; L. Sosa,
C. Medrano y D. Romero. 1997. Nematodos fitoparásitos en plantaciones de
plátano (Musa AAB) de la margen
izquierda del río Chama, Estado Zulia, Venezuela. Revista Facultad de Agronomía (LUZ). Volumen 14:
245-251.
Nava, C. 1999.
Problemática del cultivo del plátano en Venezuela. Memorias IX Reunión ACORBAT,
Mérida, Venezuela. p. 643-653.
Ordosgoitti, A. 2004.
Enfermedades del banano y plátano en Venezuela. Medidas de control. Ediciones
de FONAIAP. Serie B. Nº 37. p. 7-71.
Palmanaranja Asociación
Citrícola. 2005. III Jornadas de cítricos. Ediciones Deauno Documenta. p. 8-55.
Pineda, J.; R. Ercilla
y E. Gonnella. 1988. Evaluación del control biológico de Macrophomina phaseolina en
ajonjolí (Sesamum indicum L.). Revista Agronomía
Tropical 38 (4-6): 43-48.
Pitt, J. and A. Hocking. 1997. Fungi and Food Spoilage. Second edition.
Blackie Academic & Professional, London. 836 p.
Pocasangre L.; R. Menjivar, A. Felde, A. Riveros, F. Rosales y R.
Sikora. 2006. Hongos endofíticos como
agentes biológicos de control de fitonematodos en banano. Memorias XVIIl Reunión ACORBAT. p. 249-254.
Ramírez,
R.; R. Santos, F. Bracho, L. Sandoval y C. Castro. 1998. Control de Sclerotium
rolfsii Sacc con fungicidas y humus. Revista Facultad de Agronomía (LUZ)
15: 535-544.
Strauss, E.; W.
Fuenmayor y J. Romero. 1986. Atlas estado Zulia. Síntesis histórica y
demográfica del estado Zulia. Segunda edición. p. 114-117.
Ulacio, D.; D. Pérez y J. Pineda. 1997. Micoflora asociada a las raíces
de las plantas de tabaco (Nicotina
tabacum) provenientes del estado Portuguesa Bioagro 9: 3-11.
Ulacio, D.; J. Salas, P. Quevedo y M. Sanabria. 2002. Micobiota del suelo
de zonas productoras de papa del estado Mérida y su relación con Rhizoctonia solani. Bioagro 14: 11-16.
Valencia, E. y J. Peña. 2001. El suelo y sus habitantes microbianos:
consideraciones ecológicas. Revista Avance y Perspectiva
20: 401-406.
Weindling, R. 1932. Trichoderma lignorum as a
parasite of other soil fungi. Phytopathology 22: 837-845.
Zavaleta
Mejía, E. 2000. Alternativa de manejo de las enfermedades de las plantas.
Revista Terra Latinoamericana 17 (3): 201- 207.
Página
diseñada por Prof. Jesús Rafael Méndez Natera
TABLA DE CONTENIDO DE LA REVISTA CIENTÍFICA UDO
AGRÍCOLA



