Revista Científica UDO Agrícola Volumen 9.
Número 1. Año 2009. Páginas: 148-157
Evaluación de la antracnosis (Colletotrichum sp.) en guanábana (Annona muricata L.) tipo Gigante en el sector Moralito del estado Zulia, Venezuela
Evaluation of anthracnose (Colletotrichum
sp.) in Annona muricata L. Giant type in the sector
Moralito, Zulia State, Venezuela
Indira ANDRADES1, Franco YENDER ![]() 1,
Johanna LABARCA1, Dilcia ULACIO2,
Claudia PAREDES1 y Yuleiska
MARÍN3
1,
Johanna LABARCA1, Dilcia ULACIO2,
Claudia PAREDES1 y Yuleiska
MARÍN3
1Universidad
Nacional Experimental Sur del Lago (UNESUR). Programa Ingeniería de ![]() Autor para
correspondencia
Autor para
correspondencia
|
Recibido: 03/07/2008 |
Fin
de primer arbitraje: 23/02/2009 |
Primera
revisión recibida: 03/04/2009 |
|
Fin de segundo arbitraje: 20/04/2009 |
Segunda revisión
recibida: 28/04/2009 |
Aceptado: 30/04/2009 |
RESUMEN
Con el fin de evaluar la antracnosis (Colletotrichum sp.) en guanábana (Annona muricata L.) tipo “Gigante”
en el Sector Moralito del estado Zulia, se seleccionaron
al azar 20 árboles, en una plantación comercial de 7 años de edad, en cada
planta se marcaron todos los frutos sanos presentes, con edades comprendidas
entre 5 y 8 días de haber cuajado (etapa de erizos), para un total de 126
frutos. Se realizó aislamientos de los hongos presentes en los frutos, se
determinó la severidad de la antracnosis en
las diferentes etapas de crecimiento de éstos,
se relacionó la precipitación con el mayor grado de severidad de la enfermedad.
Los frutos sanos por etapa fueron inoculados con los hongos identificados y la
combinación de ellos. Los resultados demuestran que la enfermedad es más severa
en la etapa I (30 días) y II (60 días) de crecimiento del fruto, con promedios
de severidad 9,65 (etapa I) y 8,53
(etapa II), relacionados con el momento de mayor precipitación (
Palabras
clave: Antracnosis, Colletotrichum sp., Annona muricata, guanábana,
incidencia.
ABSTRACT
With the purpose of evaluating
the anthracnose (Colletotrichum
sp.) in Annona muricata L.
“giant type” in the Moralito sector in Zulia state,
there were selected, totally at random, 20 plants from a comercial
plantation, which was 7 years old, for each plant, all the healthy fruit present were marked, with ages ranking
from 5 to 8 days of having been curd (burr stage), for a total of 126 fruits.
The lenght of the fruit was measured, to determine
the severity of the anthacnosis in the different
stages of the growth. The precipitation data was taken to correlate with the
highest severity moment of the disease. The present fungus was isolated for
each fruit in orden to complay
with the koch process. The healthy fruit in each
stage were inoculated for each of the identified fungus and their mixture. The
results showed that the disease is more severe in stage I (30 days) and II (60
days) of the growth of the fruit with severity average in stage I (9,6500) and
II (8,5333), due to the high level of precipitation, reached in the fourth week
(50 mm/water) and in the eighth week (145 mm/water). The incidence of the
disease reached 100% in all stages. Three colonies of Colletotrichum sp., were indicated, presenting
different morphological characteristics and one of Fusarium sp., according to Koch
process. It was corroborated that the damage was caused by the Colletotrichum
spp., fungus being more aggressive when it acts in association with other
fungi.
Key words: Anthracnose, Colletotrichum
sp., Annona muricata,
incidence.
INTRODUCCIÓN
El cultivo de
guanábana (Annona muricata L.)
tiene grandes perspectivas como frutal, tanto para el mercado nacional como
internacional, por sus cualidades nutricionales para el consumo fresco y
agroindustrial (Perés-Martínez
et al., 2004). En Venezuela existen alrededor de
Este cultivo se ha desarrollado fácilmente en
las condiciones agroecológicas de la planicie de Maracaibo, debido a su adaptación a esta zona, es una alternativa a
la disminución de la explotación del guayabo. Sin embargo, la
propagación de las plantas se ha realizado de forma sexual obteniéndose una
gran desuniformidad en las plantaciones comerciales
(Pérez et al., 2004). Existen muchas
enfermedades que atacan al cultivo de guanábana como: secamiento de ramas
causada por Diplodia sp., mancha de las hojas (Scolecotrichum sp.), siendo la de mayor importancia económica la
antracnosis (Colletotrichum sp.), la cual
resulta más agresiva en las zonas con humedad relativa alta.
La antracnosis causa una pudrición negra en los frutos y ataca en
todas las etapas de su desarrollo, principalmente en los
tejidos tiernos. Los frutos se momifican y caen; en el vivero provoca
necrosis en el cuello del tallo y en las ramas terminales. Se ha observado que
los árboles que crecen en condiciones poco favorables como mal drenaje, plagas,
entre otros; son más afectados por la antracnosis, por lo que se recomienda un
manejo adecuado de la plantación (MAG, 2008).
Actualmente, la
antracnosis está siendo considerada en el rubro de guanábana, como una de las enfermedades que más afecta el rendimiento y calidad del
producto final, debido a que las condiciones edafoclimáticas
son favorables para la expansión de la misma (Álvarez et al., 2005). En tal sentido se planteó en esta investigación:
a)
Demostrar
que los síntomas observados en los frutos colectados, son inducidos por el
hongo Colletotrichum sp.
b)
Determinar
el grado de severidad de la antracnosis (Colletotrichum sp.), en
diferentes etapas de crecimiento del fruto de guanábana (Annona muricata L.) tipo “Gigante”.
c)
Determinar
el momento de mayor severidad de la enfermedad con respecto a la precipitación
durante los tres meses de evaluación.
d)
Determinar
la incidencia de la antracnosis en los frutos
presentes en cada una de las plantas de guanábana.
MATERIALES Y MÉTODOS
Localización del ensayo
Se realizó en la unidad de producción “Las Chamitas”
propiedad del señor Jairo Toros, en una plantación comercial de guanábana Tipo
“Gigante” de 7 años de edad, ubicada en el Sector Moralito
del municipio Colón del estado Zulia, cuya altitud es
menor de
Análisis de campo
Dentro de la plantación, hay un total
de 124 plantas (1 ha) de guanábana, se tomaron 20 al azar, identificadas con un
código, (Px – Hx – Nx), donde “P” es la planta a muestrear, “H” es la hilera
donde está ubicada, y la letra “N” es el número de su ubicación en la hilera.
Para la evaluación se
tomó en cuenta el manejo agronómico que realiza el productor, se marcaron
frutos sanos en cada una de las plantas, con edades comprendidas entre cinco y
ocho días de haber cuajado (etapa de erizos) a los mismos se le colocaron
cintas de diferentes colores por semana para llevar un registro de acuerdo a la
fecha de marcaje y se le colocó un número dependiendo de la cantidad de erizos
que se encontraron por planta, alcanzando un número total de 126
frutos, se evaluó la severidad de la antracnosis, utilizando una escala visual
(Cuadro 1) según Anculle y Álvarez, (2006).
|
Cuadro
1. Escala de grado de severidad. |
|
|
Grado |
Severidad (%) |
|
0 |
0 |
|
1 |
0-3 |
|
2 |
3-6 |
|
3 |
6-12 |
|
4 |
12-25 |
|
5 |
25-50 |
|
6 |
50-75 |
|
7 |
75-87 |
|
8 |
87-94 |
|
9 |
94-97 |
|
10 |
97-100 |
|
11 |
100 |
La longitud de cada
fruto fue medida para relacionar las fases de desarrollo con el grado de severidad
presente en los mismos, para esto se tomaron en cuenta cuatro etapas: etapa I
(1-7cm de longitud = de
Para determinar el
momento de severidad de la enfermedad del fruto con relación a la precipitación
de los tres meses de evaluación se tomaron en cuenta los datos obtenidos por el
Fondo de Consorcio de Innovación (FCI 05 PR 52 – 3) que registran datos
climáticos dentro de
Se determinó la
incidencia de la enfermedad tomando en cuenta el número de frutos enfermos con
respecto al número de frutos sanos por planta mediante una fórmula matemática
(Figura 1) según Anculle y
Álvarez, (2006).

Análisis de laboratorio
Aislamiento
del patógeno
Los frutos caídos por causa de la enfermedad, o aquellos
que alcanzaron el mayor grado (momificado), en la escala visual de severidad,
fueron llevados al laboratorio para ser aislado los patógenos y posteriormente
ser identificados.
Para este proceso se
utilizaron los medios de cultivos Papa
Dextrosa Agar (PDA) y Jugo V8 para aquellos hongos que no desarrollaron su fase
reproductiva en medio de cultivo (PDA).
Preparación del área de trabajo
a) Se desinfectaron los frutos con cloro por
un (1) min. usando una concentración de 1ml.
al 2% en 100 ml. de agua destilada.
b) Se lavaron los frutos con agua destilada
estéril por un (1) min., para eliminar los restos de cloro y cualquier impureza que pudiese quedar en la cutícula, luego se dejaron secar
completamente.
Se realizó el proceso de aislamiento de las
muestras, en medios de cultivos papa dextrosa agar (PDA), se sellaron las
cápsulas con papel parafilmMR, se
rotularon en la parte superior con el número de la planta y el número de fruto
recolectado, la fecha en que fue sembrada y el grado de severidad de la
enfermedad en el mismo. Se incubaron las cápsulas en el laboratorio a una
temperatura aproximada de
Posteriormente se realizó la identificación de los
patógenos, mediante las características culturales y las estructuras reproductivas que
presentaron cada una de las colonias aisladas. Cabe destacar que las mismas se
obtuvieron en condición totalmente pura.
Para corroborar que los síntomas observados en los
frutos colectados en campo, fueron ocasionados por los hongos aislados (Fusarium sp. y
Colletotrichum
sp.), se aplicaron los postulados de Koch (Agrios,
1999). Se recolectaron frutos sanos de las diferentes etapas de crecimiento
descritos anteriormente, los cuales fueron trasladados al laboratorio de
Microbiología y Fitopatología de
Se desinfectaron los frutos con hipoclorito de sodio
al 2% por 2 minutos, luego se lavaron con agua destilada dejándolos secar a
temperatura ambiente, seguidamente se le ocasionaron heridas al mismo, se
asperjaron con los patógenos identificados
utilizando un atomizador manual y finalmente se colocaron en cámara
húmeda.
El inoculo se obtuvo realizando un raspado al patógeno
mezclándolo con agua estéril.
Para cumplir con los postulados de Koch, se inocularon
2 frutos de guanábana (Annona muricata L.)
Tipo Gigante por etapa de crecimiento, con cada una de los patógenos aislados
por separado y la mezcla de ellos, en los cuales se encontraban el Fusarium sp. y
Colletotrichum
sp., este último tenia tres
colonias con características culturales diferentes.
Todos los tratamientos se dejaron en el laboratorio a
temperatura ambiente, (
RESULTADOS Y DISCUSIÓN
Evaluación
de la severidad de la antracnosis (Colletotrichum sp.) en guanábana (Annona muricata L.) tipo “gigante” en las diferentes etapas de
crecimiento del fruto
Los resultados obtenidos
demuestran alto nivel de significancia, de acuerdo a los datos recolectados en
campo, con respecto a la severidad por etapa de crecimiento del fruto, el grado
de severidad durante las doce semanas de evaluación, y la interacción que
existe entre las etapas y semanas de acuerdo a la severidad de la enfermedad en
los frutos de guanábana (Cuadro 2).
|
Cuadro
2. Grado de significación de los resultados obtenidos según el análisis de
varianza (ANOVA). |
|||||
|
Fuente de Variación |
Suma
de Cuadrados Tipo III |
Grados
de Libertad |
Media
Cuadrática |
F |
Significación |
|
Modelo |
5912,770a |
31 |
190,735 |
29,575 |
< 0,01 |
|
Etapa |
191,256 |
3 |
63,752 |
9,885 |
< 0,01 |
|
Semana |
119,791 |
9 |
13,310 |
2,064 |
0,041 |
|
Etapa
* Semana |
336,892 |
18 |
18,716 |
2,902 |
< 0,01 |
|
Error |
606,230 |
94 |
6,449 |
|
|
|
Total |
6519,000 |
125 |
|
|
|
La
enfermedad fue más severa durante la etapa I, con 9,6500 grados seguida de la
etapa II, alcanzando los 8,5333 grados (Cuadro 3). Esto se debe a que los
frutos que se encuentran entre estas etapas, están fisiológicamente inmaduros
lo cual son más vulnerables a la enfermedad de acuerdo a los resultados
reportados por Villanueva et al.
(2006), quienes determinaron que el hongo Colletotrichum sp., es el causante de la enfermedad de
los frutos inmaduros de chirimoya (Annona cherimola Mill.), llegando a
momificarlos completamente.
|
Cuadro 3. Agrupaciones por
subconjunto del grado de severidad de la antracnosis (Colletotrichum sp.) por
etapas de crecimiento de frutos de guanábana (Annona muricata L.). |
||||
|
Etapas |
N |
Subconjunto |
||
|
1 |
2 |
|||
|
DHS de Tukey a,b,c, |
4 3 2 1 Significación |
28 47 30 20 |
3,7143 b 4,4681 b 0,678 |
8,5333 a 9,6500 a 0,351 |
Padrón (1991) explica
que los frutos, en sus primeras etapas de desarrollo, aumentan progresivamente
su tasa respiratoria, ya que esta, está ampliamente relacionada con la
actividad bioquímica del mismo para lograr un crecimiento normal hasta llegar a
su etapa de maduración, en este momento los frutos se encuentran susceptibles a
enfermedades por el esfuerzo que deben realizar hasta llegar a la madurez
fisiológica.
Rondón (1997) expresa
que en la dinámica de la infección por tamaño del fruto de tomate, se
observa una mayor susceptibilidad de los
frutos verde mediano, verde pequeño y verde grande, debido muy posiblemente a
sus características bioquímicas y quizás a la mayor duración de estas etapas en
el campo, como blanco de la infección.
También se debe a que en estas
etapas de desarrollo, el fruto se encuentra tierno y puede ser penetrado
fácilmente por insectos, facilitando la penetración del hongo en los tejidos
del mismo con más rapidez, favoreciendo
el progreso de la misma, relacionado con lo descrito por Avilán et al. (1992), explicando que la antracnosis, se
encuentra asociada con insectos.
El Cuadro 4 muestra las
agrupaciones por subconjunto del grado de severidad de la enfermedad en los
frutos, por las semanas de evaluación,
según pruebas de media por Tukey,
encontrándose los niveles más altos de severidad en la semana 4 con (9,6364) y
la semana 8 con (8,6667).
|
Cuadro
4. Agrupaciones por subconjunto del grado de severidad del fruto por semanas
de evaluación. |
||||||
|
Semanas
|
N |
Subconjunto |
||||
|
1 |
2 |
3 |
4 |
|||
|
DHS de Tukey
a,b,c |
12 11 9 7 10 3 6 5 8 4 Significación |
21 16 15 9 15 4 7 3 24 11 |
2,5714 4,0625 5,3333 5,7778 6,3333 0,093 |
4,0625 5,3333 5,7778 6,3333 7,0000 7,2857 8,0000 0,064 |
5,3333 5,7778 6,3333 7,0000 7,2857 8,0000 8,6667 0,204 |
5,7778 6,3333 7,0000 7,2857 8,0000 8,6667 9,6364 0,076 |
En la Figura 2, se observa que
en las semanas 4 y 8 presentaron los
niveles más altos de precipitación alcanzando
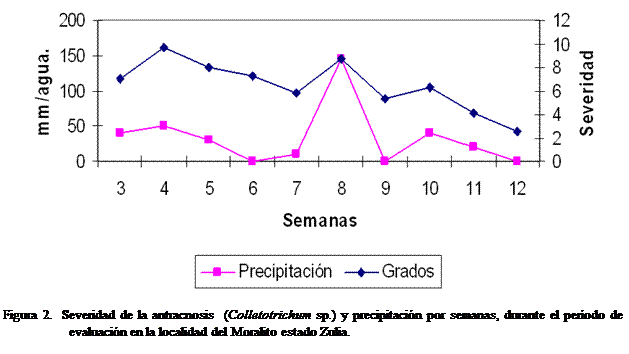
Incidencia
de la antracnosis (Colletotrichum sp.) en los frutos presente en cada una de
las plantas de guanábana (Annona muricata L.) tipo gigante.
La incidencia
de la antracnosis causada por el hongo (Colletotrichum sp.), en plantas de guanábana (Annona muricata L.), representa el 100% ya que los 126 frutos que fueron
evaluados en las 20 plantas, presentaron los síntomas de la enfermedad. Esto se
debe a que las condiciones climáticas fueron favorables para el desarrollo de
la misma, resultados que nos permiten relacionarlos con lo descrito por Álvarez
et al. (2005) expresando que la incidencia de la
enfermedad se incrementa debido a factores como la selección inadecuada de
zonas agroecológicas, distancia de siembra, drenaje, podas, fertilización, poco
o deficiente manejo de poda e inadecuado uso de fungicidas.
Aislamiento
e identificación de los hongos
En
los aislamientos en frutos de guanábana (Annona muricata L), realizados en el
laboratorio de Microbiología y Fitopatología de
Descripción
de las colonias
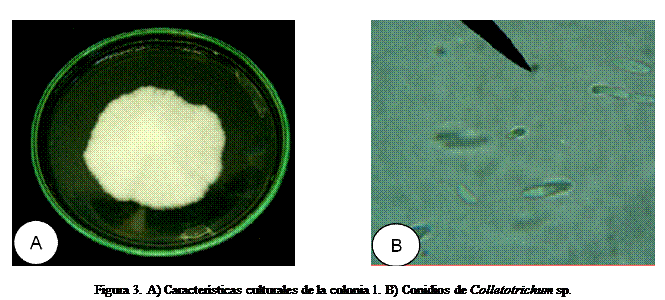
Colonia Nº 1: Color blanco, con bordes pocos definidos de color
crema, forma redonda, de crecimiento rápido (5 días) y no muy amplio el cual
abarco el 50% de la cápsula de Petri, esta representó el 40% de las muestras
aisladas. Fue identificada como: Colletotrichum sp.
Colonia Nº 2: Color naranja claro, con un halo naranja oscuro bien definido en la mitad de la
colonia, con bordes definidos de color naranja oscuro, de crecimiento rápido (5
días), abarcando el 50% de la cápsula de
Petri, esta representó el 30% de las muestras aisladas. Fue identificada como: Colletotrichum sp.
Colonia Nº 3: Color gris oscuro con un punto blanco en el centro de
la colonia con puntos negros y blancos alrededor de la misma, forma circular de
crecimiento rápido (5 días), abarcando el 100% de la cápsula de
Petri, este último fue repicado y sembrado en medio de cultivo Jugo V8, ya que
en el medio de cultivo (PDA) Papa Dextrosa Agar, no se formaron estructuras reproductivas
para su posterior identificación, esta representó el 20% de las muestras
aisladas. Fue identificada como: Colletotrichum sp.
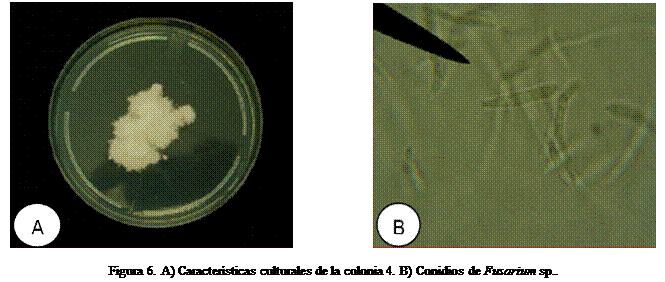
Colonia Nº 4: Color rosado claro con bordes no definidos, forma
irregular, crecimiento lento abarcando el 40% de la cápsula
de Petri, en (5 días), esta representó
el 10% de las muestras aisladas. Fue identificada como: Fusarium sp.
La diferencia de las
características culturales entre las colonias Nº (1, 2, 3) indica que se tratan
posiblemente, de tres especies de Colletotrichum diferentes,
asociadas a la enfermedad. Este resultado difiere, contrasta con la
investigación de Álvarez et al.
(2005), que comenta que existen al menos
dos (2) especies de Colletotrichum sp.,
asociadas a la antracnosis en guanábana. Villanueva et al. (2006), expresan que pueden encontrar más de una
especie de patógeno atacando frutos u otros órganos de un mismo hospedante,
entre los cuales se mencionan: Colletotrichum acutatum, Colletotrichum gloeosporioides y Colletotrichum fragariae.
Por otra parte, Lugo y Fuguet (2004) mencionan, que en estudios realizados se
demuestra que junto al Colletotrichum spp., se han identificado géneros de hongos
como Fusarium sp.,
Mycosphaerella sp., entre otros, lo cual concuerda con
los resultados obtenidos en las evaluaciones realizadas. Las estructuras
reproductivas (conidios) de las tres colonias identificadas como Colletotrichum sp.
presentaron características diferentes, en el caso de la colonia 1 (Figura 3),
con forma alargada y pequeñas curvaturas; la colonia 2 (Figura 4), con forma un
poco más redondeada y pequeña que la
colonia 1; y la colonia 3 (Figura 5), presentó una forma alargada con puntas
agudas y más pequeña que las colonias anteriores. Estas características
concuerdan con las descritas por Oliveira et al., (2005). La colonia identificada como Fusarium sp., que corresponde a la colonia 4
(Figura 6), presentó macroconidios curvados, pluriseptados, con una célula apical más o menos
puntiaguda, con una longitud mayor a los conidios de las colonias anteriormente
mencionadas, características iguales a las mencionadas por Carrillo, (2007).


Postulados
de Koch
De los
frutos inoculados, a las 24 horas después no presentaron síntomas de la enfermedad;
a las 48 horas se empezaron a mostrar pequeñas manchas con motas algodonosas
sobre las heridas que se le ocasionaron al fruto, esto concuerda con lo
descrito por Avilán et al. (1992), refiriéndose que la antracnosis esta
asociada con las heridas causadas por insectos. Estos frutos presentaron
síntomas característicos de la antracnosis, a excepción del testigo que permaneció
completamente sano, a las 72 horas después de la inoculación se observo que en los frutos de las etapas (I y II) la enfermedad
ya había alcanzado un grado de severidad entre 7 y 11, asemejándose más a los
síntomas observados en campo, tales como manchas de color marrón oscuro produciendo una pudrición seca en todo el área
del fruto (momificación), para las que fueron inoculadas con las colonias de Colletotrichum sp. así mismo las inoculadas con todas las colonias,
iguales a las características descrita por Avilán et al.,
(1992).
Los frutos que fueron inoculados con Fusarium sp., presentaron una pudrición húmeda
color marrón. Los frutos de las etapas (III y IV) inoculados con Colletotrichum sp.,
alcanzaron grado 10, según la escala de
severidad, manteniendo las mismas características del inoculado en las etapas
(I y II), de igual forma, ocurrió en los frutos inoculados con la mezcla de las
colonias, presentando varias manchas, predominando la pudrición seca alcanzando
grado 4 de severidad. El testigo al cual sólo se le ocasionaron heridas, se
mantuvo sano durante todo el periodo de evaluación, lo que quiere decir, que
las manchas presentes en los frutos, si fueron ocasionadas por los géneros de
hongos inoculados, descartando la posibilidad de que ya estos frutos estuviesen
inoculados por el patógeno.
Estos resultados coinciden con lo descrito por
Villanueva et
al. (2006), quienes determinaron que a las 72 horas el hongo Colletotrichum sp., había
completado el ciclo de la enfermedad momificando completamente los frutos
inmaduros de chirimoya (Annona cherimola Mill.), por tanto que los resultados obtenidos en esta
investigación permiten relacionar la antracnosis con el daño ocasionado por el
hongo Colletotrichum sp.
Luego de haber transcurrido las 72 horas de evaluación
se aisló el hongo de cada tratamiento de inoculación el cual se corroboro que
el hongo causante de la mancha en los
frutos de Guanábana (Annona muricata L.) Tipo Gigante, fue identificado como Colletotrichum sp., (Figura 7). Estos resultados
concuerdan con los obtenido por Lugo y Fuguet,
(2004), que determinaron que el Colletotrichum gloeosporioides, es el principal causante de los síntomas observados en frutos de
lechosa (Carica papaya L.), en diferentes estados de
desarrollo.

Se puede decir que el complejo de microorganismos patógenos
ayudan a que la enfermedad sea más severa en contraposición al efecto que pueda
causar uno por si solo, como lo explica Morales
y Rodríguez (2006), quienes
identificaron Colletotrichum
sp.,
asociado con Fusarium sp., y Alternaria sp., en frutos de mango en diferentes edades
de desarrollo.
La antracnosis (Colletotrichum sp.) es más severa en los frutos que se encuentran
inmaduros fisiológicamente correspondientes a las etapas I y II, con
aproximadamente entre uno y dos meses de
edad.
CONCLUSIONES
· De acuerdo a los aislamientos realizados en
laboratorio se encontraron cuatro colonias, de las cuales tres corresponden a
un mismo género de hongo identificado como Colletotrichum spp., con características culturales diferentes, se puede inferir que se tratan de
especies distintas, y la otra colonia
como Fusarium sp.
· Se pudo demostrar mediante los postulados de Koch, que
el causante principal de los síntomas presentes en los frutos de guanábana (Annona muricata L.)
tipo “gigante”, es el hongo Colletotrichum sp. siendo esta más severa cuando actúa en asociación con otros
patógenos.
· La enfermedad es más severa en las primeras etapas de
crecimiento del fruto en el cual se encuentran fisiológicamente inmaduros.
·
Las altas
precipitaciones son favorables para el desarrollo de la enfermedad.
· La incidencia de la enfermedad en el cultivo de
guanábana (Annona muricata L.),
alcanzó el 100% de los frutos evaluados.
RECOMENDACIONES
· Se considera fundamental desarrollar nuevas
investigaciones biológicas y moleculares, para determinar las especies de Colletotrichum spp., que se encuentran asociadas en los daños causados por la enfermedad en los frutos de
guanábana (Annona muricata L.)
tipo “gigante”.
· Evaluar la severidad e incidencia de la antracnosis (Colletotrichum spp.), en frutos de guanábana (Annona muricata L.) tipo “gigante”, en épocas
de verano, durante todo el año.
· Evaluar el manejo agronómico del cultivo y su relación
con la incidencia de la enfermedad.
LITERATURA CITADA
Agrios, N. 1999. Fitopatología.
Editorial Limusa. México. p. 393- 400.
Alcaldía del municipio Colón. 2007.
Crónicas de Colón, Municipio Colón,
Estado Zulia, Venezuela.
Disponible en: www.cronicasdecolon.org.ve/
discurso.htm [Consultada: 2008, febrero 19].
Álvarez, E.; C. Ospina, J. Media, y G. Llano. 2005.
Caracterización morfológica, patogénica del agente causal de la antracnosis (Colletotrichum gloeosporioides) en guanábana (Annona muricata L.)
en el Valle de Cauca. Revista de
Fitopatología Colombiana 28 (1): 1-8.
Anculle, A. y R. Álvarez. 2006. Evaluación de enfermedades de plantas, disponible en:
http://www.senasa.gob.pe/servicios/intranet/capacitacion/cursos/curso_arequipa/evaluacion_enfermedades_plantas_1.pdf
[Consultada: 2007, abril 10].
Avilán, L.; F. Leal y D. Bautista. 1992. Manual
de fruticultura. Segunda Edición. Editorial América. Caracas, Venezuela.
p. 446-463.
Benavides, D. y
K. Salazar. 2005. Técnicas para inducir floración en guanábana (Annona
muricata L.)
Tipo Gigante, en
Carrillo, L 2007. Los hongos
de los alimentos forrajeros. Capitulo 6. Morfología
del Fusarium. disponible en: www.unsa.edu.ar/matbib/hongos/
06htextofusarios.pdf [Consultada: 2007, abril 18].
Finch,
C. y N. Finch. 1974. Los hongos comunes
que atacan cultivos en América Latina. Editorial Trillas. México. p. 35-58.
Lugo, Z. y R. Fuguet. 2004. Antracnosis en frutos de lechosa (Carica
papaya L.) del tipo Maradol causada por Colletotrichum gloeosporioides
Pentz en el Estado Falcón. Revista de
Facultad de Agronomía (LUZ) 21 (1): 207-212.
Yamarte, M.; L. Avilán,
M. Marín, E. Rendiles, M. J. Tales, J. Solarte y R. Maldonado.
2004. Fenología floral del guanábano (Annona muricata L.)
injertado sobre combinaciones de patrones y a pie franco. Rev. Fac. Agron. (LUZ) 21 Supl. 1: 91-101.
Ministerio de Agricultura Ganadería (MAG). 2008.
Guanábana (Annona
muricata L)
Annonaceae,
disponible en: http://www.mag.go.cr/
[Consultada: 2008, febrero 19].
Morales, V. y M. Rodríguez. 2006. Hongos endófitos en
plantaciones de mango “Haden” de
Oliveira, R.; J. Moral, K. Bouhmidi
y A. Trapero. 2005. Caracterización morfológica y cultural de aislamientos de Colletotrichum spp. causantes de la antracnosis de olivo. Boletín de
Sanidad Vegetal. Plagas 31 (4): 531-548.
Padrón, J. 1991. Elementos de Fisiología Vegetal. Editorial
Pueblo y Educación Ciudad de
Perés-Martínez,
J.; M. Arizaleta, M. E. Sanabria y L. Brito. 2004. Características de los estomas,
densidad e índice estomático y su variación en función a la injertación
en Annona muricata L. y
A. montana MADFAC. Bioagro 16 (3): 213-218.
Pérez, E.; M.
Marín, L. Sandoval, R. Alejos, C. González y O.
Urdaneta. 2005. Calidad del fruto de guanábana para consumo fresco. Revista
de Facultad de Agronomía (LUZ) 18:
1-7.
Rondón J. 1997.
Estudio biológico y epidemiológico de la antracnosis (Colletotrichum gloeosporioides
Paenz), del tomate de árbol (Solanum betacea, (Cav)
Sendt) y generación de alternativas para su manejo
integrado en Colombia. En honor al Programa Nacional Manejo Integrado de Plagas
Colombia Santafé de Bogotá.
Villanueva,
R.; E. Cardenas, A. Hernández, A. Mora y D. Téliz. 2006. Patogénesis de la antracnosis (Colletotrichum fragariae) en
frutos de chirimoya. Revista de Agrociencia 40 (6): 773-782.
Página diseñada
por Prof. Jesús Rafael Méndez Natera
TABLA DE CONTENIDO DE LA REVISTA CIENTÍFICA UDO
AGRÍCOLA



