Revista Científica UDO Agrícola Volumen 8.
Número 1. Año 2008. Páginas: 1-22
Algunas
potencialidades de la quitina y el quitosano para usos relacionados con la
agricultura en Latinoamérica
Some potentialities of chitin and chitosan for uses
related to agriculture in Latin America
Cristóbal LÁREZ VELÁSQUEZ
Laboratorio de Polímeros, Departamento
de Química, Facultad de Ciencias, Universidad de Los Andes. Mérida 5101, Venezuela. E-mail: clarez@ula.ve
|
Recibido: 23/11/2007 |
Fin
de primer arbitraje: 22/01/2008 |
Primera
revisión recibida: 02/03/2008 |
|
Fin
de segundo arbitraje: 14/03/2008 |
Segunda
revisión recibida: 18/03/2008 |
Aceptado: 19/03/2008 |
Resumen
En este trabajo se presenta una
revisión bibliográfica sobre las principales aplicaciones de los biopolímeros
quitina y quitosano en algunas áreas relacionadas a la actividad agrícola con
el objetivo de tener una visión más técnica del estado actual del uso de estos
biopolímeros en este campo, con énfasis en la región latinoamericana. En primer
lugar, se revisan las diversas propiedades (actividad bactericida, fungicida,
antiviral, estimulante del crecimiento, capacidad inductora) que hacen del
quitosano y la quitina biomateriales sumamente atractivos para su aplicación en
el campo de la agricultura. En segundo término se presentan algunos de los usos
más comunes que actualmente se les dan a estos dos biomateriales (recubrimiento
de frutos, semillas, alimentos con películas; protección de plántulas;
clarificación de jugos de frutas; matrices para la liberación de agroquímicos;
biocidas), algunos de los cuales ya han sido aprobados legalmente en varios
países y están siendo aprovechados comercialmente. Finalmente, se presenta una
breve revisión de la tendencia hacia la producción y el uso del quitosano y la
quitina en Latinoamérica. La revisión realizada permite vislumbrar una gran
potencialidad para la producción y aplicación de estos biomateriales en el área
agrícola en la región latinoamericana.
Palabras claves: Agroquímicos naturales, biocidas, estimulación de
crecimiento, inductor, protección de plantas
Abstract
Chitin and chitosan main properties (i.e. bactericide, fungicide,
antiviral, growth stimulation, elicitor capability) and their potential
agricultural applications are discussed. Some of the more common uses (fruit,
seed and food coating, plantlet protection, fruit juice clarification, matrix
for agrochemical release, biocide) for these materials are presented, including
those which have already been legally approved in several countries and
commercially exploited. A brief review on the production and commercialization
of products based on chitin and chitosan in the Latin American region is
presented. This review points that the biomaterials covered are of great
importance for the Latin American industry.
Key words: Natural agrochemicals, biocide, growth
stimulation, elicitor, plant protection.
Introducción
En general, la
búsqueda de materiales menos agresivos con el ambiente es una tarea continua en
todas las áreas del quehacer humano debido a los altos niveles de contaminación
presentes en todo el planeta. En la agricultura este trabajo es doblemente
complicado porque, por un lado se deben producir materiales que logren su
efecto específico en la planta o en sus productos, mientras que por el otro, se
necesita que éstos se eliminen sin efectos perturbadores en el medio ambiente.
Adicionalmente, en los sistemas agrícolas es necesario garantizar que los
diversos agroquímicos utilizados como biocidas, estimuladores de crecimiento,
fertilizantes, etc., no produzcan efectos perjudiciales como la inducción de
resistencia en patógenos o su acumulación en los consumidores humanos. Se
estima que muchas de las enfermedades actuales se producen por las causas
anteriores.
El uso de
agroquímicos de origen natural podría ser una solución satisfactoria a la
problemática anterior. Son muchas las sustancias que desde mucho tiempo se usan
en este sentido. En el presente trabajo se aborda la revisión de algunas
aplicaciones de la quitina y el quitosano, dos biopolímeros de origen natural
que se han convertido rápidamente en una alternativa prometedora para la
agricultura.
Las propiedades
antimicrobianas de la quitina y el quitosano son conocidas por el hombre desde
la antigüedad. En un principio, no se conocía la relación entre dichas
propiedades y la composición química de estos materiales. Sí se conocían, no
obstante, sus propiedades curativas, las cuales fueron aprovechadas
ampliamente, como por ejemplo en la aceleración de la cicatrización de heridas.
En este sentido, se sabe que los primeros mexicanos usaban preparaciones
derivadas de hongos para acelerar la cicatrización de heridas y que los
coreanos primitivos utilizaban quitina, proveniente de la pluma de calamar,
para favorecer la curación de abrasiones corporales (Goodman, 1989).
El uso del quitosano
en actividades agrícolas es mucho más reciente pero, a pesar de ello, puede
considerarse hoy en día abundante y en aumento. El cuadro 1 muestra algunas de
las aplicaciones que se han ensayado para este biopolímero en actividades
relacionadas con la agricultura.
|
Cuadro 1. Algunas de las aplicaciones de la quitina y
el quitosano en actividades relacionadas con la agricultura. |
||||
|
Uso |
Bipolímero |
Propiedades
aprovechadas |
Referencias |
Cultivo |
|
Películas para
recubrimiento de frutos, hojas, semillas y vegetales frescos |
Quitosano |
Antimicrobiana |
Galed et al., (2004), Srinivasa et al., (2004), Ratanachinakorn et al., (2005) Hewajulige et al., (2007), Devlieghere et al., (2004) |
Cítricos, mango,
toronja, lechosa (papaya), fresa, tomate |
|
Clarificación de
jugos de fruta |
Quitosano |
Coagulante-Floculante |
Chatterjee et al.,
(2004), Boguslawski et al.,
(1990), Root y Johnson, (1978), Hongfei y Hesheng, (2003) |
Pera, toronja, limón, manzana |
|
Protección de plántulas |
Quitosano |
Fungicida |
Barka et al., (2004); Lafontaine y Benhamou,
(1996) |
Uva de vino, tomate |
|
Liberación
controlada de agroquímicos |
Quitina y quitosano |
Formación de hidrogeles,
labilidad de derivados |
Mc Cormick et al., (1982), Teixeira et al., (1990), Hirano, (1978), Palma et al., (2005) |
Arándano |
|
Estimulación del
crecimiento |
Quitosano |
Bioestimulante |
Nge et al., (2006) |
Orquídea |
|
Inhibidor del oscurecimiento
de frutos y tubérculos |
Quitosano |
Biocida |
Waliszewski et al.,
(2002) |
Banana, papa |
|
Biocidas |
Quitosano |
Antimicrobiana |
Liu et al., (2007), Hadwiger y McBride,
(2006), Bautista-Baños et al.,
(2006) |
Tomate, papa, hortalizas |
|
Corrección de
sustratos de crecimiento |
Quitina y quitosano |
Fungicida, nematicida |
Sneh y Henis,
(1972), Abd-El-Kareem, (2002), Abd-El-Kareem et al., (2002), Abd-El-Kareem et
al., (2004), Abd-El-Kareem et al.,
(2006) |
Lupino blanco
(altramuz), guisante, tomate, papa, apio |
|
Inductor de
mecanismos de defensa |
Oligómeros de
quitina y quitosano |
Inductor de
resistencia |
Khan et al., (2003) |
Soya |
La diversidad de uso de estos materiales en diferentes áreas del quehacer
humano, en muchas partes del mundo, y el poco conocimiento que de éstos se
tiene en el sector agrícola de nuestra región ha motivado la realización de
esta revisión bibliográfica, buscando darle mayor difusión a este conocimiento
acumulado. Igualmente, el trabajo realizado pretende servir de puente entre las
investigaciones previas relacionadas con algunas aplicaciones del quitosano
desarrolladas por el autor (Lárez, 2002; Lárez, 2006, Lárez et al., 2007) y el sector agroproductor
de la región andina de Venezuela, la cual es productora de rubros agrícolas que
en nuestro país se obtienen casi exclusivamente en dicha zona, como el caso de
la papa, la mora, el apio, etc. Es importante señalar que este sector, especialmente
el asentado en la denominada zona alta, ha enfrentado desde hace mucho tiempo
graves problemas medioambientales, muchos de los cuales están relacionados con
el uso indiscriminado de biocidas y agroquímicos sintéticos, su consecuente
acumulación en suelos y la contaminación del agua (Gutiérrez, 1998), con lo
cual un trabajo motivador del uso de quitina y/o quitosano para estos fines
parece una acción importante.
1.- PROPIEDADES DEL QUITOSANO ÚTILES EN
AGRICULTURA
1.1.- Actividad bactericida
La carga positiva que
se desarrolla en el quitosano en medio ácido (pH < 5,5; Figura 1), debido a
la protonación del grupo amino presente en cada una de sus unidades
glucosamina, lo hace soluble en medio acuoso, diferenciándolo de su polímero
matriz la quitina y, según muchos autores, confiriéndole también mayor
actividad biocida (Papineau et al., 1991; Helander et al., 2001; Devlieghere et al., 2004).
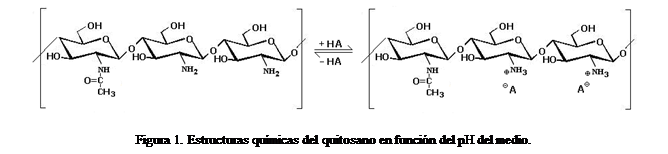
Los mecanismos de
acción por los cuales el quitosano (con distintos grados de acetilación), y por
extensión sus derivados, ejercen dicha actividad no han sido dilucidados
completamente; sin embargo, hay algunos mecanismos propuestos para explicar
acciones específicas, como por ejemplo:
·
La interacción electrostática entre el
quitosano cargado positivamente (polielectrolito catiónico) y algunas bacterias
con membranas celulares cargadas negativamente (Gram negativas como
·
La interacción electrostática entre los
grupos NH3+ del policatión y los grupos fosforilos
(Fernández et al., 2003) de los
fosfolípidos presentes en la membrana celular de bacterias Gram negativas causa
daños en ésta, provocando la salida de material intracelular (Liu et al., 2004). En este sentido se han
realizado estudios espectroscópicos de la salida de dicho material, el cual
absorbe en la región ultravioleta (270 nm). Más recientemente Chung y Chen (2008) han
determinado que la salida del material intracelular bacteriano se ve favorecida
por grados de acetilación más altos, tanto en bacterias Gram
negativas (E. coli) como en Gram
positivas (Staphylococcus aureus).
·
Para algunas bacterias Gram positivas (como S. aureus
y Bacillus cereus) que carecen de cargas negativas en la membrana celular, el
quitosano ha mostrado actividad incluso mayor, en algunos casos, que para
bacterias Gram negativas. En el caso de S.
aureus recientemente se ha planteado
la posibilidad de que la membrana celular de estos microorganismos tenga poros
lo suficientemente grandes como para que el quitosano logre entrar al interior
de las células (Li et al., 2007) y
alterar funciones vitales de éstas. Su interacción con el ADN, por ejemplo,
podría inhibir la replicación del ARNm y la síntesis de proteínas (Hadwiger et al., 1985; Sudarshan et al., 1992) y su efecto quelante podría
disminuir la concentración de algunos metales necesarios en procesos
enzimáticos (Cuero et al., 1991). Sin
embargo, otros autores creen que la longitud de persistencia del quitosano
cargado positivamente es demasiado grande para poder pasar al interior de las
células (Chung et al., 2003).
·
La interacción selectiva del quitosano con
trazas de metales pudiera inhibir la producción de toxinas y el crecimiento
microbiano (Sudarshan et al., 1992).
En este sentido se conoce bien que el quitosano puede ejercer una acción
quelante bien específica (Varma et al., 2004).
Como puede inferirse
de los mecanismos propuestos, la actividad antimicrobiana del quitosano
dependerá en gran manera de aquellos factores que ayuden a acentuar las cargas
positivas en la cadena del biopolímero. Entre estos factores cabe destacar el
grado de desacetilación, la distribución de los grupos desacetilados a lo largo
de la cadena, la longitud de la cadena, la distribución de los pesos
moleculares (Terbojevich et al.,
1991), el pH, la fuerza iónica del medio, el contraión asociado en su forma sal
y la temperatura.
En ese sentido, la
dependencia de la carga con respecto al grado de desacetilación es lineal
debido a que los quitosanos más desacetilados (de una misma longitud de cadena)
tendrán mayor número de grupos aminos libres para ionizar, lo cual dependerá
obviamente del pH del medio (Rinaudo et
al., 1993); asimismo, un peso molecular mayor implicará una molécula con
más grupos cargados (para un mismo grado de desacetilación y al mismo pH) y una
mayor interacción electrostática con grupos cargados negativamente.
Por su parte, el
contraión asociado al quitosano en su forma salina puede apantallar en una
extensión variable las cargas positivas de éste, entre otras razones por
efectos estéricos (Lárez et al.,
2008). Un estudio sobre la actividad del quitosano disuelto en distintos ácidos
sobre E. coli confirmó que los ácidos
orgánicos de menor tamaño produjeron soluciones con mejores propiedades
bactericidas. El ácido fórmico es más eficaz que el ácido acético, cuyas
soluciones a su vez mostraron mayor actividad que las preparadas con ácido
propanoico (Chung et al., 2003). El
apantallamiento de las cargas en la cadena también puede surgir de la presencia
de iones externos (algunas veces añadidos al medio para controlar la fuerza
iónica), lo que modifica la magnitud de las interacciones entre éstas (Rinaudo et al., 1993); sin embargo, debe
considerarse también que las moléculas de quitosano tienen una mayor
solubilidad a valores de fuerza iónica mayores, con lo cual pueden compensar la
mayor flexibilidad que adquieren en estas condiciones. La mayor actividad
bactericida observada contra E. coli
y S. aureus para valores de fuerza
iónica más altos así parece demostrarlo (Chung y Chen, 2008).
La explicación
anterior también podría ser válida para justificar la mayor actividad
bactericida que se ha observado con soluciones de quitosano cuando se
incrementa la temperatura (Tsai y Su, 1999), en contra de lo que debería
esperarse si se considera que al aumentar la temperatura las cadenas se hacen
más flexibles y compactas (Launay et al.,
1986) y/o disminuyen su volumen específico porque se desfavorecen los puentes
de hidrógeno con el agua (Noguchi, 1981).
1.2.- Actividad fungicida
La actividad
fungicida del quitosano se ha estudiado, tanto in vitro (El Ghaouth et al., 1992a)
como in vivo (Li y Yu, 2001; Yu et al., 2007). El quitosano inhibe
multitud de especies de hongos, exceptuando, o siendo menos efectivo con
aquellas que lo poseen en sus paredes celulares (Roller y Covill, 1999; Allan y
Hardwiger, 1979), como cabría esperar. Los hongos que poseen quitosano como
componente de sus paredes celulares deberían ser menos sensibles a la
aplicación de dosis razonables de éste por dos razones: (a) la presencia
natural de quitosano en las paredes celulares no genera efectos adversos para
el microorganismo y (b) las interacciones electrostáticas del quitosano añadido
(exógeno), cargado positivamente, deberían verse menos favorecidas con paredes
celulares que poseen quitosano endógeno que cuando éstas poseen material con
cargas negativas. Estos estudios han dejado claros los principales requerimientos
que deben satisfacerse para lograr una mayor efectividad fungicida del
biopolímero. Los más importantes son:
·
Existe una alta correlación entre la
concentración de quitosano aplicada y la inhibición fúngica; por ello, para una
buena efectividad se deberá encontrar la dosis adecuada en cada situación.
·
Existen evidencias de que la sensibilidad de
los hongos patógenos hacia el quitosano puede cambiar en los diferentes
estadios de su desarrollo. Por ejemplo, en el trabajo de Liu et al. (2007), se reporta que el
quitosano es mejor inhibidor de la germinación de Penicillium expansum que la de Botrytis
cinerea, contrariamente a lo que se observó en el crecimiento micelial de
estas especies. De manera similar, un estudio reciente ha mostrado que el quitosano
es más efectivo sobre los conidios que sobre las hifas de algunos hongos
fitopatógenos (Palma-Guerrero et al.,
2008). En general, estos resultados son similares a los reportados para otros
agentes fungicidas, como por ejemplo el caso reportado por Everett et al. (2005), quienes encontraron que
la germinación de esporas de Botryosphaeria parva fue menor con la
aplicación del agente fluazinam que la de Colletotridum
gloeosporioiodes, pero ocurrió lo contrario para la inhibición del
crecimiento micelial.
·
También se ha encontrado una relación directa
entre la actividad fungicida y el peso molecular del quitosano (Hirano y
Nagano, 1989; Bautista-Baños et al.,
2005).
De igual modo, la
actividad fungicida del quitosano se ha asociado desde hace mucho a su carácter
catiónico. La interacción de los grupos amino libres, cargados positivamente en
medio ácido, con los residuos negativos de las macromoléculas expuestas en la
pared de los hongos, cambian la permeabilidad de la membrana plasmática, con la
consecuente alteración de sus principales funciones (Benhamou, 1992).
Otras posibles
explicaciones de la actividad fungicida del quitosano se relacionan con la
inhibición de la síntesis de algunas enzimas presentes en los hongos (El-Ghaouth
et al., 1992a) o la ocurrencia de
alteraciones citológicas, como se ha reportado en el caso de B. cinerea,
donde se ha observado al microscopio la aparición de vesículas y/o células
vacías carentes de citoplasma, después del tratamiento con soluciones acuosas
al 1,75% de quitosano (Barka et al., 2004).
El cuadro 2 muestra
algunos de los patógenos para los que se ha determinado in vitro la capacidad inhibitoria del quitosano.
|
Cuadro 2. Algunos fitopatógenos
en los cuales se ha estudiado la actividad biocida del quitosano. |
||
|
Patógeno |
Resultados de los
estudio realizados |
Referencias |
|
Botyitis cinerea |
Se encontró que el quitosano
(50 ppm) controla la enfermedad conocida como “moho gris” en pepino. |
Ben-Shalom et al., (2003) |
|
Colletotrichum gloeosporioides |
Se encontró que los
tratamientos in vitro con quitosano
(2 y 3%) tienen efectos fungicida. |
Bautista-Baños et
al., (2003) |
|
Fusarium solani |
Se demostró que el
heptámero no acetilado del quitosano tiene una alta actividad fungicida. |
Kendra y Hadwiger,
(1984) |
|
Phytophthora
capsici |
Se demostró que los
oligo-quitosanos pueden penetrar la membrana del patógeno y unirse al ADN y/o
ARN |
Xu et al., (2007) |
|
Pythium debaryanum |
El tratamiento con
quitosano favorece la germinación y crecimiento de semillas de lechuga en
medios infectados |
Kurzawińska,
(2007) |
1.3.- Actividad antiviral
Se han publicado
algunos trabajos sobre la inhibición que provocan las soluciones de quitosano
en enfermedades de plantas provocadas por virus y viroides (Chirkov, 2002; Pospieszny et al., 1989; Pospieszny et al., 1991; Pospieszny 1997).
Así, por ejemplo, Pospieszny et al (1989) encontraron que una solución acuosa 0,1% de quitosano
(rociada o adicionada al inóculo) logra controlar completamente la infección
local causada por el virus del mosaico de la alfalfa (VMA) en hojas de
frijoles. Se obtuvieron resultados similares para otros virus como el virus de
la necrosis del tabaco, virus del mosaico del tabaco (VMT), virus del no
crecimiento del maní, virus del mosaico del pepino y el virus X de la papa (Pospieszny et al., 1991).
Por otra parte, se ha
reportado la inhibición de la enfermedad causada por inoculación de hojas de
tomate con un viroide que afecta la papa (potato spindle tuber viroid), cuando
éstas fueron tratadas con soluciones de quitosano (Pospieszny 1997).
Las principales
observaciones de estos estudios han sido:
·
La eficacia del quitosano en la inhibición de
infecciones virales depende de la combinación virus/hospedante, la
concentración de quitosano aplicado y la forma de aplicación.
·
La mayor protección ocurrió en las partes
tratadas con quitosano (hojas) pero el efecto protector también pudo apreciarse
en otras partes no tratadas de las plantas que recibieron el tratamiento
(efecto sistémico).
·
El quitosano añadido a los protoplastos del
tabaco bloquea completamente la acumulación del VMT aún después de 6-8 horas de
aplicado.
·
El tratamiento previo con quitosano reduce
significativamente la infección viral en varias especies vegetales.
1.4.- Estimulación del crecimiento
En términos
generales, la aplicación de quitosano ha mostrado efectos positivos en el
crecimiento de las plantas, tanto en la estimulación de la germinación de
semillas como en el crecimiento de partes de la planta como raíces, retoños y
hojas. En algunos casos, se ha observado que la estimulación de la germinación
de semillas por tratamiento con quitosano ha logrado elevar el porcentaje de
germinación a los niveles requeridos para la certificación (Bhaskara et al., 1999).
Los efectos
beneficiosos del quitosano se han observado en plantas florales (Wanichpongpan et al., 2001) y en plantas de cosecha
(Chibu y Shibayama, 2001). Así, por ejemplo, cuando se aplicaron soluciones muy
diluidas de quitosano en las raíces de orquídeas, en forma de aerosol, éstas
mostraron una estimulación en su crecimiento y renovaron su producción de
flores (Chandrkrachang, 2002), entre otros efectos favorables. Un estudio más
reciente, relacionado con el crecimiento de tejidos vegetales, ha mostrado que
el origen del quitosano es un aspecto importante. Los quitosanos procedentes de
hongos necesitaron de dosis menores para la inducción de la diferenciación de
tejidos de plantas de orquídeas que los oligómeros procedentes de caparazones
de camarones (Nge
et al., 2006), lo
cual no es del todo extraño. A este respecto se sabe que uno de los aspectos
fundamentales en las propiedades fisicoquímicas del quitosano es su fuente de
extracción. Así por ejemplo, la quitina obtenida de camarones y cangrejos tiene
una estructura cristalográfica a, en la cual las cadenas principales están ordenadas en
agregados antiparalelos que les permite formar puentes de hidrógenos
intermoleculares muy fuertes, mientras que la procedente de las plumas de
calamar tiene una estructura b, con las cadenas ordenadas en arreglos paralelos y
fuerzas intermoleculares más débiles (Tolaimate et al., 2000).
En el cuadro 3 se
pueden observar algunos resultados interesantes, que confirman el efecto
beneficioso del quitosano en algunas variables relacionadas con el crecimiento
en plantas de mijo perla, cuyas semillas fueron tratadas previamente con Elexa,
un agroquímico que contiene quitosano como ingrediente activo.
|
Cuadro 3. Mejoría porcentual de algunas variables de
crecimiento del mijo perla cuando sus semillas se tratan previamente con
Elexa con relación a las semillas no tratadas (Sharathchandra et al., 2004). |
||||||
|
Variable |
Altura de la planta |
Número de retoños |
Número de mazorcas |
Longitud de las
mazorcas |
Contorno de
Semillas |
Peso de 1000
semillas |
|
% de mejoría |
42 |
83 |
50 |
8 |
20 |
19 |
1.5. Inducción de resistencia
Desde hace tiempo se
ha comprobado que el quitosano induce reacciones de defensa en algunas plantas
(Pearce y Ride, 1982), sensibilizándolas
para responder más rápidamente al ataque de patógenos. Entre las sustancias
cuya inducción se ve favorecida por la presencia de quitina y/o quitosano, así
como también muchos de sus derivados, se incluyen:
·
Fitoalexinas: pisantina, risitina, orchinol,
genistein, etc.
·
Proteínas relacionadas a la patogénesis.
·
Inhibidores proteicos
·
Ligninas.
En el caso del
quitosano se ha propuesto que esta sensibilización ocurre porque su presencia
estimula mecanismos de defensa ya conocidos (Barka et al., 2004), como por ejemplo la producción de quitinasas y
glucanasas (Benhamou, 1996); la lignificación en hojas dañadas (Pearce y Ride, 1982) o intactas (Moerschbacher et al., 1986); la generación de peróxido de hidrógeno (Lee et al., 1999) o la formación de fitoalexinas en legumbres y plantas
solanáceas (Cote y Hahn, 1994). Los compuestos que provocan este tipo de
respuestas se conocen como inductores.
Un factor importante
a considerar en el uso de quitosano como un inductor es, además del peso
molecular, su grado de acetilación. Los quitosanos completamente desacetilados
no inducen respuestas defensivas en la mayoría de los sistemas donde han sido
ensayados; los resultados con materiales parcialmente acetilados son muchas
veces dependientes del sistema estudiado, pero en general éstos actúan como
excelentes inductores, lo que ha llevado a pensar en mecanismos de inducción
diferentes (Lee et al., 1999). Por esa razón, se ha
pensado que la actividad del quitosano como inductor reside en sus regiones
acetiladas.
La actividad
inductora del quitosano altamente desacetilado y la no actividad de los
oligómeros completamente desacetilados ha sido explicada por un mecanismo
independiente de receptores específicos (Kauss et al., 1989),
considerando que puede ocurrir una interacción entre las cargas positivas del
policatión con fosfolípidos negativamente cargados de la membrana plasmática en
las plantas, afectándose la integridad de esta última. Sobre la base de estas
consideraciones, se debería esperar un aumento en la actividad inductora del
quitosano cuando su grado de acetilación disminuye, es decir, cuando sus grupos
cargados aumentan; sin embargo, es preciso también recordar que su actividad
desaparece cuando el material está completamente desacetilado.
En el cuadro 4 se
muestran algunos de los sistemas donde se ha estudiado la capacidad inductora
del quitosano. Es importante resaltar que en algunos casos la capacidad
inductora del quitosano no sólo puede ser aprovechada para proteger la planta
sino que se puede utilizar para incrementar el rendimiento de alguna sustancia
comercialmente importante, como algunos metabolitos secundarios en los casos
del aceite esencial d-limoneno en algunos cítricos y el mentol en la menta
(Lockwood et al., 2007; Chang et al., 1998).
|
Cuadro 4. Efecto inductor del quitosano sobre la
producción de metabolitos secundarios y la defensa de la planta. |
||||
|
Vegetal |
Patógenos |
Tratamiento |
Resultados |
Referencias |
|
Lupino (altramuz)
amarillo |
|
Las raíces de las plantas
fueron tratadas con solución acuosa 0,1% p/v de quitosano por 24 horas |
Se observó un
notorio aumento en la síntesis de genistein (una fitoalexina). |
Kneer et al., (1999) |
|
Naranja dorada
(Kumquat) |
|
Plantas crecidas en
un medio de cultivo conteniendo quitosano (200 mg/L) |
Se observó un
aumento de la producción de d-limoneno de 17 veces su contenido natural. |
Lockwood et al., (2007) |
|
Menta |
|
Células de Mentha piperita cultivadas en
soluciones acuosas que contienen 200 mg/L de quitosano |
Aumento de la
producción de mentol |
Chang et al., (1998) |
|
Maní |
Puccinia arachidis |
Hojas tratadas con
solución acuosa de 1000 ppm de quitosano |
Se observó un
aumento en los niveles de ácido salicílico endógeno y una mayor actividad para
quitinasa intercelular y glucosanasa. |
Sathiyabama y Balasubramania, (1998) |
|
Pepino |
Pythium aphanidermatum |
Plantas crecidas en
soluciones acuosas con distintas concentraciones de quitosano |
Se observó formación
de barreras físicas en las raíces y estimulación de hidrolasas en raíces y
hojas. |
El-Ghaouth et al., (1994) |
|
Soya |
F. solani f. sp. glycines |
Hojas rociadas con
soluciones acuosas de quitosano (0,1-0,5 mg/ml) 24h antes de inocular el
patógeno |
Inducción de un
incremento en la actividad de las quitinasas y retardo del síndrome de muerte
súbita |
Prapagdee et
al., (2007) |
|
Tomate |
Fusarium oxysporum f. sp. radicis-lycopersici |
Recubrimiento de semillas
con soluciones acuosas de quitosano junto con enmienda del me-dio de
crecimiento también con quitosano |
El pretratamiento
estuvo siempre asociado con la expresión de reacciones de defensa de las
plantas. |
Benhamou et al., (1994) |
2.-ALGUNOS USOS ESPECÍFICOS DE LA QUITINA Y
EL QUITOSANO EN ÁREAS RELACIONADAS CON LA AGRICULTURA
2.1.- Protección de frutos y vegetales
frescos con recubrimientos de quitosano
El uso de quitosano
para el recubrimiento de frutas y vegetales se ha propuesto y ensayado desde
hace más de 15 años (El Ghaouth et al.,
1991) debido a sus propiedades bactericidas y fungicidas, su capacidad para
formar películas y su baja toxicidad en seres humanos, la cual había sido
estudiada en la década de los sesenta del siglo pasado (Arai et al., 1968). En principio, la
capacidad del quitosano para formar películas favorece la preservación de los
productos debido a la modificación de la atmósfera interna y a la disminución
de las pérdidas por transpiración.
En la mayoría de los
sistemas estudiados se observó un efecto positivo en la conservación de los
productos después de su recubrimiento con quitosano. Así por ejemplo,
Devlieghere et al. (2004) observaron
que el recubrimiento de fresas con soluciones de quitosano tiene efectos
benéficos notables a partir del cuarto día, en la preservación del fruto. Las
principales observaciones en estos sistemas han sido las siguientes:
·
Disminución en las pérdidas por
transpiración. La respiración disminuye lentamente, aunque inicialmente se
observa un incremento de la misma que se atribuye al estrés ocasionado por la
solución acuosa de ácido láctico/lactato de sodio usada para disolver el
quitosano.
·
Se conserva una mejor textura con el tiempo;
en los casos donde se realizaron mediciones cuantitativas se estableció una
mayor firmeza en los frutos tratados con quitosano que en aquellos no tratados.
·
Aparte de un ligero sabor amargo inicial
durante el primer día, que desaparece rápidamente y que no se aprecia en días
posteriores, la presencia de quitosano no causó diferencias organolépticas
apreciables entre los frutos tratados y los frutos no tratados con quitosano.
·
La carga microbiológica a lo largo del tiempo
permaneció siempre más baja en los sistemas tratados con quitosano.
En este mismo trabajo
se reportaron resultados similares para una mezcla de legumbres frescas
(lechuga, endibia, rábano, etc.) tratadas con una solución de quitosano al pH
natural de éstas. Sin embargo, en este caso se observaron dos situaciones
iniciales adversas:
·
El sabor amargo inicial de las muestras
tratadas con quitosano permanece durante un tiempo mayor, aunque éste va
desapareciendo en el tiempo. Se atribuyó este sabor amargo al pH inicial más
alto de la solución de quitosano (alrededor de 5) ya que las soluciones de
quitosano con pH < 5,5 tienen un sabor astringente que se hace menos
pronunciado a medida que el pH aumenta (Rodríguez et al., 2003)
·
Una apariencia limosa inicial de las
legumbres, que va tornándose con el tiempo similar a la de las muestras
control.
La carga
microbiológica en la mezcla de lechugas comienza a aumentar a partir del cuarto
día; los autores asumen que la actividad bactericida de la solución de
quitosano usada en estos ensayos es menor debido a que el pH alto (~5) lo hace tener una menor fracción de cargas positivas.
Los aspectos que
deben ser considerados en la preservación de frutos y vegetales mediante el uso
de recubrimientos de quitosano son:
a)
El tipo de quitosano a emplear (grado de
acetilación, peso molecular, procedencia).
b)
Ácido usado para preparar las soluciones
acuosas.
c)
pH del medio, cuidando de respetar el pH
natural del producto a proteger.
d)
Temperatura
de almacenamiento.
e)
La presencia de otros componentes en el
producto a proteger, como por ejemplo azúcares, sales, proteínas, etc.
Se puede observar un
resumen de algunos sistemas estudiados mediante protección con recubrimientos
de quitosano en el cuadro 5.
|
Cuadro 5. Algunos
frutos estudiados con recubrimientos de quitosano. |
|||
|
Producto |
Forma de aplicación |
Objetivo del
recubrimiento con quitosano |
Referencias |
|
Fresa |
Frutas rociadas con
soluciones acuosas 1-2% p/v de quitosano |
Inducción de mecanismos
de defensa (incremento de la actividad para quitinasa y b-1,3-quitosanasa). |
Zhang y
Quantick, (1998) |
|
Guayaba |
Recubrimiento de
las rodajas con películas formadas a partir de soluciones acuosas de
quitosano. |
Conservación de propiedades
en rodajas del fruto |
Thommohaway et al., (2007) |
|
Lechosa (papaya) |
Frutas cubiertas
con películas de quitosanos formadas a partir de soluciones acuosas 1% |
Recubrimiento de frutos
para protección de la antracnosis. Se observó inhibición en el crecimiento
micelial y en la germinación de esporas. |
Hewajulige et al., (2006) |
|
Mandarina |
Fruta introducida
en solución acuosa de quitosano y dejada secar |
Control del crecimiento
de hongos. Penicillium digitatum y Penicillium italicum. |
Chien et al., (2007a) |
|
Mango |
Cajas del fruto
protegidas con películas de quitosano. |
Conservación de las
propiedades del fruto entero por mayor tiempo. |
Srinivasa et al., (2004) |
|
Mango |
Recubrimiento de
las rodajas con películas de quitosano (obtenidas dejando secar al aire
soluciones acuosas de quitosano en ácido acético 5%) |
Conservación de las
propiedades de rodajas del fruto por mayor tiempo. |
Chien et al., (2007b) |
|
Manzana |
Trozos de fruta
recubiertos con películas formadas a partir de soluciones acuosas 1 % de
quitosano |
Retardo del
oscurecimiento en fruto cortado |
Worakeeratikul et al., (2007) |
|
Melocotón |
Películas de quitosano
obtenidas a partir de soluciones acuosas |
Alargamiento del
tiempo de almacenamiento |
Du et al., (1997). |
|
Tomate |
Películas de
quitosano obtenidas a partir de soluciones acuosas |
Alargamiento del
tiempo de almacenamiento |
El-Ghaouth et al., (1992c). |
2.2.- Protección de plántulas
Una de las mayores
necesidades agrícolas es la protección de las plántulas contra enfermedades
causadas por patógenos. En este sentido, un estudio reciente relacionado con la
protección de plantitas de uva (Barka et
al., 2004) mostró que el quitosano no sólo es efectivo para inhibir el
crecimiento de B. cinerea en las
plantitas expuestas a este microorganismo sino que además parece activar
mecanismos de defensa. Igualmente, el tratamiento con el biopolímero estimuló
el crecimiento de las plantitas. Otros estudios realizados con plántulas de
tomate han mostrado resultados similares en la inducción de resistencia hacia Fusarium oxysporum (Benhamou et al., 1998).
Se
considera que el quitosano puede inducir la acumulación masiva de sustancias
fungitóxicas en los lugares de aplicación y/o constituirse en una barrera que
impida el flujo de nutrimentos hacia el patógeno; esta última consideración se
soporta en señales de deterioro que a menudo muestran las células fúngicas
expuestas a quitosano, como por ejemplo la formación anormal de depósitos
enriquecidos en quitina entre la membrana plasmática y la pared celular
(Benhamou et al., 1998; El-Ghaouth et al., 2000).
2.3.- Clarificación de jugos de frutas
El carácter
coagulante/floculante del quitosano se ha aprovechado desde hace más de 30 años
en algunas aplicaciones relacionadas con el tratamiento de aguas provenientes
de diversas fuentes (Bough, 1975; Roussy et
al., 2005) así como en la recuperación de sólidos suspendidos en aguas
residuales que pueden ser aún aprovechables (Bough y Landes, 1978). Sin
embargo, la utilidad de dichas aplicaciones
ha estado limitada por la solubilidad del biopolímero a valores de pH > 6,5.
En ese sentido, una estrategia común ha sido la modificación química del
quitosano para generar materiales solubles en un intervalo de pH más amplio,
incluyendo valores de pH alcalinos, que pueda permitir el tratamiento de aguas
de diversa procedencia. Así, por ejemplo, la metilación exhaustiva del grupo
amino del biopolímero produce un material soluble en agua que tiene mejores
propiedades coagulantes/floculantes que el quitosano de partida (Lárez et al., 2003).
Por otra parte, en
varios países se ha aprobado el uso del quitosano para ser utilizado como
aditivo en la clarificación de jugos de frutas (Baxter et al., 2005;
Oszmiański y Wojdyło, 2007), aunque éste presenta los mismos
inconvenientes de insolubilidad en medios neutros o alcalinos, por lo que se
han ensayado quitosanos modificados para solventar dicha insolubilidad. Una de
las vías rápidas que se ha encontrado para solubilizar el quitosano es la
disminución de su grado de polimerización mediante hidrólisis con ácido acético
a
2.4.- Matriz para la liberación controlada de
agroquímicos
Los agroquímicos son
sustancias usadas para mejorar la producción en las cosechas; sin embargo, su
aplicación convencional puede llegar a resultar en la contaminación de suelos y
aguas. Por ello, se hace necesario
disminuir las cantidades usadas de ingredientes activos sin reducir la
eficiencia de los tratamientos. El reemplazo de formulaciones agroquímicas
tradicionales por sistemas de liberación controlada no solo ayuda a evitar el
empleo de cantidades excesivas de sustancias activas sino que a menudo ofrece
soluciones técnicas adecuadas en áreas especiales, como por ejemplo: el control
del arroz silvestre (Zizania aquatica),
el manejo de enfermedades en campos deportivos, etc. Los objetivos
fundamentales que se pretenden alcanzar mediante el uso de formulaciones para
la liberación controlada son:
·
Protección de los agentes suministrados.
·
Permitir la liberación automática del
agroquímico únicamente en el lugar seleccionado, a una velocidad adecuada.
·
Mantener su concentración en el sistema
dentro de los límites óptimos durante un periodo de tiempo especificado,
otorgando especificidad y persistencia
En este sentido, la
liberación sostenida en el tiempo de agroquímicos, de diversa índole, es una de
las metas a lograr en la agricultura debido a que ésta puede permitir tomar el
control de varios problemas, entre los cuales se pueden mencionar:
·
Los efectos de los agroquímicos liberados se
prolongan con lo cual se obtienen ahorros económicos sustanciales debido a que
se puede ejercer un mejor control de las cantidades usadas.
·
La liberación desde la matriz ocurre cuando
la planta lo necesita, generalmente en dosis menores a las que se obtienen
cuando el agroquímico se aplica solo.
·
Reducción del número de aplicaciones,
disminuyendo el contacto del personal con los agroquímicos y las horas
dedicadas a este trabajo, así como también el estrés en las plantas.
·
Disminución del riesgo en la toxicidad hacia
humanos y animales debido a que la aplicación se realiza en la vecindad de cada
planta y en dosis controladas.
·
Uso de las cantidades necesarias del
agroquímico, lo que obviamente conlleva a menores costos económicos.
·
Un trato más amigable del medioambiente
debido a la liberación de las cantidades necesarias para las plantas.
Igualmente, la degradación del biomaterial usado como soporte no afecta la
calidad del suelo.
Una de las primeras
propuestas para el uso de derivados de quitosano, en forma de membrana
protectora, para la liberación controlada de agroquímicos fue realizado por
Hirano (1978). Así mismo, la quitina se utilizó como matriz para la liberación
de un agroquímico en los inicios de los años ochenta, cuando se reportó la
unión química del herbicida metribuzin a este biopolímero y su subsiguiente
liberación (McCormik et al., 1982).
Posteriormente, se publicaron estudios para la liberación controlada de urea y
atrazina, un herbicida de uso común para controlar la cizaña (Lolium
temulentum) en campos de maíz, usando películas y perlas fabricadas con
hidrogeles de quitosano y derivados de este biopolímero (Teixeira et al., 1990). Los ensayos mostraron que
las matrices usadas eran efectivas para controlar la liberación de los
agroquímicos estudiados y extender su tiempo de liberación hasta periodos 180
veces mayores que cuando éstos se aplican solos. En el cuadro 6 se muestran
algunos de los sistemas basados en quitina y/o quitosano utilizados para la
liberación controlada de agroquímicos.
|
Cuadro 6. Algunos sistemas basados en quitina y/o quitosano estudiados en
la liberación controlada de agroquímicos. |
||
|
Matriz |
Agroquímico
estudiado |
Referencias |
|
Quitina
químicamente sustituida con el agroquímico. |
Metribuzin
(herbicida) |
McCormick et al., (1982) |
|
Películas y perlas
de quitosano cargadas con los agroquímicos |
Urea (fertilizante); atrazina (herbicida) |
Texeira et al., (1990) |
|
Quitosano
químicamente sustituido con etil-fosfonato (Ethephon) |
Etileno (regulador del crecimiento). |
Palma et al., (2005) |
|
Microcápsulas de
quitosano preparadas por una reacción interfacial |
3-hydroxy-5-methylisoxazole
(herbicida) |
Yeom et al., (2002) |
2.5.- Biocidas basados en quitina y quitosano
El uso de la quitina
para el control de nemátodos del suelo se conoce desde hace tiempo (Mankau y
Das, 1969) y en la actualidad existen en el mercado algunos productos que
pueden ser usados con este fin tales como Clandosan, Biolizer NC, Eco-Poly 2,
etc. El mecanismo de acción de la quitina está basado en el hecho de que su
presencia en el suelo estimula la proliferación de bacterias y actinomicetos
que se alimentan de ella, como por ejemplo los hongos nematófagos; estos
microorganismos, una vez consumida la quitina agregada pasan a consumir quitina
de otras fuentes, como nematodos y sus huevos (Rodríguez-Kabana et al., 1987). Por otra parte, es
necesario considerar la dosificación de quitina en suelos debido a que su
descomposición puede tener efectos fitotóxicos, originados por el amonio que se
libera durante su descomposición (Culbreath et
al., 1985). La dosis típica recomendada por varios autores está entre 3-4
toneladas por acre (Spiegel et al.,
1986; Spiegel et al., 1987), lo que
la hace costosa para muchos cultivos.
Por otra parte, el
principal uso como biocida que se le ha dado al quitosano ha sido como
fungicida en la protección de semillas. Esta propiedad, junto con la
estimulación del crecimiento, ha hecho al quitosano realmente atractivo para su
uso en la agricultura. Sin embargo, han aparecido otras aplicaciones que
implican su uso como biocida y, en ese sentido, para el año 2001 el quitosano
aparece registrado en el proyecto IR-4 como un bioplaguicida para uso en
cultivos de uvas y fresas, quedando pendiente la revisión para los mismos fines
en pepino, melón y pomelos (Baron, 2001). El proyecto IR-4 (The IR-4 project)
es una de las mayores fuentes de datos usados por los agricultores
norteamericanos para el manejo de plagas, el cual ha sido desarrollado por
Igualmente, han
aparecido en fecha reciente algunos trabajos que demuestran una mayor actividad
fungicida (Xu et al., 2007) e
insecticida (Zhang y Tan, 2003) de los oligómeros del quitosano, lo cual
pareciera estar fundamentado en la mayor facilidad que tienen estos oligómeros
para atravesar la membrana celular. Kendra y Hadwiger (1984) habían mostrado
que el heptámero de quitosano tenía la máxima actividad fungicida contra F. solani (y la mayor capacidad
inductora), incluyendo en la comparación oligómeros que contienen de
Es importante
resaltar que la concentración de quitosano en las formulaciones aplicadas puede
tener efectos importantes para cada tipo de fitopatógeno en particular. Así,
por ejemplo, en algunos casos la actividad biocida del quitosano puede verse
favorecida con un aumento de la concentración del quitosano (El-Ghaouth et al., 1992b) y en otros casos puede suceder lo contrario (Wojdyła et al., 1996). Esto, sin duda, hace pensar que el quitosano puede
actuar como biocida mediante diversos mecanismos bioquímicos (Szczeponek et al., 2006), lo que complica el entendimiento de sus mecanismos
de acción. Adicionalmente, es importante considerar que en muchos casos
estudiados es difícil separar su efecto inductor, el cual contribuye a la
autoprotección de la planta.
3.- TENDENCIAS EN EL USO DE QUITOSANO CON FINES
AGROQUÍMICOS EN LATINOAMÉRICA
Un estudio de mercado
realizado entre los años 2003-2005 por la empresa Global Industry Analyst
Incorporated (2007) estima que la producción mundial de quitosano crecerá fuertemente
entre los años 2001-2010, con un incremento anual cercano al 16 %; sin embargo,
la región latinoamericana no figura a nivel mundial entre los principales
productores de este biopolímero como se muestra en el cuadro 7.
|
Cuadro 7. Reparto porcentual de la producción mundial
de quitosano (Caprile, 2005). |
|
|
Región |
% Producción |
|
Estados Unidos |
30 |
|
Japón |
20 |
|
Asia Pacífico |
20 |
|
Europa |
15 |
|
Resto del mundo |
15 |
A pesar de ello, como
muy bien refieren Goycoolea et al.
(2004), Latinoamérica tendría la capacidad de generar hasta un 12% del material
quitinoso que se produce a nivel mundial con alrededor de unas 170.000
toneladas/año de desechos sólidos, lo que serviría para producir alrededor de
unas 25.000 toneladas/año de quitina, es decir unas 2,5 veces la demanda actual
de quitosano. En ese sentido, varios países de la región poseen empresas
productoras de quitina y quitosano, así como también producen y comercializan
derivados de estos materiales, muchos de los cuales están dirigidos al sector
agrícola (cuadro 8). Otros países han comenzado a realizar estudios con la
finalidad de construir plantas procesadoras de desechos pesqueros, en los
cuales algunos de los productos buscados son la quitina y el quitosano. En el
cuadro 9 se presentan algunos de los estudios que se desarrollan, o se han
desarrollado, encontrados en la revisión bibliográfica realizada durante este
estudio.
|
Cuadro 8.- Algunas empresas
productoras de quitina y/o quitosano en Latinoamérica. |
||
|
País |
Empresa o
institución |
Productos |
|
Brasil |
Polymar (www.polymar.com) |
a) Quitosano de alta y baja densidad.
Presentación de 1 y 25 kg. b) Fybersan varias presentaciones.
Nutracéutico |
|
Chile |
Quitoquímica
(www.quitoquimica.cl) Biotex, Bioagro
(www.biorend.cl) |
a)
Quito-Agro. Complejo quitosano/calcio +
potasio para uso como fertilizante foliar, bioestimulante y fungicida b)
Quito-Carbe. Carbamato de quitosano +
quitosano + potasio para uso como fungicida y acaricida. c)
Quito-Def. Dietil fosfato de quitosano +
quitosano + potasio para uso como nematicida. d)
Quito-Oef. Etilfosfonato de quitosano +
quitosano para uso como regulador de crecimiento y maduración. e)
Quitoesferas de quitosano para remoción de
metales pesados. f)
Complejos de quitosano con metales para uso
como micronutrimentos. Metales disponibles: cobre (solución y pintura),
hierro, zinc, manganeso a) Biorend:
quitosano en solución acuosa para uso como estimulante de crecimiento y
vigorizador del sistema radicular. b) Formulaciones
basadas en quitosano para el tratamiento de semillas (patentadas en Chile). c) Formulaciones
basadas en quitosano para incrementar la resistencia de las plantas
(patentadas en Chile y Estados Unidos). d) Formulaciones
basadas en quitosano para el tratamiento de enfermedades aéreas (patentadas
en Chile). e)
Formulaciones biológicas basadas en
quitosano para el control de plagas y enfermedades (patentadas en España,
Comunidad Económica Europea, Chile y otros países) |
|
Cuba |
Empresa Laboratorio
Farmacéutico "Mario Muñoz" Hacendados No. 1, Municipio Habana
Vieja, Ciudad de |
Quitina y quitosano. |
|
Chile y México |
Biopol
(www.tradeleads.at/companies/ view/111621/Biopol.html) |
Quitina y
quitosano. |
|
Cuadro 9. Algunos estudios, proyectos y/o patentes relacionados con la producción
y el uso de quitina y quitosano desarrollados en Latinoamérica. |
|
|
País o región |
Estudio, proyecto
y/o patente |
|
Argentina |
1.Creación de
una planta semi-industrial de obtención de quitina y quitosano para procesar
residuos de la industria pesquera de Bahía Blanca (provenientes de camarones
y cangrejos). Materia a procesar por año: 220 toneladas (Caprile, 2005). 2.Instalación de una
planta piloto en Comodoro Rivadavia para la recuperación de desechos pesqueros
y producción de quitina y quitosano (y derivados) (Strumia, 2004). |
|
Brasil |
Varias patentes para la producción y aplicaciones de quitina y
quitosano de la empresa Polymar (www.polymar.com.br) |
|
Chile |
La empresa Biotex SA tiene varias patentes para la producción de
quitina, quitosano y agroquímicos basados en estos materiales
(www.biorend.cl). Existen dos plantas productoras: 1) Biotex 1: produce quitina y quitosano 2) Biotex 2:
tiene una planta productora de quitosano combinado con nutrimentos y
organismos de control biológico (nematodos entomopatógenos como por ejemplo Trichoderma beauver). Los productos son comercializados a varias partes de mundo por las
empresas Bioagro (Latinoamérica) e Idebio SL (Europa). Han sido certificados
por la empresa Suiza IMO, cumpliendo los requerimientos de |
|
Costa Rica |
Determinar la posibilidad técnica y económica de obtener quitina y
quitosano a partir de langostino (Pleuroncodes planipes) (Sibaja,
2001). |
|
Cuba |
1.Patentes para la producción de quitina
pura (Nieto, 1980) y aprovechamiento integral de los desechos de langosta
común (García et al., 1983). 2.Desarrollo de procesos tecnológicos para el
aprovechamiento tecnológico de la langosta (Argüelles et al., 1988) |
|
Ecuador |
Obtención de quitina, transformación a quitosano y elaboración de
películas biodegradables a partir de desperdicios de crustáceos (Alvarado et al., 2004). |
|
México |
1.Desarrollar tecnología que permita
utilizar la cáscara de camarón desperdiciada en la región, como materia prima
para la producción de quitina y quitosano (Luvian y Toledo, 2003). 2.Solicitud
de patente para desarrollar productos antifúngicos a base de quitosano y
extractos de resinas de Larrea
tridentata (Lira et al, 2005). 3.Formulación de un
paquete tecnológico para el aprovechamiento del desecho de cabeza del camarón
de cultivo para la obtención de un producto precursor de quitina y estudio de
su mercado potencial en el mundo (Ciad, 2004). |
|
Venezuela |
Estudio
Técnico-Económico: Instalación de una planta procesadora de residuos de
camarones para la obtención de harina y quitina en Zulia (Pernía, 2005). |
|
Argentina, Chile y
España |
Establecimiento de
un sistema optimizado y controlado de obtención de quitina y quitosano. Optimización
y control de la producción de quitosano y derivados (Cyted, 2000). |
|
Iberoamérica |
Formación de |
Un punto
importante de resaltar sobre las tendencias de producción y aplicación de
quitosano en Latinoamérica es el desaliento que puede surgir para la creación
de empresas productoras y distribuidoras de estos biomateriales debido a la
lentitud de los trámites burocráticos necesarios para la obtención de los
reconocimientos gubernamentales. Algunas de las empresas latinoamericanas han
encontrado este tipo de dificultades en la comercialización de productos con
mayor valor agregado (generalmente productos dietéticos) basados en quitosano,
e incluso, en uno de los casos más curiosos, han debido exportar hacia otro
país la materia prima base para luego importar y distribuir el producto final,
el cual irónicamente si tiene el reconocimiento oficial.
Otro aspecto a ser
considerado en este sentido es el efecto que sobre los precios mundiales de
quitina y quitosano pueden imponer productores con ventajas competitivas,
especialmente algunos países asiáticos, los cuales han inundado el mercado
mundial en los últimos años con precios difíciles de igualar. Sin embargo, a
pesar de que éstos hechos pudieran ser perjudiciales para la producción local
de quitina y quitosano, sin lugar a dudas ampliarían el espectro de usos de
estos biomateriales también en nuestra región.
CONCLUSIONES
La quitina y,
especialmente, el quitosano parecen llamados a seguir incrementando
fuertemente, y a corto plazo, su presencia como agroquímicos de origen natural
en muchas áreas relacionadas con la agricultura. Las principales razones que
permiten vislumbrar este futuro inmediato son: la relativa facilidad de acceso
y los bajos costos de los materiales que permiten obtenerlos, la baja
incidencia ambiental que parecen poseer para la aplicación de volúmenes
grandes, la baja toxicidad para humanos y animales, la versatilidad de formas
de usos (soluciones, hidrogeles, películas) y el amplio espectro de uso que han
encontrado en la agricultura y actividades relacionadas, abarcando aspectos
como enmiendas de suelo, protección de semillas, estimulación del crecimiento,
inducción de mecanismos de defensa, protección de plantas contra fitopatógenos
(raíces, hojas, frutos), bactericida, nematicida, matriz para la liberación de
agroquímicos, protección postcosecha de frutos y vegetales, preservación de
productos, etc. Una ventaja adicional de estos materiales es que pueden ser
obtenidos a partir de fuentes muy diversas, pudiendo por ello generarse materiales
con distintas propiedades, lo cual hace que se continúe investigando
intensamente en este campo y generándose continuamente conocimiento nuevo que
permite mejorar y diversificar sus aplicaciones.
En lo que se refiere
a Latinoamérica también se puede vislumbrar un panorama prometedor a corto y
mediano plazo para el uso de estos biomateriales en el área de la agricultura.
En primer lugar, algunos cálculos han estimado que la región genera material
quitinoso que permitiría producir quitina y quitosano en cantidad suficiente
para satisfacer más allá de la demanda mundial actual. En segundo término, ya
existen en la región varias empresas que producen y comercializan quitina y
quitosano, un paso importante para comenzar a garantizar el abastecimiento local
de estos productos, lo que obviamente dependerá de los vaivenes del mercado
internacional. Finalmente, pero sumamente importante, la región cuenta con una
comunidad importante de investigadores que han dedicado buena parte de sus
esfuerzos al desarrollo de métodos de producción y caracterización de quitina y
quitosano así como también a estudios de aplicación en actividades relacionadas
con la agricultura.
LITERATURA CITADA
Abd-El-Kareem,
F. 2002. Integrated treatments between bioagents and chitosan
on root rot diseases of pea plants under field conditions. Egyptian Journal of
Applied Science 17: 257- 279.
Abd-El-Kareem, F.; M. A. Abd-Alla and R. S.
El-Mohamedy. 2002. Induced resistance in potato plants for controlling early
blight disease under field condition. Egyptian Journal of Applied Science 17:
51-66.
Abd-El-Kareem,
F.; M. A. Abdallah, N. G. El-Gamal and N. S. El-Mougy. 2004. Integrated control
of Lupin root rot disease in solarized soil under greenhouse and field
condition. Egyptian Journal of Phytopathology 32: 49-63.
Abd-El-Kareem,
F.; N. S. El-Mougy, N. G. El-Gamal and Y. O. Fotouh. 2006. Use of
Chitin and Chitosan against Tomato Root Rot Disease under Greenhouse Conditions.
Research Journal of Agriculture and Biological
Sciences 2:
147-152.
Allan,
C. R. and L. A. Hardwiger. 1979. The fungicidal effect of chitosan on fungi of
varying cell wall composition. Experimental Mycology 3: 285–287.
Alvarado, J.;
M. Arancibia y A. Almeida. 2004. Proyecto: Obtención de quitina, transformación
a quitosano y elaboración de películas biodegradables a partir de desperdicios
de crustáceos. Universidad Técnica de Ambato, Facultad de Ciencia e Ingeniería
de Alimentos, Centro de Investigación Científica. Perú. Sitio web:
http://fcial.uta.edu.ec/archivos/Quitina.pdf; consultado 10/02/2008.
Arai
K.; T. Kinumaki and T. Fujita. 1968. Toxicity of chitosan. Bulletin of the Tokai Regional Fisheries Research
Laboratory 56: 89–92.
Argüelles, W.;
I. García, D. Oviedo, J. M. Nieto y C. Peniche. 1988. Diseño de un Proceso
Tecnológico para el Aprovechamiento del Cefalotórax de Langosta. Tecnología
Química 1: 54-62.
Barka,
E. A.; P. Eullaffroy, C. Climent and G. Vernet. 2004. Chitosan improves development,
and protects Vitis vinifera L. against Botrytis cinerea. Plant
Cell Reports 22: 608-614.
Baron,
J. 2001.
IR-4 New Products/Transitional Solution List–March, 2001. The IR-4
Project Newsletter 32(1): Special insert, p16. Sitio web: http://ir4.rutgers.edu/newsletter/vol32-1;
consultado 10/11/2007
Bautista Baños, S.; M.
Hernández López, E. Bosquez Molina and C. L. Wilson. 2003. Effects of chitosan and plant extracts on growth
of Colletotrichum gloeosporioides, anthracnose levels and quality of
papaya fruit. Crop Protection 22: 1087–1092.
Bautista
Baños, S.; A. N. Hernández Lauzardo, M. G. Velázquez del Valle, E. Bosquez
Molina y D. Sánchez Dominguez. 2005. Quitosano: una alternativa natural para
reducir microorganismos postcosecha y mantener la vida de anaquel de productos
hortofrutícolas. Revista Iberoamericana de Tecnología Postcosecha 7: 1-6.
Bautista
Baños, S.; A. N. Hernández Lauzardo, M. G. Velázquez del Valle, M. Hernández
López, E. Barka, E. Bosquez Molina and C. L. Wilson. 2006. Chitosan as a potential natural compound
to control pre and postharvest diseases of horticultural commodities. Crop
Protection 25: 108–118.
Bhaskara, M. V.; J. Arul, P. Angers and L. Couture. 1999. Chitosan Treatment of Wheat Seeds Induces Resistance to Fusarium graminearum and Improves Seed Quality. Journal of Agriculture and Food Chemistry 47: 208–1216.
Baxter, S., S. Zivanovic and J. Weiss. 2005. Molecular weight and degree of acetylation of high-intensity
ultrasonicated chitosan. Food Hydrocolloids 19: 821-830.
Benhamou, N. 1992.
Ultrastructural and cytochemical aspects of chitosan on Fusarium oxysporum f.
sp. radicis-lycopersici, agent of tomato crown and
root rot. Phytopathology 82: 1185–1193.
Benhamou,
N. ; P. J. Lafontaine and M. Nicole. 1994. Induction of systemic resistance to Fusarium crown and root rot in tomato
plants by seed treatment with chitosan. Phytopathology,
84: 1432–1444.
Benhamou,
N. 1996. Elicitor-induced plant defense pathway. Trends in Plant Science 7:
233-240.
Benhamou,
N.; J. W. Kloepper and S. Tuzun. 1998. Induction of resistance against Fusarium
wilt of tomato by combination of chitosan with endophytic bacteria strain:
ultrastructure and cytochemistry of the host response. Planta 204: 153–168.
Ben-Shalom,
N.; R. Ardi, R. Pinto, C. Aki and E. Fallik. 2003. Controlling gray mould
caused by Botrytis cinerea in
cucumber plants by means of chitosan. Crop Protection 22: 285–290.
Boguslawski,
S.; M. Bunseit and D. Knorr. 1990. Effects of chitosan treatment on clarity and
microbial counts of apple juice. Zeitschrift für Lebensmittel-Technologie und -Verfahrenstechnik 41:
42–44.
Bough,
W. A. 1975. Reduction of suspended solids in vegetable canning waste effluents
by coagulation with chitosan. Journal of Food Science 40: 297–301.
Bough,
W. A. and D. R. Landes. 1978. Recovery and nutritional evaluation of
proteinaceous solids separated from whey by coagulation with chitosan. Journal of Dairy Science 59: 1874–1880.
Caprile, M.
G. 2005. Obtención y utilización de quitina y quitosano a partir de desechos de
crustáceos. In: International Solid Waste Association. Hacia un sistema
integral de gestión de residuos sólidos urbanos. Copenhagen, ISWA, p.1-6.
Presentado en el Congreso Mundial ISWA 2005: Hacia un Sistema Integral de
Gestión de Residuos Sólidos Urbanos, Buenos Aires, 6-10 nov. 2005.
Centro de Investigación en Alimentación y Desarrollo (CIAD). 1998. Paquete tecnológico
para el aprovechamiento del desecho de cabeza del camarón de cultivo para la
obtención de un producto precursor de quitina y estudio de su mercado potencial
en el mundo. Centro de Investigación en
Alimentación y Desarrollo, A.C. Anuario, p 104.
Chandrkrachang,
S. 2002. The applications of chitin and chitosan in agriculture in Thailand.
In: K. Suchiva, S. Chandrkrachang, P. Methacanon and M.G. Peter, Editors. Advances in Chitin Science, 5,
458–462. ISBN 974-229-412-7.
Chang, J. H.; J. H. Shin, I. S. Chung and H. J. Lee. 1998. Improved menthol
production from chitosan-elicited suspension culture of Mentha piperita.
Biotechnology Letters 20: 1097–1099.
Chatterjee,
S.; S. Chatterjee, B. P. Chatterjee and A. K. Guha. 2004. Clarification of
fruit juice with chitosan. Process
Biochemistry 39: 2229–2232.
Chibu,
H. and H. Shibayama. 2001. Effects of chitosan applications on the growth of
several crops. In: T. Uragami,
K. Kurita and T. Fukamizo, Editors. Chitin
and Chitosan in Life Science, Yamaguchi. 235–239. ISBN 4-906464-43-0.
Chien,
P. J.; F. Sheu and H. R. Lin. 2007a. Coating citrus (Murcott tangor)
fruit with low molecular weight chitosan increases postharvest quality and
shelf life. Food Chemistry 100: 1160–1164.
Chien, P. J.; F. Sheu and F. H. Yang. 2007b. Effects of edible chitosan coating on quality and shelf life of sliced mango fruit. Journal of Food Engineering 78: 225-229.
Chirkov,
S. N. 2002. The antiviral activity of chitosan. Applied Biochemestry and
Microbiology 38: 1–8.
Chung,
Y.; H. L. Wang, Y. M. Chen and S. L. Li. 2003. Effect of abiotic factors on the
antibacterial activity of chitosan against waterborne pathogens. Bioresource
Technology 88: 179–184.
Chung,
Y.; Y. Su, C. Chen, G. Jia, H. Wang, J. Wu and J. Lin. 2004. Relationship
between antibacterial activity of chitosan and surface characteristics of cell
wall. Acta Pharmacologica Sinica 25: 932-936.
Chung, Y. C. and C. Y. Chen. 2008. Antibacterial characteristics and activity of acid-soluble chitosan. Bioresource Technology 99: 2806-2814.
Ciencia y Tecnología para el Desarrollo
(CYTED). 2000. Establecimiento de un sistema optimizado y controlado de obtención
de quitina y quitosano. Optimización y control de la producción de quitosano y
derivados. Proyecto Iberoeka 00-077 (QUITINCONTROL). Memorias 1999-2000, p 250.
Sitio web: www.cyted.org.
Ciencia y Tecnología para el Desarrollo (CYTED). 2001-2002. Red Temática IV.G. Red Iberoamericana Sistema Quitina/Quitosano: Aplicaciones y Desarrollos en el Agro y la Industria. Coordinadora: Angeles Heras Caballero. Memorias, p 54. Año de inicio: 2002. Sitio web: www.cyted.org.
Cote,
F. and M. G. Hahn. 1994. Oligosaccharin: structures and signal transduction.
Plant Molecular Biology 26: 1379–1411.
Cuero,
R. G.; G. Osuji and A. Washington. 1991. N-carboxymethyl chitosan inhibition of
aflatoxin production: role of zinc. Biotechnology Letters 13: 441–444.
Culbreath,
A. K.; R. Rodríguez Kábana and G. Morgan Jones. 1985. The use of hemicellulosic
waste matter for reduction of the phytotoxic effects of chitin and control of
root-knot nematodes. Nematropica 15: 49-75.
Devlieghere,
F.; A. Vermeulen and J. Debevere. 2004. Chitosan: antimicrobial activity,
interactions with food components and applicability as a coating on fruit and
vegetables. Food Microbiology
21: 703–714.
Du, J.
M. ; H. Gemma and S. Iwahori. 1997. Effects of
chitosan coating on the storage of peach, Japanese pear, and kiwifruit. Journal of the Japanese Society of
Horticultural Science 66: 15–22.
El
Ghaouth, A.; J. Arul, R. Ponnampalam and M. Boulet. 1991. Chitosan coating
effect on storability and quality of fresh strawberries. Journal of Food Science
56: 1618–31.
El-Ghaouth,
A.; J. Arul, J. Grenier and A. Asselin. 1992a. Effect of chitosan and other
polyions on chitin deacetylase in Rhizopus stolonifer. Experimental Mycology 16:
173–177.
El-Ghaouth, A.; J. Arul,
J. Grenier and A. Asselin.
1992b. Antifungal activity of chitosan on two
postharvest pathogens of strawberry fruits. Phytopathology 82: 398–402.
El
Ghaouth, A., R. Ponnamapalam, F. Castaiglne and J. Arul. 1992c. Chitosan
coating to extend the storage life of tomatos. HortScience 27: 1016–1018.
El-Ghaouth,
A.; J. Arul, J. Grenier, N. Benhamou, A. Asselin and G. Belanger. 1994. Effects
of chitosan on cucumber plants: Suppression of Pythium aphanidermatum
and induction of defense reactions. Phytopathology 84:
313–320.
El-Ghaouth,
A.; J. L. Smilanick and C. L. Wilson. 2000. Enhancement of the performance of Candida saitoana by the addition of
glycolchitosan for the control of postharvest decay of apple and citrus fruit. Postharvest Biology and Technology 19:
103–110.
Everett,
K. R.; S. G. Owen and J. M. Cutting. 2005. Testing efficacy of fungicides
against postharvest pathogens of avocado (Persea Americana cv. Hass).
New Zealand Plant Protection 58: 89–95.
Fernández, C.; S. Ausar, R. Badini, L.
Castagna, I. Bianco and D. Beltramo. 2003. An FTIR
spectroscopy study of the interaction between αs-casein-bound
phosphoryl groups and chitosan. International Dairy Journal 13: 897-901.
Galed, G.; M. E. Fernández Valle, A.
Martínez and A. Heras. 2004. Application of MRI to monitor the process
of ripening and decay in citrus treated with chitosan solutions. Magnetic
Resonance Imaging 22: 127–137.
García, I.;
D. Oviedo, J. M. Nieto, C. Peniche y R. D. Henríques. 1983. Método para el
aprovechamiento integral del desecho de langosta común. Patente Cubana
CU21658A1.
Global
Industry Analyst Inc. 2007. Chitin & Chitosan (Specialty Biopolymers).
Global Strategic Business Report. Chapter 9. USA. Pub ID: GJOB1473672
Goodman,
W. G. 1989. Chitin: A magic bullet. The Food Insects Newsletter 2: 1, 6-7.
Goycoolea,
F.; E. Agulló y R. Mato. 2004. Fuentes y Procesos. En: Quitina y Quitosano:
obtención, caracterización y aplicaciones. Fondo Editorial del Pontificia
Universidad Católica del Perú. Ana Pastor Editora. Cap 3 p 105.
Gutiérrez, A.
1998. Plan Estratégico del Estado Mérida. Algunas características importantes del Sector Agrícola del Estado Mérida.
Provincia: Revista Venezolana de Estudios Territoriales 5-6 (I Etapa): 21-39.
Hadwiger,
L. A.; D. F. Kendra, B. W. Fristensky and W. Wagoner. 1986. Chitosan both
activates genes in plants and inhibits RNA synthesis in fungi. In: Muzzarelli, R.A.A., Jeuniaux, C.,
Gooday, G.W. (Eds.), Chitin in Nature and Technology. Plenum Press, New York,
pp. 209–214.
Hadwiger,
L. A. and P. O. McBride. 2006. Low-level copper plus chitosan applications
provide protection against late blight of potato. Plant Health Progress, April.
doi:10.1094/PHP-2006-04XX-01-RS.
Helander, I. M.; E. L. Nurmiaho Lassila, R. Ahvenainen, J. Rhoades and S. Roller. 2001. Chitosan disrupts the barrier properties of the outer
membrane of Gram-negative bacteria. International Journal of Food Microbiology
71: 235-244.
Hewajulige,
I. G.; D. Sivakumar, Y. Sultanbawa, R. S Wijeratnam and R. L. Wijesundera.
2006. Effect of chitosan coating on postharvest life of papaya (Carica Papaya L) var. Rathna Grown in
Sri Lanka. Eighteenth Annual Congress of the PGIA, 16-17, Nov.
Hewajulige, I. G.; D. Sivakumar, Y. Sultanbawa, R. S.
Wijeratnam and R. L. Wijesundera. 2007. Effect of chitosan coating on the
control of anthracnose and overall quality retention of papaya (Carica papaya)
during storage. Acta Horticulturae 740:
245-250.
Hirano, S.
Hirano,
A. and N. Nagano. 1989. Effects of chitosan, pectic acid, lysozyme, and
chitinase on the growth of several phytopathogens. Agricultural
and Biological Chemistry 11:
3065–3066.
Hongfei,
W. and L. Hesheng. 2003. Effects of chitosan on clarification of apple fruit
juice. LWT - Food Science and Technology 36:
691-695.
Kauss, H.; W. Jeblick and A. Domard. 1989. The degrees of
polymerization and N-acetylation of chitosan determine its ability to elicit
callose formation in suspension cells and protoplasts of Catharanthus roseus. Planta 178: 385–392.
Kendra,
D. F. and L. A. Hadwiger. 1984. Characterization of the smallest chitosan
oligomer that is maximally antifungal to Fusarium solani and elicits
pisatin formation in Pisum sativum.
Experimental Mycology 8: 276–281.
Khan,
W.; B. Prithiviraj and D. Smith. 2003. Chitosan
and chitin oligomers increase phenylalanine ammonia-lyase and tyrosine
ammonia-lyase activities in soybean leaves. Journal of Plant Physiology
160: 859–863
Kneer,
R.; A. Poulev, A. Olesisnski and I. Raskin. 1999. Characterization of the
elicitor-induced biosynthesis and secretion from roots of Lupinus luteus L. Journal of Experimental Botany 50: 1553-1559.
Kurzawińska, H. 2007. Potential use of chitosan in the control
of lettuce pathogens. Polish Chitin Society Monograph XII:
173–178.
Lafontaine,
P. J. and N. Benhamou. 1996. Chitosan treatment: an emerging strategy for
enhancing resistance of greenhouse tomato to infection by Fusarium oxysporum
f.sp. radicilycopersici. Biocontrol Science and Technology 6:
111-124.
Launay,
B.; J. L. Doublier and G. Cuvelier. 1986. Flow properties of aqueous solutions
and dispersions of polysaccharides. En:Functional
properties of food macromolecules. Mitchell, J. R. and Ledward, D.
A.(eds.), Elsevier Applied Science Publishers, New York, 12-19.
Lárez, C.
2002. Algunos usos del quitosano en sistemas acuosos. Revista Iberoamericana de
Polímeros 4: 91-109.
Lárez, C.; L.
Lozada, E. Millán, I. Katime y P. Sasía. 2003. La densidad de carga de
polielectrolitos y su capacidad de neutralización en sistemas coloidales.
Revista Latinoamericana de Metalurgia y Materiales 23: 16-20.
Lárez, C.
2006. Quitina y quitosano: materiales del pasado para el presente y el futuro.
Avances en Química 1: 15-21.
Lárez, C.; D.
Medina, C. Torres y E. Millán. 2007. Kinetic of the enzymatic degradation
of chitosan using bromelain: a viscosimetric study. Avances en Química 2:
25-32.
Lárez C.; J. Sánchez y E. Millán. 2008. Viscosimetric
studies of chitosan nitrate and chitosan chlorhydrate in acid free NaCl aqueous
solution. e-polymers 014. www.e-polymers.org
Lee, S.; H. Choi, S. Suh, I. S. Doo, K. Y Oh, E.
Choi, A. T. Schroeder, P. S. Low and
Y. Lee. 1999. Oligogalacturonic Acid and Chitosan Reduce Stomatal Aperture by
Inducing the Evolution of Reactive Oxygen Species from Guard Cells of Tomato
and Commelina communis. Plant
Physiology 121: 147–152.
Li, H. and Y. Yu. 2001. Effect of chitosan on incidence of
brown rot, quality and physiological attributes of postharvest peach fruit.
Journal of the Science of Food and Agriculture 81: 269-274.
Li, Y.;
X. G. Chen, N. Liu, C. S. Liu, C. G. Liu, X. H. Meng, L. J. Yu and J. F.
Kenendy. 2007. Physicochemical characterization and antibacterial property of
chitosan acetates. Carbohydrate Polymer 67: 227–232.
Lira, R.; R.
G. López, M. E. Treviño y L. A. Villarreal. 2005. Solicitud de Patente para:
Producto antifúngico para uso agrícola obtenido con formulaciones de extractos de
resina de Larrea tridentata y el
bipolímero Quitosán. No. De Expediente: NL/a/2005/000284. México.
Liu,
H.; Y. Du, X. Wang and L. Sun. 2004. Chitosan kills bacteria through cell
membrane damage. International Journal of Food Microbiology 95: 147– 155.
Liu,
J.; S. Tian, X. Menga and Y. Xua. 2007. Effects of chitosan on control of
postharvest diseases and physiological responses of tomato fruit. Postharvest
Biology and Technology 44: 300–306.
Lockwood,
G. B.; S. Bunrathep, T. Songsak and N. Ruangrungsi. 2007. Production of d-Limonene
in Chitosan Elicited Citrus Japonica Suspension Cultures. Journal of Essential
Oils Research March/April, 113-116.
Luvian, A. R. y A. R. Toledo. 1993. Comparación de
métodos de extracción de quitina y quitosano a partir de cáscara de camarón y
análisis preliminar de su producción en planta piloto. CIAD, A.C. México. Sitio
web: www.pncta.com.mx/pages/pncta_investigaciones_ 93b.asp; consultado
10/11/2007
Mankau,
R. and S. Das. 1969. The influence of chitin amendments on Meloidogyne
incognita. Journal of Nematology 1: 15-16.
McCormick,
C. L.; K. W. Anderson and B. H. Hutchison. 1982. Controlled Activity Polymers
with Pendently Bound Herbicides. Polymer Reviews 22: 57-87.
Moerschbacher, B.; K. H Kogel, U. Noll and H. J. Reisener. 1986. An elicitor of
the hypersensitive lignification response in wheat leaves isolated from the
rust fungus Puccinia graminis f. sp. tritici. I. Partial
purification and characterization. Zeitung für Naturforschung 41: 830–838.
Nge, K. L.; N. Nwe, S. Chandrkrachang and W. F. Stevens. 2006. Chitosan as a growth stimulator in orchid tissue culture. Journal of Plant Science 170: 1185-1190.
Nieto, O.
M. 1980. Método para la obtención de quitina suficientemente pura. Patente
Cubana CU20760A.
Noguchi, H.
Oszmiański, J. and
A. Wojdyło. 2007. Effects of various clarification treatments on phenolic
compounds and color of apple juice. European Food Research and Technology A224: 755–762.
Palma, G.; P. Casals and G. Cárdenas. 2005.
Synthesis and characterization of new chitosan-O-ethyl phosphonate. Journal of
the Chilean Chemistry Society 50: 719-724.
Palma Guerrero, J.; H. B. Jansson, J.
Salinas, and L. V. Lopez Llorca. 2008. Effect of chitosan
on hyphal growth and spore germination of plant pathogenic and biocontrol
fungi. Journal of Applied
Microbiology. 104: 541-553.
Papineau, A. M.; D. G. Hoover, D. Knorr
and D. J. Farkas. 1991. Antimicrobial effect of water-soluble chitosans with
high hydrostatic pressure. Food
Biotechnology 5: 45–57.
Pearce, R. B. and J. P. Ride. 1982. Chitin and related
compounds as elicitors of the lignification response in wounded wheat leaves.
Physiological and Molecular Plant Pathology 20: 119–123.
Pernía, Y.
2005. Estudio Técnico Económico: Instalación de una planta procesadora de
residuos de camarones para la obtención de harina y quitina”. Polímeros y
Proteínas de Venezuela, CA. Corpozulia – Maracaibo.
Pospieszny, H.; S. Chirkov and J. Atabekov. 1989. Effect of chitosan on the hypersensitive reaction of bean to alfalfa mosaic virus. Plant Science 62: 29-31.
Pospieszny, H.; S. Chirkov and J. Atabekov. 1991. Induction of antiviral resistance in plants by chitosan. Plant Science 79: 63-68.
Pospieszny.
H. 1997. Antiviroid activity of chitosan. Crop Protection 16: 105–106.
Prapagdee, B.; K. Kotchadat, A. Kumsopa and N. Visarathanonth. 2007. The role of chitosan in protection of soybean from sudden death syndrome caused by Fusarium solani f. sp. Glycines. Bioresource Technology 98: 1353-1358.
Ratanachinakorn,
B.; W. Kumsiri, Y. Buchsapawanich and J. Singto. 2005. Effects of chitosan on
the keeping quality of pummelos. Acta Horticulturae 682: 1769-1772.
Rinaudo, M.; M. Milas and P. Dung. 1993.
Characterization of chitosan. Influence of ionic strength and degree of
acetylation on chain expansion. International Journal of Biological
Macromolecules 15: 281-285.
Rodríguez
Kabana, R.; G. Morgan Jones and I. Chet. 1987. Biological control
of nematodes: Soil amendments and microbial antagonists. Plant and Soil 100:
237-247.
Rodríguez,
M.; L. Albertengo, I. Vitale and E. Agulló. 2003. Relationship
between astringency and chitosan saliva solutions turbidity at different pH.
Journal of Food Science 68: 665-667
Roller,
S. and N. Covill.1999. The
antifungal properties of chitosan in laboratory media and apple juice. International Journal of Food Microbiology 47: 67–77.
Root,
T. and E. L. Johnson.
Roussy, J.; M. Van
Vooren and E. Guibal. 2005. Chitosan for the Coagulation and Flocculation of
Mineral Colloids. Journal of Dispersion Science and Technology
25: 663–677.
Sathiyabama, M. and R. Balasubramanian. 1998.
Chitosan
induces resistance components in Arachis hypogaea against leaf rust
caused by Puccinia arachidis Speg. Crop Protection 17: 307-313.
Sharathchandra,
R. G.; S. N. Raj, N. P. Shetty, K. N. Amruthesh and H. S. Shetty.
Sibaja,
M. 2001. Diseño y puesta en marcha del arte de captura y del diseño de una
planta de industrialización del camarón “Langostino” (Pleuroncodes planipes) para la extracción de quitina y quitosano. Proyecto
FC-026-01. Conicit Costa Rica. Sitio web: www.conicit.go.cr/ conicit/memorias/infa2002/solconcur.html;
consultado 27/02/2007.
Sneh,
B. and Y. Henis. 1972. Production of antifungal substances active against Rhizoctonia
solani in chitin amended soil. Phytopathology 62: 595-600.
Spiegel, Y.; E. Cohn and I. Chet. 1986. Use of chitin
for controlling plant parasitic nematodes. I. Direct effects on nematode
reproduction and plant performance. Plant and Soil 95: 87-95.
Spiegel,
Y.; I. Chet and E. Cohn. 1987. Use of chitin for controlling plant-parasitic
nematodes II. Mode of action. Plant and Soil 98: 337-345.
Srinivasa,
P.; R. Baskaran, M. Ramesh, K. H. Prashanth and R. Tharanathan. 2004. Storage
studies of mango packed using biodegradable chitosan film. European Food
Research and Technology 215: 504-508.
Strumia, M.
2004. Subproyecto: Recuperación, aprovechamiento y transformación química de
Quitina/Quitosán extraído de los restos de crustáceos de las costas
patagónicas. Proyecto: Funcionalización de materiales poliméricos: Síntesis,
caracterización y aplicaciones. Subsidiado por: Agencia Nacional (FONCYT) No.
0609706, CONICET 03066, Res 1296/03, y Secyt (UNC) 62/03.
Sudarshan,
N. R.; D. G. Hoover and D. Knorr. 1992. Antibacterial action of chitosan. Food
Biotechnology 6: 257-272.
Szczeponek, A.;
S. Mazur and J.
Nawrocki. 2006. The usage of chitosan on protection of some peppermint and
lemon balm pathogens. Polish
Chitin Society Monograph XI. Sitio
web: www.ptchit.lodz.pl/PTChit/11_24.pdf; consultado 10/11/2007
Tsai,
G. J. and W. H. Su. 1999. Antibacterial activity of shrimp chitosan against Escherichia coli. Journal of Food Protection 62:
239–243.
Teixeira,
M. A.; W. J. Paterson, E. J. Dunn, Q. Li, B. K. Hunter and M. F. Goosen. 1990.
Assessment of Chitosan gels for the controlled release of agrochemicals. Industrial
and Engineering Chemistry Research 29: 1205–1209.
Terbojevich, M.; A. Cosani, G. Conio, E.
Marsano and E. Bianchi. 1991. Chitosan: Chain rigidity and mesophase formation.
Carbohydrate Research 209:
251–260.
Tolaimate, A.; A. Desbrieres, M. Rhazi, A.
Alagui, M. Vicendon and P. Vottero. 2000. On the influence of deacetylation
process on the physicochemical characteristic of chitosan from squid chitin.
Polymer 41: 2463-2469.
Thommohaway,
C.; S. Kanlayanarat, A. Uthairatanakij and P. Jitareerat. 2007. Quality of
fresh-cut guava (Psidium Guajava L.)
as affected by chitosan treatment. Acta Horticulturae 746: 449-455.
Varma,
A. J.; S. V. Deshpande and J. F. Kennedy. 2004. Metal complexation by chitosan
and its derivatives: a review. Carbohydrate Polymer 55: 77–93.
Waliszewski, K. N.; V.
T. Pardio and M. Ramirez. 2002. Effect of chitin on color during osmotic
dehydratation of banana slices. Drying Technology 20:
719–726.
Wanichpongpan,
P.; K. Suriyachan and S. Chandrkrachang. 2001. Effects of chitosan on the
growth of Gerbera flower plant (Gerbera jamesonii). In: T. Uragami, K.
Kurita and T. Fukamizo, Editors. Chitin
and Chitosan in Life Science, Yamaguchi, p 198–201.
Wojdyła, A.; L. Orlikowski, A. Niekraszewicz and H. Struszczyk. 1996. Effectiveness of chitosan in the control
of Sphaerotheca pannosa var. Rosae
and Peronospora sparsa on roses and Myrothecium roridum on
difenbachia. Medical Faculty Landbouww, University of Gent 2:
461–464.
Worakeeratikul, W.; V. Srilaong, A.
Uthairatanakij and P. Jitareerat. 2007. Effects of hydrocooling and chitosan
coating on browning and physiological changes in fresh-cut rose apple. Acta Horticulturae 746: 427-434.
Xu, J.;
X. Zhao, X. Wang, Z. Zhao and Y. Du. 2007. Oligochitosan inhibits Phytophthora
capsici by penetrating the cell membrane and putative binding to
intracellular targets. Pesticide Biochemistry and Physiology 88: 167–175.
Yeom,
C. K.; Y. H. Kim and J. M. Lee. 2002. Microencapsulation of water-soluble
herbicide by interfacial reaction. II. Release properties of microcapsules. Journal of Applied
Polymer Science 84: 1025-1034.
Yu, T.;
H. Y. Li and X. D. Zheng. 2007. Synergistic effect of chitosan and Cryptococcus laurentii on inhibition of Penicillium expansum infections.
International Journal of Food Microbiology 114: 261–266.
Zhang,
D. and P. C. Quantick. 1998. Antifungal effects of chitosan coating on fresh
strawberries and raspberries during storage. Journal of Horticultural Science and Biotechnology 73: 763–767.
Zhang,
M. and T. W. Tan. 2003. Insecticidal and fungicidal activities of chitosan and
oligo-chitosan. Journal of Bioactive and Compatible Polymer 18: 391–400.
Página diseñada por Prof. Jesús Rafael Méndez Natera
TABLA DE CONTENIDO DE LA REVISTA CIENTÍFICA UDO
AGRÍCOLA



