Revista Científica UDO Agrícola Volumen 8.
Número 1. Año 2008. Páginas: 42-51
Polvos, extractos y fracciones de hojas de Cestrum nocturnum L. y su actividad antifúngica en dos aislamientos de Fusarium spp.
Powders,
extracts and fractions of leaves of Cestrum
nocturnum L. and their antifungal activity over
two isolations of Fusarium spp.
Silvia BAUTISTA BAÑOS ![]() 1, Laura Leticia BARRERA NECHA1,
Ana Niurka HERNÁNDEZ
LAUZARDO1, Miguel Gerardo VELÁZQUEZ DEL VALLE 1,
Irán ALIA TEJACAL2 y Dagoberto GUILLÉN SÁNCHEZ3
1, Laura Leticia BARRERA NECHA1,
Ana Niurka HERNÁNDEZ
LAUZARDO1, Miguel Gerardo VELÁZQUEZ DEL VALLE 1,
Irán ALIA TEJACAL2 y Dagoberto GUILLÉN SÁNCHEZ3
1Centro de
Desarrollo de Productos Bióticos, Instituto Politécnico Nacional. Carr. Yautepec-Jojutla Km. 8.5
San Isidro, Yautepec, Morelos, México CP 62731; 2Facultad de
Ciencias Agropecuarias, Universidad
Autónoma del Estado de Morelos. Av. Universidad Núm. 1001. 62209,
Chamilpa, Cuernavaca, Morelos y 3Campus Oriente, Universidad
Autónoma del Estado de Morelos. Nicolás Bravo s/n. Parque Industrial Cuautla, Xalostoc, Morelos, México CP 91690. E-mails: sbautis@ipn.mx ![]() Autor para
correspondencia
Autor para
correspondencia
|
Recibido: 05/02/2008 |
Fin
de primer arbitraje: 01/04/2008 |
Primera
revisión recibida: 17/04/2008 |
|
Fin
de segundo arbitraje: 02/06/2008 |
Segunda revisión
recibida: 04/07/2008 |
Aceptado: 10/07/2008 |
Resumen
Una de las principales causas de pérdidas postcosecha de frutas y hortalizas es la pudrición causada
por Fusarium spp.
Una
de las posibles alternativas en el control de estas enfermedades es la
utilización de especies botánicas con propiedades fungicidas ya sea en polvos o
extractos. El género Cestrum
se compone de una diversidad de especies con diferentes usos en la medicina
tradicional, asociándose también con actividad insecticida y fungicida. Los
objetivos de esta investigación fueron obtener
extractos acuosos, etanólicos, metanólicos,
clorofórmicos, diclorometánicos y acetónicos
de C. nocturnum
y evaluar su actividad antifúngica. Las fracciones
obtenidas por cromatografía en columna (CC) fueron evaluadas sobre la
germinación de dos aislamientos de Fusarium
obtenidos de frutos de papaya y ciruela mexicana (Spondias purpurea). Asimismo, se evaluó el potencial fungicida de
polvos de C. nocturnum en concentraciones de 0,5; 1,0; 1,5 y
Palabras clave: huele de noche, biofungicidas, papaya, ciruela mexicana.
Abstract
One of the main causes
that originate considerable postharvest loses during handling and storage of
fruits and vegetables is the infection by Fusarium. One possible
alternative to control postharvest disease originated by fungi in fruits and
vegetables is the application of powders and extracts from botanical species
with fungicidal properties. The genus Cestrum is composed by a great diversity
of botanical species with different applications in the traditional medicine,
associated with pesticidal and fungicidal activities.
The objectives of this research were to obtain aqueous, ethanolic,
metanolic, chlorophormic, dichloromethanic and acetonic
extracts, evaluating their antifungal activity. Fractions obtained by column
chromatography (CC) were evaluated on germination of two isolations of Fusarium from
fruits of papaya and red mombin. The fungicidal
potential of powders of C. nocturnum at
concentrations each 0.5, 1.0, 1.5 and
Key words: Night blooming jessamine, biofungicides, papaya,
red mombin
INTRODUCCIÓN
Por su naturaleza biodegradable y utilizados en dosis
apropiadas, los polvos y extractos botánicos pueden ser una alternativa al uso
de fungicidas sintéticos (Hernández et al.,
2005). La especie vegetal Cestrum nocturnum
L. es conocida como huele de noche, dama de noche y jazmín nocturno (Martínez,
1990; 1994). Su fragancia fuerte y
dulce ha hecho que esta planta sea utilizada para fines ornamentales (Bunezgo et al., 1997). Sin embargo, también es
utilizada con fines medicinales. Uno de los principales usos reportados para C.
nocturnum es que disminuye cefaleas, presión alta
y taquicardia. Se menciona también que dentro de su efecto medicinal
contrarresta los espasmos, erupciones cutáneas y la epilepsia. Existen reportes
donde se menciona el potencial fungicida de polvos y extractos de esta especie.
Grainge y Ahmed (1988) clasifican a esta planta
dentro del grupo de las plantas con efecto fungicida. Por su parte, Bravo et
al., (2000) reportan que de 97 especies botánicas C. nocturnum
sobresalió por su efecto fungicida contra Fusarium moniliforme Sheldon. Igualmente Hernández (2004) y Rodríguez (2004)
mencionan la actividad fungicida de C. nocturnum
sobre los hongos Colletotrichum gloeosporioides (Penz.) Penz.
and Sacc., y
Rhizopus stolonifer
(Ehrenb.:Fr.).
Se
sabe que el género Fusarium Link ex Gray es de distribución cosmopolita en todos los
tipos de climas y posee un amplio ámbito de hospedantes (Nelson et al., 1983). El hongo penetra la
cutícula del fruto por medio de enzimas y permanece latente hasta que el fruto
comienza a madurar y entonces se desarrolla rápidamente. Entre los frutos que
se ven más afectados por este microorganismo se encuentra la papaya, melón,
sandía, pera, aguacate, manzana y plátano entre otros (Snowdon,
1990). Los objetivos de este trabajo fueron: 1.- Obtener mezclas de componentes
y fracciones de extractos de C. nocturnum por
cromatografía en capa fina y cromatografía en columna y 2.- Evaluar el
potencial fungicida de polvos y extractos vegetales de esta especie botánica en
diferentes aspectos del desarrollo in
vitro de dos aislamientos de Fusarium.
MATERIALES
Y MÉTODOS
Aislamiento
de Fusarium spp.
Uno de los aislamientos del hongo Fusarium spp
se obtuvo de frutos de papaya (Carica papaya L.)
provenientes del estado de Guerrero, México y el segundo de frutos de ciruela
mexicana (Spondias purpurea L.) de la localidad de Tepoztlan, Morelos, México. Se tomaron porciones del fruto
enfermo previamente desinfectadas con hipoclorito de sodio al 1% y se
depositaron en cajas de Petri que contenían medio de cultivo Papa Dextrosa Agar
(PDA). Se incubaron por 7 días a una temperatura de 25 ±
Obtención de
hojas de C. nocturnum
Las hojas de “huele de noche” se
colectaron en el municipio de Yautepec, Morelos, con número de voucher specimen 2746
(MO). Una vez hecha la recolección se transportaron al laboratorio de
fitopatología postcosecha del Centro de Desarrollo de
Productos Bióticos. Se desecharon todas aquellas con daños o síntoma de plagas
o enfermedades y se almacenaron por un periodo corto de tiempo (12 h máximo) a
una temperatura de
Preparación
de polvos y extractos de C. nocturnum
Las hojas de “huele de noche” se lavaron
con agua corriente, posteriormente se enjuagaron con agua destilada y se
pusieron a secar en una charola sobre papel secante a temperatura ambiente (27
±
Cantidad de
extracto obtenido
Una vez eliminado el disolvente se
procedió a vaciar el extracto concentrado en frascos ámbar y se calculó el
extracto obtenido por diferencia de peso. Los extractos se almacenaron (5 días
aproximadamente) en un cuarto frío a una temperatura de
Bioautografía
Para la
preparación del inóculo se cosecharon las esporas a partir de cultivos de diez
días en cajas de Petri. La superficie de cada caja de Petri se raspó con una aguja
de disección estéril, agregando a cada caja 10 mL de
agua destilada estéril. La suspensión se filtró a través de un embudo y una
gasa estéril, se ajusto con agua destilada estéril a
una concentración de 3 x 105 esporas mL-1. Para detectar la actividad biológica directamente
sobre la placa de CCF, éstas fueron inoculadas con una suspensión de esporas (3
x 105) de Fusarium. Alícuotas de 25-50 mL
de la suspensión de conidios fueron preparados con caldo de papa dextrosa. Cada
placa fue asperjada con 50 mL de la suspensión de
conidios. Las placas fueron colocadas en cámaras húmedas de 23 x
Cromatografía
en Capa Fina Bidimensional (CCF)
Diez microlitros
de cada extracto vegetal se corrieron en cromatografía en capa delgada
bidimensional (AL TLC 20 x
Obtención de Fracciones por (CC)
Para separar las fracciones con actividad antifúngica del extracto acetónico
de 24 h esterilizado, se pesaron
Tratamientos
con polvos de C. nocturnum
Las
concentraciones de polvos de huele de noche utilizadas fueron: 0,5; 1,0; 1,5 y
Tratamientos
con extractos de C. nocturnum
Primer
experimento: a cajas Petri con medio PDA se les agregó por separado cada uno de
los siguientes extractos: acuoso, metanólico o acetónico, siendo los controles PDA, metanol y acetona.
Segundo experimento: los extractos evaluados fueron diclorometano,
cloroformo-metanol-agua (CMA) y etanólico, y como
testigos PDA, diclorometano, CMA y etanol. En ambos experimentos las concentraciones de los
extractos y disolventes puros fueron:
12, 25 y 50 mg mL-1
para cada tratamiento se realizaron 6 repeticiones y fueron probados para los
dos aislamientos de Fusarium.
Variables de
respuesta
a)
Crecimiento micelial de la colonia: se evaluó midiendo diariamente el crecimiento del
micelio desde el centro de la caja hasta la zona marginal de la colonia con
ayuda de un vernier (Plastic Caliper).
Esto se realizó hasta que el micelio del hongo alcanzó la orilla de las cajas
de Petri. Se llevó a cabo un análisis de regresión para obtener la tasa de
crecimiento. Para evaluar el crecimiento micelial de
los dos aislamientos de Fusarium spp se realizaron 6 repeticiones por cada tratamiento
(polvos o extractos). Los valores de crecimiento micelial
se expresaron en mm.
b)
Esporulación: para obtener la suspensión
de esporas, la superficie de cada caja Petri utilizada en la evaluación del
crecimiento micelial se raspó con una aguja de
disección estéril, agregando a cada caja 10 mL de
agua destilada estéril. La suspensión se filtró a través de un embudo de
filtración rápida y una gasa estéril. Para inhibir la germinación de los
conidios se le agregó a la suspensión de esporas unas gotas de safranina-lactofenol. El conteo se realizó en una cámara de Neubauer, se contaron 5 campos del cuadro central de la
cámara con la ayuda de un microscopio
compuesto (Nikkon ALPHAPHOT-2 YS-2) con el objetivo
de 40X y con un contador manual de cuatro dígitos (Marca Compass).
Se realizaron 3 repeticiones por tratamiento y se tomaron lecturas por
duplicado.
c) Porcentaje de germinación en discos de
PDA: Para realizar esta evaluación se
colocaron tres discos de PDA (
Análisis
estadístico
Los experimentos tuvieron un arreglo completamente
al azar. Con los datos relacionados con crecimiento micelial,
germinación y esporulación se realizaron los análisis de varianza con el
programa Sigma Stat versión 2.0. Se obtuvieron medias
y tasas de crecimiento. La separación de medias se llevó a cabo mediante la
prueba de Diferencia mínima significativa (DMS) (p≤ 0,05).
RESULTADOS
Cuantificación
de extractos
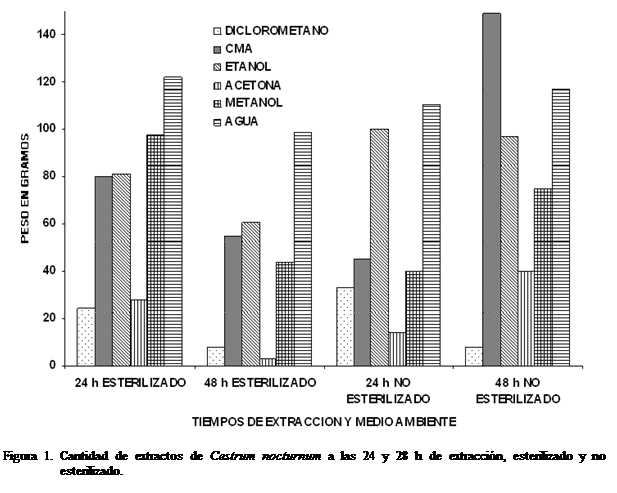
En las Figura 1 se muestran los
resultados obtenidos con la cantidad de extracto obtenido por los diferentes
disolventes aplicados a hojas
de C. nocturnum durante 24 y 48 h,
esterilizado y no esterilizado. Se encontró una mayor cantidad de extracto con
agua (99,7-
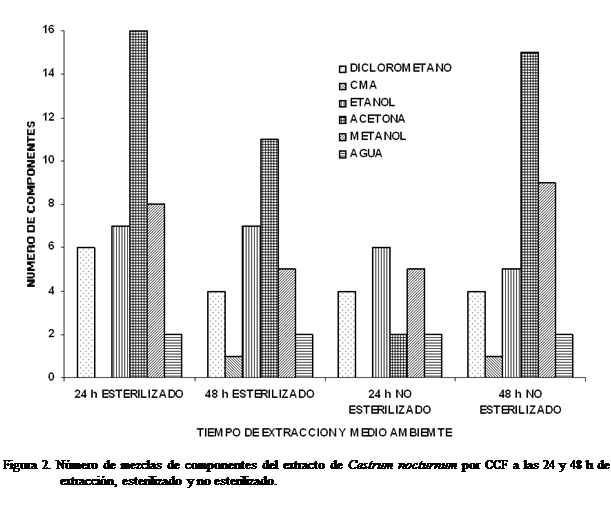
Número de manchas extraídas por CCF
El número de manchas observadas varió de acuerdo
al disolvente utilizado, tiempo de extracción y esterilizado o no. Los
resultados obtenidos utilizando primeramente como eluyente
la mezcla metanol: diclorometano (1:9) y
posteriormente acetato de etilo: hexano (1:1) se presentan en
Diversidad de extractos con actividad antifúngica
En la Figura 3,
se puede observar que en relación al aislamiento de Fusarium de frutos de papaya, con el extracto de diclorometano
se obtuvo una mezcla de componentes (manchas) inhibitorios, con excepción de
las 48 h de extracción esterilizado, donde no hubo presencia de éstos. Con el
extracto de CMA no se observaron componentes inhibitorios en ninguno de los
tratamientos. El número de manchas o mezclas inhibitorias con el extracto etanólico fue de uno (Rf = 0,89), en los tratamientos
esterilizado y no esterilizado, en ambos tiempos de extracción (24 y 48 h). En
general, con el extracto acetónico,
independientemente del tiempo de extracción, esterilizado o no, se observó el
mayor número de mezclas de componentes activos (cinco a seis) Con el extracto metanólico el número varió de uno a dos (Rf = 0,20; 0,72).
Con el extracto acuoso se observaron dos manchas inhibitorias (Rf = 0,25;
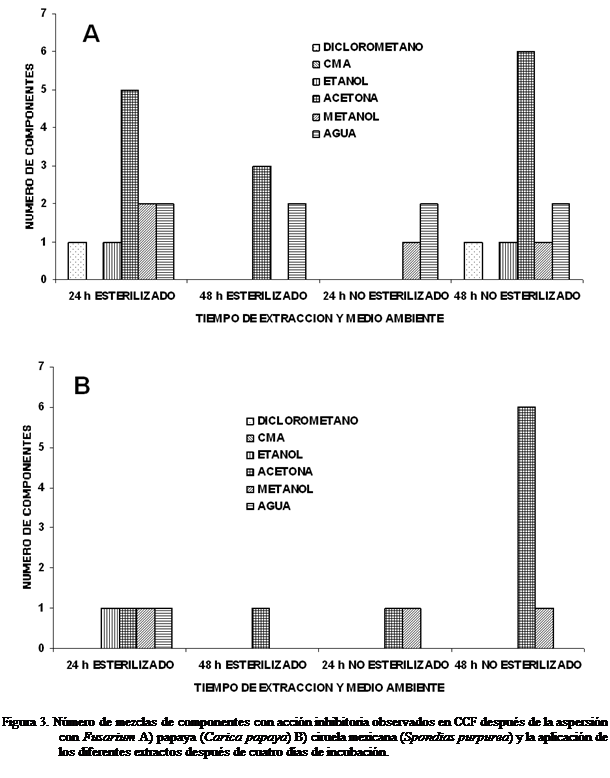
Obtención de Fracciones por Cromatografía en Columna
En total, se colectaron
55 fracciones del extracto acetónico de 24 h de
extracción esterilizado (datos no mostrados). Al terminar el periodo de
incubación de cuatro días, se observó que las fracciones 6, 7, 51 y 55
inhibieron el aislamiento de Fusarium de papaya. Para el aislamiento de Fusarium de ciruela, las fracciones que
inhibieron su desarrollo fueron la 42, 46 y 51.
Tratamientos con polvos de hojas de C. nocturnum
Se
obtuvieron diferencias significativas (p≤ 0,05) en el desarrollo del
micelio de Fusarium aislado de papaya y ciruela mexicana (Cuadro 1). En
el aislamiento de papaya, el menor crecimiento micelial
se observó en el tratamiento testigo (
|
Cuadro 1. Crecimiento micelial,
esporulación y germinación de Fusarium
spp. aislado de papaya (Carica papaya) y ciruela
mexicana (Spondias purpurea)
incubadas en medio PDA y/o diferentes concentraciones de polvos no
esterilizados de hojas de Cestrum nocturnum. |
||||||
|
Polvos g mL-1 |
Fusarium (Papaya) |
Fusarium (Ciruela
Mexicana) |
||||
|
Crecimiento micelial (mm) |
Esporulación (esporas/mL) |
Germinación (%) |
Crecimiento micelial (mm) |
Esporulación (esporas/mL) |
Germinación (%) |
|
|
0,5 |
48,6 a* (6,3)1 |
6,1 x 107
c* |
67,0 a* |
38,0 c* (7,1)2 |
6,7 x107
d* |
68,0 a* |
|
1,0 |
|
4,7 x 107
c |
|
42,4 b (7,5) |
8,2 x 107
c |
|
|
1,5 |
|
8,4 x 107
b |
|
42,4 b (7,1) |
1,1 x 108
b |
|
|
2,0 |
|
1,3 x |
|
42,8 b (7,8) |
1,2 x |
|
|
PDA |
36,5 b (6,0) |
3,7 x 106
d |
36,0 b |
|
8,8 x 106
e |
42,0 b |
|
*Letras iguales indican similitud estadística con la
prueba DMS (p≤ 0,05). Valores entre paréntesis indican la tasa de
crecimiento (mm d-1) durante el período
de incubación de 151 y 102 días. |
||||||
Tratamientos con extractos acuosos, metanólicos y acetónicos de hojas
de C. nocturnum
Se encontraron diferencias
significativas (p≤ 0,05) en el crecimiento micelial
en la mayoría de las concentraciones de los extractos utilizados excepto en el
aislamiento de Fusarium de papaya e
incubada en los extractos acuosos (Cuadro 2). El menor crecimiento micelial en este aislamiento se observó en el tratamiento
donde el hongo se incubó con medio PDA y metanol al 1,0% (
|
Cuadro 2. Crecimiento micelial,
esporulación y germinación de Fusarium
spp. aislado de papaya (Carica papaya) y ciruela
mexicana (Spondias purpurea)
incubadas en medio PDA con diferentes concentraciones de extractos acuosos, metanólicos y acetónicos no
esterilizados de hojas de Cestrum nocturnum. |
||||||
|
Extractos
mg
mL-1 |
Fusarium spp.(Papaya)
|
Fusarium spp. (Ciruela Mexicana) |
||||
|
Crecimiento
micelial (mm) |
Esporulación
(esporas/
mL) |
Germinación (%) |
Crecimiento
micelial (mm) |
Esporulación
(esporas/
mL) |
Germinación (%) |
|
|
Acuoso: 12 25 50 |
31,0
a* (4.9)1 |
1,2
x 107 b* 1,5
x 1,2
x 107 b |
47,0
c* 47,0
c 9,0
d |
32,4
ab* (8.6)2 33,0
ab (9.0) 31,0
b (9.2) |
3,31x
106 b* 3,6
x 106 b 4,3
x |
77,1
ab* 65,3
bc 50,2
c |
|
Metanólico: 12 25 50 |
20,4
b (4.7) 16,2
e (3.2) 5,0
e (1.4) |
4,6
x 106 d 1,9
x 106 e 2,6
x |
71,0
ab 81,0
ab |
22,3
d (6.0) 22,1
d (5.9) |
2,5
x 106 c 2,5
x 106 c 1,1
x 106 fg |
80,0
ab 82,0
ab |
|
Acetónico: 12 25 50 |
16,5
bcd (3.5) 14,8
cde (3.2) 11,5
cde (3.7) |
2,2
x 106 e 5,6
x 106 c 4,3
x 106 d |
67,0
ab 69,0
ab 77,0
ab |
25,1
cd (7.0) 22,8
cd (6.5) 16,3
e (3.7) |
9,6
x 1,4
x 105 ef 9,2
x |
|
|
Testigos: |
|
|
|
|
|
|
|
Metanol: 12 25 50 |
18,9
bc (4.5) 10,8
e (2.7) |
3,9
x 106d 2,0
x 106e 2,8
x |
19,0
d |
26,9
c (7.7) 16,7
e (4.3) 5,3
fg (1.8) |
2,8
x 106 c 2,5
x 106 c 1,2
x 106 fg |
82,0
ab 82,0
ab 82,0
ab |
|
Acetona: 12 25 50 |
17,9
bc (4.7) 10,1
e (2.6) 11,0
e (3.9) |
9,1
x 2,4
x 106e 2,5
x 106e |
70,0
ab 73,0
ab 69,0ab |
27,1
c (7.8) 18,6
e (5.8) |
1,9
x 106 d 1,7
x 106 de 1,2
x 106 fg |
82,0
ab 81,0
ab |
|
PDA |
|
4,6
x 106d |
63,0b |
|
1,9
x 106 d |
69,0
ab |
|
* Letras
iguales indican similitud estadística con la prueba DMS (p ≤ 0,05). Valores entre
paréntesis indican la tasa de crecimiento (mm d-1) durante el período de incubación de 151 y 102
días. |
||||||
Tratamientos con extractos de diclorometano,
CMA y etanólicos de hojas de C. nocturnum
Para ambos aislamientos, se
observaron diferencias significativas (p ≤ 0,05) entre los tratamientos
en relación al crecimiento micelial y esporulación
(Cuadro 3). En el medio PDA con el extracto etanólico
a la concentración de 50 mg mL-1 (
|
Cuadro 3. Crecimiento micelial,
esporulación y germinación de Fusarium
spp. aislado de papaya (Carica papaya) y ciruela
mexicana (Spondias purpurea)
incubadas en medio PDA con diferentes concentraciones de extractos de diclorometano, cloroformo-metanol-agua (CMA) y etanólicos no esterilizados de hojas de Cestrum nocturnum. |
||||||
|
Extractos mg
mL-1 |
Fusarium spp. (Papaya) |
Fusarium spp. (Ciruela mexicana) |
||||
|
Crecimiento
micelial (mm) |
Esporulación
(esporas/mL) |
Germinación (%) |
Crecimiento
micelial (mm) |
Esporulación
(esporas/mL) |
Germinación (%) |
|
|
Diclorometano: 12 25 50 |
25,0
a* (6.3)1 20,7
abc (3.6) 6,2
ef (1.6) |
4,7
x 106 b* 4,3
x 106 bc 3,1
x 106 cde |
70,0
a* |
22,1
bcde* (12.0)2 22,0
bcde (11.2) 13,7
h (7.0) |
3,1
x 106 hg 4,3
x 106 ef 6,4
x 106 b |
83,0
a* |
|
CMA: 12 25 50 |
23,0
ab (4.9) |
3,9
x 106 bcd 6,4
x 6,3
x |
|
27,0
b (12.6) 22,5
bcde (10.0) 19,9
def (10.1) |
3,5
x 106 hg 2,2
x 106 i 2,9
x 106 hi |
|
|
Etanólico: 12 25 50 |
17,5
bc (4.7) 11,3
de (2.8) 2,0
fg (0.3) |
3,5
x 105 h 2,3
x 105 h 1,1
x 105 h |
|
16,1
gh 8.3 2,1
j (1.7) 0,0
j |
1,2
x 106 j 3,3
x 105 k 1,4
x 105 k |
|
|
Testigos: |
|
|
|
|
|
|
|
Diclorometano: 12 25 50 |
21,8
ab (5.3) 20,6
abc (5.4) 22,6
ab (6.0) |
3,3 x 106 cde 1,6 x 106 fg 1,1 x 106 hg |
|
24,1
bcd (11.6) 24,7
bc (12.0) 7,1
i (3.5) |
3,8
x 106 fg 4,9
x 106 de 5,8
x 105 jk |
|
|
CMA: 12 25 50 |
23,2
ab (5.8) 15,6
cd (2.9) |
3,1
x 106 ed 3,1
x 106 ed 2,6
x 106 ef |
|
25,5
b (12.0) 20,3
cdef (10.0) 19,2
efg (9.5) |
5,9
x 106 bc 5,2
x 106 cd 9,5
x |
|
|
Etanol: 12 25 50 |
22,1
ab (6.1) 15,6
cd (4.3) |
1.1 x 106 hg 4,6
x 105 hg 7,5
x 104 h |
|
14,8
gh (7.4) 1,4
j (1.4) 0,0
j |
1.2 x 106 j 4,1
x 105 k 1,7
x 105 k |
|
|
PDA |
|
4,1
x 106 bc |
63,0
b |
|
1,9
x 106 i |
69,0
b |
|
*Letras iguales indican similitud estadística con la
prueba DMS (p ≤ 0,05). Valores entre paréntesis indican la tasa de
crecimiento (mm d-1) durante el período
de incubación 151 y 102 días. |
||||||
DISCUSIÓN
En la presente
investigación se evaluó el potencial fungicida de extractos y fracciones de C. nocturnum sobre
dos aislamientos de Fusarium (papaya
y ciruela) obtenidos con disolventes de diferente polaridad mediante CCF y
cromatografía en columna. La mayor cantidad de extracto se obtuvo con el agua
debido probablemente a la baja volatilidad del agua, efecto contrario se
observó con la acetona donde se obtuvo la menor cantidad de extracto ya que
éste posee una alta volatilidad. Asimismo, se observó que en los extractos
esterilizados independientemente del disolvente utilizado, a mayor tiempo de
extracción (48 h) se obtuvo menor cantidad de extracto indicando que existe un
tiempo de saturación del extracto en el disolvente. Por otro lado, se observó
que el número de manchas extraídas mediante CCF varío según el disolvente
utilizado, el tiempo de extracción y el tratamiento esterilizado o sin
esterilizar.
En esta investigación también se evaluó la actividad
fungicida de polvos y extractos de la especie botánica C. nocturnum en el desarrollo in vitro de Fusarium. En general, la respuesta a los polvos y extractos fue
diferente en cada aislamiento. Al parecer en el aislamiento de ciruela
mexicana, la respuesta fungicida a los polvos se manifestó más en el desarrollo
micelial que en la esporulación o germinación ya que
en el aislamiento de ciruela mexicana se observó que todos los tratamientos
inhibieron su crecimiento. Coincidiendo parcialmente con estos resultados, con
lo reportado por Bravo-Luna et al. (1997) quienes mencionan la
inhibición Fusarium moniliforme con
polvos de esta especie botánica hasta en un 68%. Sin embargo
en este estudio, la esporulación y germinación de ambos aislamientos no se
inhibió por efecto de los polvos, observándose una considerable estimulación en
estas dos variables evaluadas. Una
posible explicación es que los hongos en su mayoría cuando se someten a un
estrés promueven la formación de más esporas ya que éstas se consideran
estructuras de ‘sobrevivencia’ del hongo, de aquí que tengan la capacidad de
mantenerse en estado latente (sin germinar) en un medio ambiente adverso como
bajas temperaturas, sequías etc. En esta investigación, los
extractos que presentaron mayor actividad antifúngica
fueron el metanólico seguido por el etanólico. El primero redujo el crecimiento micelial de ambos aislamientos y la esporulación del
aislamiento de papaya, mientras que el segundo inhibió la esporulación de ambos
aislamientos. En otros estudios de identificación de compuestos aromáticos de C.
nocturnum el disolvente utilizado fue el metanol
obteniendo compuestos del grupo de las saponinas y flavonoides, los cuales a su
vez pudieran estar ejerciendo la actividad antifúngica
aquí reportada (Mimaki et al., 2001; 2002). En
esta investigación el extracto acuoso de C. nocturnum
independientemente de la concentración inhibió la germinación del aislamiento
de papaya. En otros estudios no se reporta el efecto de esta especie sobre la
germinación, sin embargo, se hace hincapié en la actividad fungicida de estos
extractos sobre el crecimiento micelial de R. stolonifer. Cabe mencionar que la metodología de
obtención y concentraciones utilizadas fueron diferentes a la de nuestra investigación
(Rodríguez, 2004). En este estudio se
pudo observar que el efecto de los extractos varió según la etapa de desarrollo
del hongo, es decir que en algunos casos su efecto se manifestó más sobre el
crecimiento micelial, esporulación o germinación. Sin
embargo, cualquiera de los estados antes mencionados es importante de inhibir
ya que en cualquiera de ellos el hongo puede ocasionar daños severos al
producto agrícola. Se sigue proponiendo la identificación de grupos de
compuestos activos y su evaluación fungicida sobre Fusarium.
LITERATURA CITADA
Barnett, H. L. and B. B. Hunter. 1972. Illustrated Genera of Imperfect
Fungi. Third. Edution. Burgess Publishing Co. Minneapolis, Minnesota, USA. 241 p.
Bravo, L. L.; T. K. Bermúdez y B. R.
Montes. 1997. Identificación de alcaloides de Cestrum
nocturnum y su efecto sobre crecimiento y
esporulación de Fusarium moniliforme. Memorias del VI Congreso Nacional
de Micología. IX Jornadas Científicas. Tapachula, Chiapas, México. Resumen,
p.35.
Bravo, L. L.; T. K. Bermúdez y B. R.
Montes. 2000. Inhibición de Fusarium monoliforme mediante
polvos vegetales y algunos de sus componentes químicos. Manejo Integrado de
Plagas 57:29-34.
Bunezgo, R. M. T.; A. N. León, G. M. Acevedo, V. M. Llanio,
P. M. D. Fernández y H. Pérez Saad. 1997. Perfil neurofarmacológico del Cestrum nocturnum L. (galán de noche). Revista
Cubana Planta Médica 2:30-34.
Eloff J. N. 1998. Which extractant
should be used for the screening and isolation of antimicrobial components from
plants. Journal of Ethnopharmacology 60:1-8.
Grainge, M. and S. Ahmed, S. 1988. Handbook of plants
with pest-control properties. John Wiley and Sons, New York, USA. 470 p.
Hernández,
A. R. 2004. Evaluación del potencial antifúngico de extractos
vegetales crudos en la germinación de esporas de Colletotrichum gloeosporioides
(Penz.) Sacc. Tesis de
Maestría. Centro de Desarrollo de Productos Bióticos- Instituto Politécnico
Nacional. Yautepec, Morelos. México.174 p.
Hernández, A. R.; L. L. Bravo, S.
Bautista B. y N. L. Barrera. 2005. Actividad antifúngica
de extractos vegetales en hongos postcosecha. Revista
BIOTICA 2:115-155.
Martínez,
M. 1990. Las plantas medicinales de México. Ed. Botas. México, D. F. 656 p.
Martínez, M.
1994. Catálogo de nombres vulgares y científicos de plantas
mexicanas. Tercera reimpresión. Fondo de cultura económica. México, D. F. 1247
p.
Mimaki, Y.; K. Watanabe, H. Sakagami and Y. Sashida. 2001. Flavonol
glycosides and steroidal saponins from the leaves of Cestrum nocturnum
and their cytotoxicity. Journal of Natural Products 64: 17-22.
Mimaki, Y.; K. Watanabe, H. Sakagami and Y. Sashida. 2002. Steroidal Glycosides from the leaves of Cestrum nocturnum.
Journal of Natural Products 65: 1863-1868.
Nelson, P.
E. ; T. A. Tousson and W. F. O. Marasas. 1983. Fusarium species. An illustrated
manual for identification. Pennsylvania State University Press. Pennsylvania,
USA. 357 p.
Rodríguez,
O. N. 2004. Empleo de productos naturales como agentes inductores de
resistencia en el control de microorganismos postcosecha
en productos hortofrutícolas. Reporte de Prácticas Profesionales. Centro de
Desarrollo de Productos Bióticos-Instituto Politécnico Nacional. Yautepec,
Morelos, México. 33 p.
Snowdon, A. L.
Página diseñada por Prof. Jesús Rafael Méndez Natera
TABLA DE CONTENIDO DE LA REVISTA CIENTÍFICA UDO
AGRÍCOLA


