Revista Científica UDO Agrícola Volumen 7.
Número 1. Año 2007. Páginas: 1-14
Desempeño funcional del boro en las plantas
Functional
performance of boron in plants
Auristela del Carmen MALAVÉ ACUÑA![]() 1 y Pablo Eligio CARRERO MOLINA2
1 y Pablo Eligio CARRERO MOLINA2
1Postgrado
en Agricultura Tropical, Campus Juanico,
Universidad de Oriente. Núcleo de Monagas, Maturín-Estado Monagas, 6201.
Venezuela e 2Instituto Venezolano Andino
de Investigaciones Químicas (IVAIQUIM). Departamento de Química, Universidad de
Los Andes, Mérida 5101-A. Venezuela. Emails: auris@ula.ve
y pcarrero@ula.ve ![]() Autor para correspondencia
Autor para correspondencia
|
Recibido: 05/11/2007 |
Fin
de primer arbitraje: 04/12/2007 |
Primera
revisión recibida: 12/12/2007 |
|
Fin de segundo arbitraje: 19/12/2007 |
Segunda revisión
recibida: 23/12/2007 |
Aceptado: 26/12/2007 |
RESUMEN
A
pesar de que hace nueve décadas desde que se demostró la esencialidad del boro
(B) para el normal crecimiento de las plantas, hasta ahora su rol bioquímico aún
no está bien definido. El B es un importante micronutrimento
con un difícil manejo debido a que su movilidad en el floema varía marcadamente
entre las especies vegetales con síntomas de deficiencia y toxicidad en un
rango bastante estrecho. Durante los
últimos años numerosas investigaciones han contribuido a mejorar la comprensión
acerca del rol del B en las plantas. Las recientes revisiones proponen que este
elemento está involucrado en tres procesos principales que incluyen:
preservación de la estructura de la pared celular, mantenimiento de las
funciones de la membrana y cofactor de las actividades metabólicas. Sin
embargo, debido a la ausencia de evidencias concluyentes, su rol primario en
las plantas aún no está claro. El aislamiento y caracterización del complejo
polisacárido-B a partir de las paredes celulares proporcionó evidencia directa
para los eslabones cruzados de B en los polímeros de la pectina y confirmó in vivo su rol en la arquitectura de la
pared celular. Hasta ahora, las evidencias han indicado que la esencialidad del
boro en las plantas está relacionada con su capacidad para formar puentes diésteres con grupos cis-diol
para producir moléculas estables como el complejo B-ramnogalacturonano
II fundamental en la estructura de la pared celular. Esta revisión ayuda a
sintetizar los más recientes avances en cuanto al rol funcional del B en el
reino vegetal para un mejor entendimiento de su comportamiento fundamental e
impacto directo sobre su manejo en los sistemas agrícolas.
Palabras claves: Boro, nutrición mineral, fisiología de cultivos
ABSTRACT
In spite of it is now nine decades
since boron (B) was demonstrated to
be essential for normal growth of plants, its biochemical role is not well
understood at the moment. B is an important
micronutrient with a difficult management because of its phloem mobility varies
dramatically among vegetable species with deficiency and toxicity symptoms in a quite narrow range. Several new and
exciting researches during the past few years greatly contributed to better
understanding about B role in plants. Recent reviews propose that it is
involved in three main processes that include: keeping cell wall structure,
maintaining membrane functions, and supporting metabolic activities. However,
because of the absence of conclusive evidence, its primary role in plants is
still undefined. Isolation and characterization of the B-polysaccharide complex
from cell walls provided direct evidence for B crosslinking of pectin polymers,
and confirmed in vivo its role in
cell wall architecture. At the present time, the evidences have indicated that
the B essentiality in plants is related with its ability to form diester bridges with cis-diol
groups to yield stable molecules as the complex B-ramnogalacturonan
II fundamental in the cell wall structure. This review aims to summarize the
most recent advances about B functional role into vegetal kingdom to a better
understand of its fundamental behavior and direct impact on its management in
agricultural systems.
Key
words: Boron, mineral nutrition, crop physiology
INTRODUCCIÓN
El boro (B) es un elemento con
propiedades intermedias entre los metales y no metales, es decir un metaloide,
ampliamente utilizado como semiconductor en la elaboración de una gran variedad
de materiales (Hovanski et al, 2007; Liu et
al, 2007; Weber y Tavanga, 2007; y
Zhou et
al, 2007). Adicionalmente, muchos de sus compuestos son
usados con fines clínicos en terapias para el tratamiento de diferentes tipos de
cáncer (Chandra y Loret,
2007; Conti et al, 2007; Kankaanranta et al, 2007; Matsumoto,
2007; Nakamura et
al, 2007; Yanagie et al, 2007), como preservativo en el tratamiento de madera (Aydin y Colakoglu, 2007; Dhamodaran y Gnanaharan, 2007; Kartal et al, 2007) y en baterías (Xue et al, 2007).
En los últimos años gran cantidad
de evidencia indica la importancia del B como elemento esencial o beneficioso
en una gran variedad de organismos incluyendo humanos (Samman
et al, 1998; Fort et al, 1999; Rowe
y Eckhert, 1999; Armstrong et al, 2000; Nielsen, 2000; Miller y Bassler, 2001; Ralston y Hunt, 2001; Chen et al, 2002; Hunt,
2002, 2003; Moore y Hertweck, 2002; Newnham, 2002; Bakken y Hunt, 2003; Park et
al, 2004, 2005; Pawa y Ali,
2006; Goldbach y Wimmer,
2007). Algunos estudios epidemiológicos
indican que hay una relación inversa entre el consumo de B y el riesgo de
desarrollar cáncer de próstata sugiriendo que cada célula expresa su capacidad
particular para el transporte de las biomoléculas de
borato (Barranco y Eckhert,
2004; Cui et al, 2004). Existen laboratorios expendedores de
diferentes antibióticos a base de B, de los cuales el boromicin
tiene aplicación en el control del virus de inmunodeficiencia adquirida, más
conocido como SIDA, (Kohno et al, 1996).
A pesar de que está muy bien
establecida la esencialidad del B como micronutrimento
para todas las plantas vasculares en la obtención de altas y buenas
producciones de calidad en las prácticas agrícolas, el conocimiento acerca de
sus funciones metabólicas en los vegetales aún permanece incompleto. Algunas investigaciones han ayudado a mejorar
grandemente el entendimiento de algunos procesos en las plantas en cuanto a su
consumo y transporte (Brown y Shelp, 1997; Hu y Brown, 1997; Brown et
al, 2002; Takano et al, 2002, 2005a,b, 2006), formación de la pared celular (Matoh, 1997; O`Nelly et al, 2004), funciones de la membrana
celular (Goldbach et
al, 2001) y de defensa antioxidativa (Cakmak y Römheld, 1997). El presente trabajo tiene como finalidad dar a
conocer los más recientes hallazgos en cuanto a los procesos involucrados en
las diferentes funciones desempeñadas por el B en las plantas para una mejor
comprensión de su comportamiento en cuanto a su manejo en los sistemas de
producción agrícola.
Capacidad del boro
para formar biomoléculas
El átomo de B es de los más
pequeños, con sólo tres electrones de valencia, lo que le confiere una
deficiencia de electrones que lo destacan, después del átomo de carbono, con
una de las químicas más interesantes y diversas hasta ahora estudiadas (Greenwood y Earnshaw, 1984; Rodgers, 1995; Power
y Word, 1997; WHO, 1998, Malavé Acuña, 2005).
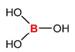
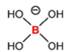
En la mayoría de los fluidos biológicos, el B existe principalmente como
ácido bórico, B(OH)3 (» 96%), y una pequeña cantidad del
anión borato, B(OH)4-, de acuerdo al equilibrio de
disociación:
B(OH)3
+ H2O D B(OH)4- + H+
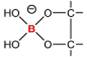
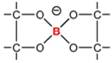
Debido a la tan
llamada deficiencia de electrones del B, ambas especies reaccionan rápidamente para
formar complejos con una variedad de azúcares y otros compuestos que contienen
grupos cis-diol, generando ésteres de boratos
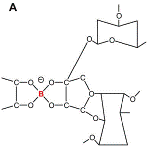
cíclicos estables (Figura 1, A-D), sugiriéndose que la clave de la esencialidad
del B radica en la estabilización de moléculas de importancia biológica en
diferentes organismos (Bolaños et al,
2004a), lo cual está aún en debate (Goldbach y Wimmer, 2007).
|
A
|
B
|
|
C
|
D
|
|
Figura 1. Estructuras químicas: A) ácido bórico, B) anión
borato, C) complejo monoborato, D) complejo bis(diol) borato. |
|
Sobre la base de la
mayor estabilidad de los borato di-ésteres en sistemas acuosos y de la
distribución de sitios de enlace cis-diol en células,
es más probable que en estas moléculas el B juegue funciones metabólicas más
relevantes de lo que lo haría en moléculas mono-ésteres, cuya formación es
menos favorecida debido a las condiciones químicas en sistemas vivientes más
apropiadas para la generación de moléculas suficientemente estables como los
di-ésteres (Goldbach y Wimmer,
2007). Diferentes estudios han logrado
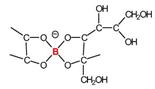
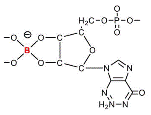
identificar algunas moléculas de importancia biológica ricas en grupos cis-diol libres ideales para la formación de boratos, cuyas
estructuras están representadas en la Figura 2, A-F (Bolaños et al, 2004a).
La primera molécula
enlazada por borato identificada en el reino de las plantas es la ramnogalacturonano II (RGII), un componente péctico de la pared celular estable en condiciones
fisiológicas, la cual es un dímero donde el B une dos monómeros de RGII a
través de un puente borato (Fig. 2-A) para proporcionar estabilidad a la matriz
de la pared celular (O`Neill et al,
2004).
|
|
|
|
|
|
|
|
|
Figura
2. Estructuras de biomoléculas enlazadas a boro: A)
complejo B-ramnogalacturonano II en la pared celular
de las plantas, B) molécula de señal bacterial quórum sensing autoinductor
AI- |
||
El boro en la pared celular
La pared celular es fundamental en la determinación del
crecimiento y desarrollo de la célula vegetal, que involucra una dinámica y continua
modificación durante la diferenciación celular (Pérez-Almeida y Carpita,
2006). De acuerdo con Taiz y Zeiger (1991), la pared
primaria de plantas dicotiledóneas normalmente está compuesta de un 25–30% de
celulosa, de un 15–25% de hemicelulosa, de un 35% de
pectina y de un 5–10% de proteínas; donde las microfibrillas
de celulosa se disponen formando un entramado embebido en una matriz amorfa
formada por hemicelulosa, pectinas y proteínas. En esta compleja estructura, mientras las microfibrillas sirven para soportar las tensiones ejercidas
sobre la célula (Niklas, 1992) y dirigir su
crecimiento (Darley et al., 2001), la matriz controla la rigidez y grosor de la pared; en tanto que, la hemicelulosa sirve como puente de unión entre las microfibrillas de celulosa lo que facilita su interacción
con el gel formado por las pectinas. Las
proteínas presentes en la pared, ricas en prolina e hidróxiprolina, además de funcionar como un andamio donde se disponen los
polisacáridos integrantes de la pared, también regulan las interacciones de las
pectinas y hemicelulosa con la celulosa,
debilitándolas durante el crecimiento celular (Redondo Nieto et al., 2007). La matriz péctica es una mezcla compleja de homogalacturonano
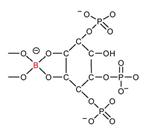
(HG) y polímeros de RGI y RGII, donde el boro participa como un puente borato
en la formación del dímero B-RGII componente fundamental en la arquitectura de
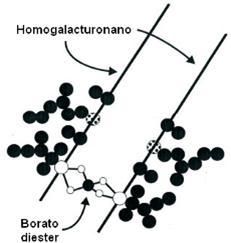
la pared celular (Figura 3).
|
|
|
Figura 3. Estructura del
dímero B-RGII mostrando el puente borato entre los residuos apiosil de cada monómero homogalacturonano. Adaptado de O`Neill et al (2001) y Reuhs et al (2004), (Goldbach
y Wimmer, 2007). |
Hasta la fecha son muchas
las evidencias que enfatizan el rol estructural del B en la pared celular de
las plantas superiores soportadas a través de diversas revisiones (Goldbach y Wimmer, 2007). Debido a que las briofitas no vasculares contienen sólo alrededor del 1%
de la cantidad de RGII de las especies de plantas vasculares y que la cantidad
de RGII en la pared celular se incrementó durante la evolución de las plantas
vasculares (Matsunaga et al, 2004); es probable que exista una estrecha relación entre la
formación del borato de RGII y la evolución de la tierra. Consecuentemente, el
desarrollo de la dependencia del B durante la evolución puede también
correlacionarse con el desarrollo y lignificado de las paredes
secundarias. Adicionalmente, la
estructura altamente concentrada del complejo B-RGII (Figura 3) y el hecho de
que sus genes aparecieron durante las etapas tempranas de la evolución de las
plantas terrestres, señalan a
Diversos experimentos
han sido direccionados a determinar los efectos estructurales de la pared al
inducir pequeños cambios a nivel molecular dentro de la estructura del complejo
B-RGII (Figura 3). Reuhs
et al., (2004), observaron una
reducción del crecimiento y malformación de las plantas al reemplazar
parcialmente fragmentos de L-fucosil por L-galactosil en xiloglucanos y en
RGII del mutante mur1 de Arabidopsis thaliana;
mientras que en otro experimento conducido por Ryden et al., (2003), se observó una reducción
en la resistencia de tensión al compararla con la planta del tipo
silvestre. El hecho de que las plantas
pudieron ser rescatadas totalmente con más altos niveles de B en el hipocotíleo
y pecíolo, demostró que la carencia de fucosa en RGII
más que en xiloglucan es de importancia para el
fenotipo. Estas observaciones, entre
otras (Goldbach y Wimmer,
2007), resaltan la gran contribución de
las pectinas como moléculas de adhesión (Lord y Mollet,
2002), cuyo rol es alterado, afectando así la estructura de la pared celular
cuando no tiene lugar la dimerización de
El boro en la membrana
Son amplios los
estudios que han demostrado la importancia del B para la completa
funcionabilidad de los diferentes procesos a nivel celular en las plantas,
donde participan una diversidad de enzimas y otras proteínas plasmáticas,
además de los procesos de transporte a través de la membrana y de su integridad
(Cakman y Römheld, 1997; Goldbach et al,
2001; Brown et al, 2002). De acuerdo con estudios realizados, se
encontró que la deficiencia de B altera el potencial de la membrana (Blaser-Grill et al,
1989), reduce la actividad de
Algunos autores han
propuesto que la participación directa del B en el mantenimiento de la
integridad de la membrana probablemente tiene lugar mediante la complejación cis-diol con
glicoproteínas, las cuales son constituyentes estructurales de la membrana
plasmática (Goldbach et al, 2001; Brown et al,
2002). Algunos efectos de deficiencia
del elemento, que lo señalan como fundamental en la estabilización de la
membrana, incluyen: alteración de permeabilidad por potasio y azúcares (Parr y Loughman, 1983; Goldbach, 1985; Cakmak et al, 1995; Wang et al, 1999), daño de la membrana peribacteroide
en nódulos (Bolaños et al, 1994) o un
cambio en los niveles de calcio enlazado a la membrana (Mühling
et al, 1998; Wimmer
y Goldbach, 1999), lo cual puede ser corregido por un
suministro de calcio en cianobacterias compensando así las reacciones de
deficiencia de B (Bolaños et al,
1993).
El desempeño del B y
su importancia para los organismos fijadores de nitrógeno, así como su
esencialidad en el establecimiento del sistema simbiótico Rhizobium-leguminosas ha sido
revisado extensivamente (Bolaños et al,
2004a). El rol del B en la señalización bacterial se reveló recientemente con el descubrimiento del
autoinductor AI-2 (Chen et al, 2002), una nueva molécula de
señal bacterial “quórum sensing”,
tanto en estructura como en función, identificada como un borato diéster furanosil (Figura 2-B). Como producto de la señalización molecular,
mediada por planta-bacteria, se originan glicoconjugados
en su mayoría ricos en grupos cis-diol con una
subsecuente integración física y metabólica rhizobia/células
hospederas que se vuelve progresivamente más intima (Kannemberg y Brewin, 1994). Una vez que el Rhizobium está dentro de la
célula el B promueve a los bacteroides a fijar el
nitrógeno; siendo el elemento necesario para el correcto enfoque de las
glicoproteínas derivadas de un nódulo específico de la planta (Bolaños et al, 2001), que son cruciales como
señales para la diferenciación de bacteroides dentro
de una forma de fijación de nitrógeno (Bolaños et al, 2004b). Se ha
indicado la posibilidad de que el autoinductor AI-2
(Fig. 2-B) podría servir no sólo como una señal bacterial
universal para comunicación entre especies (Chen et al, 2002; Winans,
2002), sino también como un transportador de B hacia dentro y fuera de la
célula dependiendo del crecimiento o condiciones ambientales (Coulthurst et al,
2002).
Por otro lado, Verstraeten et al
(2005) sugieren que a nivel celular el B interacciona con fosfolípidos cargados
negativamente o con aquellos que contienen residuos de azúcares móviles, tal
como el residuo apiosa
donde se establece el puente borato en el dímero RGII (Fig. 2-A y 3). En este caso los autores mostraron la
interacción B con la bicapa lipídica usando concentraciones tan bajas como 0,5 mM de ácido bórico, determinándose así la magnitud y
dirección de los efectos del elemento y su posible rol en el mantenimiento reológico de la membrana al modular la hidratación y
fluidez de las bicapas lipídicas. No
obstante, aún se requieren evidencias de esta función modular que podría ser
distribuida por igual tanto en animales como en vegetales (Goldbach
y Wimmer, 2007).
El hecho de que las actividades enzimáticas relacionadas con enlaces a plasmalemas respondan marcadamente rápido (desde minutos a
una hora) a los cambios en el suministro de B, señala, al menos en parte, un
control post-transcripcional y post-translacional regulado por el nivel del elemento. Así mismo, otra evidencia para un control
post-translacional de proteínas enlazadas a plasmolemas radica en la observación de que el
transportador de B de Arabidopsis thaliana
(AtBOR1-1) está regulado por el nivel de B (Takano et al, 2005a). Adicionalmente, el normal funcionamiento de
la membrana también puede ser afectado por la acumulación de radicales libres
oxidativos (incluyendo la especie ·OH) en las células, siendo ésta una de las consecuencias
indirectas de deficiencia de B en las células de la raíz y de las hojas (Cakmak y Römheld, 1997) que puede
ser sobrellevado, incluso en células animales, incrementando los niveles de B (Pawa y Ali, 2006). Una probable respuesta secundaria producto de
los radicales ·OH es el cierre reversible de los canales de agua de
la membrana plasmática (Henzler et al, 2004), lo cual está en línea con los hallazgos de Yu et al. (2002)
en raíces de tabaco.
Otros procesos implicados en la relación B-planta a nivel
celular
Algunos estudios han
demostrado que la deficiencia de B afecta el proceso de fotosíntesis en las
plantas; sin embargo, es necesario destacar que la evidencia existente hasta
ahora, en su mayoría, se obtuvo a partir de experimentos in vivo con tratamientos bastante distantes (10 días o más) en
plantas con un deficiente suministro del micronutrimento
(Kastori et al,
1995; El-Shintinawy, 1999). Los mecanismos primarios del desempeño del B
en la fotosíntesis no se conocen, pero podría afectar las funciones a nivel de
las membranas cloroplásticas por interrupción del
transporte de electrones y del gradiente de energía a través de la membrana
resultando en una fotoinhibición (Goldbach
y Wimmer, 2007).
Otros estudios indican
la existencia de una estrecha relación entre el B y el Ca donde ambos co-actúan a nivel de la membrana celular por interacciones
aún desconocidas (Bolaños et al,
2004a). En este aspecto, las evidencias
obtenidas a partir de diferentes investigaciones señalan que esta relación es
un factor determinante en la expresión genética (Redondo-Nieto, 2002;
Redondo-Nieto et al, 2002), además de
que la participación del Ca es importante en la estabilización de los complejos
de B (Mühling et
al, 1998; Kobayashi et al, 1999; Wimmer y Goldbach,
1999). Adicionalmente, el Ca reduce los
efectos de la deficiencia de B en el desarrollo de los nódulos (Redondo-Nieto et al, 2003) incluso bajo estrés salino
(El-Hamdaoui et
al, 2003a; 2003b).
Recientemente se
revisaron los efectos que la interacción entre el B y las bajas temperaturas
produce en especies de clima tropical, particularmente en cuanto a las
funciones de la raíz, uso del agua en el tallo y consumo y utilización del B en
estos tipos de plantas (Huang et al, 2005). Es un desafío
seguir más de cerca las posibles interacciones entre el suministro de B y el
posterior estrés originado tanto al frío (Ye et al, 2000, 2003) como a la salinidad (Wimmer
et al, 2005), cuyos efectos parecen
ser aditivos (Ye et al, 2000, 2003),
permaneciendo aún con dudas los procesos y reacciones involucrados en la
tolerancia de las plantas a ambos estreses (Goldbach
y Wimmer, 2007).
Dordas y Brown (2000), demostraron que las
diferentes proporciones de esteroles y ácidos grasos de cadenas más largas en
la membrana plasmática de células de raíz cambia significativamente el consumo
de B en mutantes de Arabidopsis thaliana y
relacionaron estos cambios a diferentes coeficientes de permeabilidad para el
ácido bórico a través de membranas plasmáticas que contienen diferentes grupos
de lípidos y ácidos grasos. Así, el
descenso del nivel de esteroles en la membrana plasmática puede incrementar su
fluidez y permeabilidad al agua y a iones, lo cual está correlacionado con la
tolerancia de la planta al frío (Hugly et al, 1990), siendo una respuesta común
el incremento de la rigidez en la membrana en especies susceptibles a las bajas
temperaturas tales como las de café, Coffea arabica L., (Queiroz et al, 1998). Como resultado, la reducción inducida por el
frío en la fluidez y permeabilidad en la membrana de células de raíz, puede
también contribuir a la inhibición del consumo de B en especies susceptibles al
frío (Ye et al, 2000, 2003). Adicionalmente, los requerimientos internos
de B en las células de hojas también pueden sufrir cambios bajo condiciones de
estrés debido a la alteración de sus niveles de antioxidante (Cakmak y Römhel, 1997). Asimismo, Huang et al. (2005) señalaron que la
coincidencia de un bajo suministro de B junto con frío (u otro estrés) puede
exceder la capacidad de las células para hacer frente a una excesiva producción
de especies de oxígeno reactivas.
La pérdida de agua
inducida por el frío es una de las más significativas consecuencias
fisiológicas resultantes de una reducida conductancia hidráulica de la raíz y
de una transpiración excesiva debido a un descontrol estomático en cuanto a un
retardo o falla de cierre (Allen y Ort, 2001), lo que
además tendría un impacto negativo en el suministro de B a los sitios de
crecimiento debido a un limitado consumo y transporte del elemento desde la
raíz hacia el resto de la planta.
Considerando que la deficiencia de B incrementa la acumulación de
radicales libres oxidativos (·OH) (Cakmak y Römhel, 1997), los cuales influyen en el cierre reversible
de ciertas acuaporinas (Henzler
et al, 2004), se puede entonces decir
que la deficiencia inducida de B, al reducir el flujo de agua a través de las acuaporinas, puede añadir un elemento más a tener en cuenta
en el manejo de los sistemas agrícolas sujetos a condiciones tanto de frío como
de sequía.
Aspectos y perspectivas resaltantes del rol funcional
del boro en las plantas
Se ha hipotetizado que el rol primario del B en todo sistema
consiste en estabilizar moléculas de importancia biológica mediante la
formación de puentes diésteres con grupos cis-diol independientemente de la función de cada una de
ellas (Bolaños et al, 2004a). Esta capacidad particular del átomo de B
radica en su química, la cual no sería posible para otros átomos tales como
fósforo o azufre, que aunque puedan formar uniones a través de puentes diésteres, la estructura molecular resultante sería
inestable debido a una densidad electrónica marcadamente grande propia de los
átomos más pesados.
A pesar de que hoy esta bien documentada la importancia del B como elemento de
unión en la formación del dímero ramnogalacturonano
II (RGII), componente estructural de la fracción péctica
fundamental en el ensamblaje de la pared celular de las plantas, sus funciones
en la membrana plasmática han sido postuladas sólo en base a un gran número de
observaciones cuyos mecanismos aún son tema de especulación (Goldbach, 1997; Blevins y Lukaszewski, 1998; Brown et al, 2002; Bolaños et al,
2004a; Goldbach y Wimmer,
2007). Al parecer, la presencia de
moléculas aceptoras específicas capaces de formar
complejos con el par ácido bórico/borato, son indispensables en la existencia
de cualquier rol funcional desempeñado por el B. Así, el B puede formar complejos borato con
una variedad de moléculas que contengan ligandos hidroxilados tales como serina o treonina, además de fragmentos de azúcares como manosa, apiosa o galactosa entre
otros (Ralston y Hunt,
2000); siendo las glicoproteínas y glicolípidos
buenos candidatos para una posible función del B en las membranas. En cuanto a esto, se ha reportado un número
de estructuras específicas de interés, que incluyen proteínas enlazadas o que forman parte de la
membrana, que están probablemente relacionadas con procesos dependientes del B
a nivel celular como crecimiento, diferenciación y percepción cuyos mecanismos aún permanecen sin aclarar (Kohorn, 2000). La
mayoría de estas estructuras enlazadas a la membrana pueden contener residuos
de manosa o fosfatidil-inositol,
los cuales son posibles ligandos para B con una
capacidad de enlace fuerte (Ralston y Hunt, 2000). De este
modo, la proporción de proteínas libres y unidas a la membrana puede cambiar
bajo una deficiencia de B con consecuencias que pueden incluir más bajos
contenidos de proteínas ricas en hidróxiprolina en la
pared celular de Phaseolus vulgaris
(Bonilla et al, 1997). Existe una notable coincidencia entre muchos
procesos sujetos a los arabinogalactán-proteína (AGP)
y su dependencia en el suministro de B que involucran diferenciación del xilema
(Stacey et al,
1995) y crecimiento del tubo de polen (Majewska-Sawka
y Nothnagel, 2000).
Las proteínas ancla de glicosil-fosfatidilinositol
(GPI) son componentes de los transportadores de membrana con funciones
específicas, ricas en esfingolípidos y colesterol e
insolubles en detergentes no iónicos (Brown y London, 2000). Estos transportadores requieren del B debido
a su rol específico tanto en su formación como en su estabilización mediante la
posible formación de complejos bis-borato con residuos de manosa
(Brown et al, 2002).
Manejo del boro en los sistemas agrícolas
Los desequilibrios
originados por deficiencia y toxicidad de B son problemas existentes en muchas
regiones agrícolas del mundo, siendo necesaria su identificación y corrección
sólo a través de un buen conocimiento de los procesos involucrados en su
absorción, movilización y distribución en la planta (Brown y Hu, 1998a).
En general, las
técnicas de muestreo para diagnosticar el estatus de B en las plantas están
basadas en la premisa de que el B es inmóvil, no se desplaza en el floema, como
sucede en la mayoría de las especies.
Sin embargo, actualmente se sabe que el B es móvil en el floema de
aquellas especies que utilizan polioles (azúcares
simples: manitol, sorbitol) como un metabolito fotosintético primario con alta
afinidad para enlazar al B para su posterior transporte en el floema hacia
zonas de acumulación activa, como los meristemas
vegetativos o reproductivos (Brown et al,
1999; Brown y Hu, 1996; 1998a; Hu
et al, 1997). En estas especies la toxicidad de B se
presenta como muerte descendente de los brotes jóvenes, abundante secreción de
resina en la axila de la hoja y presencia de lesiones corchosas de color marrón
a lo largo del tallo y los pecíolos que son síntomas observables en almendra,
manzana, albaricoque, cereza, melocotón, pera, níspero, olivo y ciruela (Brown
y Hu, 1998a).
Por el contrario, en las especies que no producen cantidades
significativas de polioles, el B una vez translocado con el flujo de la transpiración hasta las
hojas permanece inmóvil sin poder reentrar en el floema. En estas especies, el B se acumula en las
partes terminales de las venas de las hojas describiendo un gradiente abrupto
de modo que la concentración en el peciolo o nervadura central es menor que en
la lámina media y ésta a su vez es menor que en los márgenes y ápices, así
estas especies exhiben los síntomas clásicos de toxicidad de B presentes como
quemaduras en las márgenes y puntas de las hojas en fresa, nuez, pecano y tomate (Brown y Hu,
1998a).
La diferencia de
movilidad del B influye en el diagnóstico de su estatus para corregir su
deficiencia y toxicidad en las plantas, teniendo en cuenta su movilidad en el
floema para la selección del tejido a muestrear. Esto es debido a que el B no se acumula en
las hojas más viejas, pero si en las más jóvenes, de las especies donde es
móvil; mientras que por el contrario, en las especies donde es inmóvil su
acumulación es mayor en las hojas más viejas, con respecto a las más jóvenes,
por una mayor transpiración. De igual manera,
un diagnóstico de deficiencia de B en hojas con una madurez reciente o de
completa expansión no es adecuado para especies donde el B es inmóvil debido a
que no refleja la concentración de los sitios en crecimiento cuyo muestreo si
será válido para tal diagnóstico como único enfoque válido a pesar de su
naturaleza de ser un proceso difícil e inconsistente. Por el contrario, en las especies con
movilidad, las hojas maduras son apropiadas para diagnosticar la deficiencia ya
que su contenido si refleja el estatus de B en toda la planta incluyendo los
tejidos en crecimiento (Brown y Hu, 1998a).
La fertilización de B
debe ser manejada muy cuidadosamente para no crear problemas de contaminación
en el ambiente de los cultivos, teniendo en cuenta los patrones de movilidad en
las plantas. De acuerdo con evidencias
experimentales, el B aplicado foliarmente es retranslocado hacia los órganos en crecimiento en las
especies donde es móvil, siendo ésta una práctica efectiva en cualquier momento
que estén presentes hojas funcionales, para corregir su deficiencia y
suministrarlo a los futuros tejidos incluyendo flores y frutos (Christensen et al,
2006; Nyomora et
al, 2000; Nyomora y Brown, 1999; Brown y Hu, 1998a; 1998b).
Sin embargo, en especies donde el B es inmóvil su aplicación foliar no
lo transloca del sitio aplicado, no pudiéndose suplir
sus requerimientos en los tejidos aún no formados. En tal sentido, la corrección de la
deficiencia se logra por aplicación directa en los sitios de interés. Así, en frutales donde el B es inmóvil, pero
esencial para el proceso de floración, las aplicaciones son efectivas
directamente en los botones o en las flores (Brown y Hu,
1998a).
CONCLUSIONES
El gran cúmulo de evidencias
existentes hasta ahora, destacan al B como un elemento dinámico que afecta un
número excepcionalmente grande de funciones biológicas involucradas en un
amplio espectro de procesos englobados en las plantas, que en gran parte
carecen de una clara y satisfactoria elucidación de los mecanismos involucrados
para la ocurrencia de tales procesos. En tal sentido, las investigaciones futuras cuentan con
muchos retos que incluyen la identificación de los componentes de relevancia y
de los ligandos enlazados al B además de definir su
función. Entre las herramientas
promisorias para estos intentos se pueden incluir el uso de mutantes, la
disponibilidad de marcadores fluorescentes y estudios in vivo para determinar la estabilidad de los complejos de B y su
dependencia con el medio. Estos son, entre otros, algunos experimentos que
pueden ayudar a mejorar la comprensión en cuanto a las funciones del B en el
reino vegetal. Adicionalmente, se
dispone de una herramienta bastante útil basada en el uso de ácidos fenilborónicos que incluyen al ácido 3-naftil-borónico muy
recientemente utilizado para prevenir la formación de puentes borato debido a
que enlazan fuertemente a los cis-dioles (Bassil et al,
2004). A pesar de los grandes avances y
mejoras logradas en los instrumentos analíticos durante la presente década, son
necesarios mayores esfuerzos conducentes al desarrollo de nuevas metodologías
con mayores capacidades de análisis de B a concentraciones fisiológicas en los
tejidos de las plantas. En cuando al
manejo del B en los sistemas agrícolas, es fundamental conocer la relativa
movilidad del B en las especies para el muestreo de tejido cuyo análisis
indicará el estatus de B en la planta y la consecuente estrategia de aplicar o
no fertilización teniendo en cuenta el estrecho margen entre deficiencia y
toxicidad.
LITERATURA CITADA
Allen, D. J. and D. R. Ort.
2001. Impacts of chilling
temperatures on photosynthesis in warm-climate plants. Trends Plant Sci. 6(1):
36–42.
Armstrong,
T. A.; J. W. Spears, T. D. Crenshaw and F. H. Nielsen. 2000. Boron supplementation of
a semipurified diet for weanling pigs improves feed efficiency and
bone strength characteristics and
alters plasma lipid metabolites. J. Nutr., 130 (10): 2575–2581.
Aydin, I. and G. Colakoglu.
2007. Variation
in surface roughness, wettability and some plywood properties after
preservative treatment with boron compounds. Building and Environment, 42 (11):
3837-3840.
Bakken, N. A. and C. D. Hunt. 2003. Dietary boron
decreases peak pancreatic in situ insulin release in chicks and plasma insulin
concentrations in rats regardless of vitamin D or magnesium status. J. Nutr., 133
(11): 3577–3583.
Barr,
R.; M. Böttger and F. L. Crane. 1993. The effect of
boron on plasma membrane electron transport and associated proton secretion by
cultured carrot cells. Biochem. Mol.
Biol. Intern. 31 (1): 31–39.
Barranco, W. T. and C. D. Eckhert. 2004. Boric acid inhibits human prostate cancer
cell proliferation. Cancer Lett., 216 (1): 21-29.
Bassil, E.; H. N. Hu and P. H.
Brown. 2004.
Use of phenylboronic acids to investigate boron
function in plants. Possible role of boron in transvacuolar
cytoplasmic strands and cell-to-wall adhesion. Plant Physiol. 136
(2): 3383–3395.
Blaser Grill, J.; D. Knoppik, A. Amberger and H. E. Goldbach. 1989. Influence of boron on the membrane potential in Elodea
densa and
Helianthus annuus roots and H+ extrusion of suspension cultured Daucus carota cells. Plant Physiol. 90 (1): 280–284.
Blevins,
D. G. and K. M. Lukaszewski. 1998. Boron in plant structure
and function. Ann. Rev. Plant Physiol.
Plant Mol. Biol. 49 (1): 481–500.
Bolaños, L.; P. Mateo and I.
Bonilla. 1993. Calcium-mediated recovery of boron deficient Anabaena sp. PCC 7119 grown under nitrogen
fixing conditions. J. Plant Physiol. 142
(5): 513–517.
Bolaños, L.; E. Esteban, C. Delorenzo, M. Fernandez Pascual,
M. R. Defelipe, A. Garate
and I. Bonilla. 1994. Essentiality of boron for
symbiotic dinitrogen fixation in pea (Pisum sativum)
rhizobium nodules. Plant Physiol. 104 (1): 85–90.
Bolaños, L.; A. Cebrián, M. Redondo Nieto, R. Rivilla
and I. Bonilla. 2001. Lectin-like glycoprotein PsNLEC-1 is not
correctly glycosylated and targeted in boron-deficient pea nodules, Mol.
Plant-Microbe Interact. 14 (5): 663–670.
Bolaños, L.; K. Lukaszewski, I. Bonilla and D. Blevins. 2004a. Why boron? Plant Physiol. Biochem. 42 (11): 907–912.
Bolaños, L.; M. Redondo Nieto, R. Rivilla, N.
J. Brewin and I. Bonilla. 2004b. Cell surface
interactions of Rhizobium bacteroids and other bacterial strains with symbiosomal and peribacteroid
membrane components from pea nodules, Mol. Plant-Microbe Interact. 17 (2): 216–223.
Bonilla,
I.; C. Mergold Villasenor,
M. E. Campos, N. Sánchez, H. Pérez, L. López, L. Castrejón, F. Sánchez and G. I. Cassab.
1997. The aberrant cell walls of boron-deficient bean
root nodules have no covalently
bound hydroxyproline-/proline-rich proteins. Plant Physiol. 115 (4): 1329–1340.
Brown,
P. H. and H. Hu. 1996. Phloem mobility of boron in species dependent: evidence
for phloem mobility in sorbitol-rich species. Ann. Bot., 77(5): 497-505.
Brown,
P. H. and H. Hu. 1998a. Boron mobility and consequent management in different
crops. Better Crops 82 (2): 28-31.
Brown,
P. H. and H. Hu. 1998b. Phloem boron mobility in diverse plant species. Bot. Acta, 111 (1): 331-335.
Brown,
P. H. and B. J. Shelp. 1997. Boron mobility in
plants. Plant Soil 193 (1-2):
85–101.
Brown,
P. H.; N. Bellaloui, M. A. Wimmer,
E. S. Bassil, J. Ruiz, H. Hu, H. Pfeffer,
F. Dannel and V. Römheld. 2002. Boron in
plant biology. Plant Biol. 4 (2): 205–223.
Cakmak, I. and V. Römheld. 1997. Boron deficiency-induced impairments of cellular
functions in plants. Plant Soil, 193
(1-2): 71–83.
Cakmak, I.; H. Kurz and H. Marschner. 1995. Short-term
effects of boron, germanium and high light intensity on membrane permeability
in boron deficient leaves of sunflower. Physiol.
Plant. 95 (1): 11–18.
Chandra,
S. and D. R. Lorey. 2007. SIMS ion microscopy imaging of
boronophenylalanine (BPA) and 13C15N-labeled
phenylalanine in human glioblastoma cells: Relevance
of subcellular scale observations to BPA-mediated boron neutron capture therapy
of cancer. International Journal of Mass Spectrometry, 260 (2-3):
90-101.
Chen,
X.; S. Schauder, N. Potier,
A. Van Dorsselaer, I. Pelczer,
B. L. Bassler and F. M. Hughson. 2002. Structural
identification of a bacterial
quorum-sensing signal containing boron. Nature,
415 (6871): 545–549.
Christensen, L .P.; R. H. Beede and W. L. Peacock. 2006. Fall foliar sprays prevent
boron-deficiency symptoms in grapes. California Agriculture, 60 (2): 100-103.
Coulthurst, S. J.; N. A.
Whitehead, M. Welch and G. P. C. Salmond. 2002. Can
boron get bacteria talking? Trends Biochem. Sci. 27
(5): 217–219.
Conti, V.; G. Bartesaghi,
D. Bolognini, V. Mascagna,
C. Perboni, M. Prest, S. Scazzi, A. Mozzanica, P. Cappelletti, M. Frigerio, S. Gelosa, A. Monti, A. Ostinelli, G. Giannini and E. Vallazza.
Cui, Y.; M. I. Winton, Z. F. Zhang, C. Rainey
J. Marshall, J. B. De Kernion and C. D. Eckhert. 2004.
Dietary boron intake and prostate cancer risk. Oncol.
Rep. 11 (4): 887-892.
Darley, C. P.; A. M. Forrester and S. J. McQueen
Mason. 2001.
The molecular basis of plant cell wall extension. Plant Mol. Biol. 47 (1-2): 179–195.
Dhamodaran, T. K. and R. Gnanaharan. 2007. Boron impregnation treatment of Eucalyptus
grandis wood. Bioresource
Technology, 98 (11): 2240-2242.
Dordas, C. and P. H. Brown. 2000. Permeability of
boric acid across lipid bilayers and factors affecting it. J. Membr.
Biol. 175 (2): 95–105.
El-Hamdaoui, A.; M. Redondo Nieto, R. Rivilla, I. Bonilla and L. Bolaños. 2003a. Effects of
boron and calcium nutrition on the establishment of the Rhizobium leguminosarum-pea (Pisum sativum)
symbiosis and nodule development under salt stress. Plant Cell Environ., 26 (7): 1003–1011.
El-Hamdaoui, A.; M. Redondo Nieto, B.
Torralba, R. Rivilla, I. Bonilla and L. Bolaños. 2003b. Influence of
boron calcium on the tolerance to salinity of nitrogen-fixing pea plants, Plant
Soil, 251 (1): 93–103.
El-Shintinawy, F. 1999. Structural and functional damage caused
by boron deficiency in sunflower leaves. Photosynthetica 36 (4): 565–573.
Ferrol,
N. and J. P. Donaire. 1992. Effect of boron on
plasma membrane proton extrusion and redox activity in sunflower cells. Plant Sci. 86 (1): 41–47.
Fleischer,
A.; M. A. O‘Neill and R. Ehwald. 1999. The pore size
of nongraminaceaous plant cell walls is rapidly
decreased by borate ester cross-linking of the pectic
polysaccharide rhamnogalacturonan II. Plant Physiol. 121 (3): 829–838.
Fort,
D. J.; E. L. Stover, P. L. Strong, F. J. Murray and C. L. Keen. 1999. Chronic
feeding of low boron diet adversely affects reproduction and development in Xenopus laevis. J. Nutr., 129 (11): 2055–2060.
Goldbach, H. E. 1985. Influence of
boron nutrition on net uptake and efflux of 32P and 14C-glucose in Helianthus
annuus roots
and cell cultures of Daucus carota. J.
Plant Physiol. 118 (1): 431–438.
Goldbach, H. E.
Goldbach, H. E.; J. Blaser Grill, N. Lindemann, M. Porzelt, C. Hörrmann, B. Lupp and B. Gessner. 1991. Influence of
boron on net proton release and
its relation to other metabolic processes, in Randall, D. D., et al.: Current Topics in Plant Biochemistry
and Physiology. Vol. 10,
University of Missouri-Columbia, p. 195–220.
Goldbach,
H.; Q. Yu, R. Wingender, M. Schulz, M. Wimmer, P. Findeklee and F. Baluska. 2001. Rapid response reactions of roots to boron
deprivation. J. Plant Nutr. Soil Sci., 164 (2):
173-181.
Goldbach, H. E. and M. A. Wimmer. 2007. Boron in plants and animals: is there a role
beyond cell-wall structure?. J. Plant Nutr. Soil
Sci., 170 (1): 39-48.
Greenwood,
N. and A. Earnshaw. 1997. Chemistry of the elements.
Second edition, Pergamon Press, New York. p. 139-213.
Henzler, T.; Q. Ye and E. Steudle. 2004. Oxidative gating of water channels (aquaporins) in Chara by hydroxyl radicals. Plant Cell Environ. 27 (9): 1184–1195.
Hu, H. and P. Brown. 1997. Absorption
of boron by plant roots. Plant Soil 193 (1-2): 49-58.
Huang,
L. B.; Z. Q. Ye, R. W. Bell and B. Dell. 2005. Boron nutrition and
chilling tolerance of warm climate crop species. Ann. Bot. 96 (5) 755–767.
Hugly, S.; P. McCourt, J. Browse, G. W. Patterson
and C. Somerville.
Hunt,
C. D. 2002.
Boron-binding biomolecules: A key to understanding the beneficial physiological
effects of dietary boron from prokaryotes to humans, in Goldbach,
H. E., et al.: Boron in plant and
animal nutrition. Kluwer Academic/Plenum Publ., New York, p. 21–36.
Hunt,
C. D. 2003.
Dietary boron: An overview of the evidence for its roles in immune function. Trace Elem. Exp. Med., 16 (4):
291–306.
Hovanski, Y.; M. L. Santella and G. J. Grant. 2007. Friction stir spot welding of hot-stamped boron
steel. Scripta Materialia,
57 (9): 873-876.
Kankaanranta, L.; T. Seppälä, H. Koivunoro and K. Saarilahti.
2007. Boron neutron capture therapy in the treatment of locally recurred head
and neck cancer. International Journal of Radiation Oncology Biology Physics,
69 (2): 475-482.
Kannenberg, E. L. and N. J. Brewin. 1994. Host-plant invasion by Rhizobium: the
role of cell-surface components, Trends Microbiol. 2
(8): 277–283.
Kartal, S. N.; W. J. Hwang and Y. Imamura. 2007. Combined effect of boron compounds and heat
treatments on Wood properties: chemical and strength properties of wood.
Journal of Materials Processing Technology, In
Press.
Kastori, R.; M. Plesnicar, D. Pankovic and Z. Sakac. 1995. Photosynthesis, chlorophyll fluorescence and
soluble carbohydrates in sunflower leaves as affected by boron deficiency. J. Plant Nutr. 18
(9): 1751–1763.
Kobayashi, M.; H. Nakagawa, T.
Asaka and T. Matoh. 1999. Boraterhamnogalacturonan II bonding reinforced by Ca2+
retains pectic polysaccharides in higher plant cell
walls, Plant Physiol., 119 (1): 199–204.
Kohno,
J.; T. Kawahata, T. Otake,
M. Morimoto, H. Mori, N. Ueba, M. Nishio,
A. Kinumaki, S. Komatsubara
and K. Kawashima. 1996. Boromycin, an anti-HIV antibiotic. Biosci. Biotech. Biochem., 60 (6): 1036–1037.
Kohorn, B. D. 2000. Plasma
membrane-cell wall contacts. Plant
Physiol. 12 (1): 31–38.
Kohorn, B. D.; M. Kobayashi, S.
Johansen, H. P. Friedman, A. Fischer and N. Byers. 2006. Wall-associated kinase 1
(WAK1) is crosslinked
in endomembranes, and transport to the cell surface requires correct cell-wall
synthesis. J. Cell Sci. 119 (11):
2282–2290.
Liu, Y.; L. Cheng, L.
Zhang and S. Wu. 2007. Oxidation
protection of multilayer CVD SiC/B/SiC coatings for 3D C/SiC
composite. Material Science and Engineering: A, 466 (1-2): 172-177.
Lord,
E. M. and J. C. Mollet. 2002. Plant cell adhesion: A bioassay facilitates discovery
of the first pectin biosynthetic gene. Proc.
Natl. Acad. Sci. Unit. States
Am. 99 (25): 15843–15845.
Majewska Sawka,
A. and E. A. Nothnagel. 2000. The multiple roles of arabinogalactan proteins in plant development. Plant Physiol.
122 (1): 3–9.
Malavé
Acuña, A. 2005. Los suelos como fuente de
boro para las plantas. Rev. Cientif. UDO Agríc., 5 (1): 10-26.
Matoh, T. 1997. Boron in plant cell
walls. Plant Soil 193 (1-2):
59–70.
Matsunaga, T.; T. Ishii, S.
Matsumoto, M. Higuchi, A. Darvill, P. Albersheim and M. O‘Neill. 2004. Occurrence of the
primary cell wall
polysaccharide rhamnogalacturonan II in pteridophytes, lycophytes, and bryophytes. Implications for the evolution
of vascular plants. Plant Physiol., 134 (1): 339–351.
Matsumoto, T. 2007. Monte Carlo simulation of
depth-dose distribution in several organic models for boron neutron capture
therapy. Nuclear Instruments and Methods in Physics Research Section A:
Accelerators, Spectrometers, Detectors and Associated Equipment, 580 (1): 552-557.
Miller,
M. B. and B. L. Bassler. 2001. Quorum sensing in
bacteria. Ann. Rev. Microbiol., 55 (1): 165–199.
Moore,
B. S. and C. Hertweck. 2002. Biosynthesis and
attachment of novel bacterial polyketide synthase
starter units. Nat. Product Rep.,
19 (1): 70–99.
Mühling, K. H.; M. Wimmer and H. E. Goldbach. 1998. Apoplastic and membrane-associated Ca2+ in
leaves and roots as affected by boron deficiency. Physiol. Plant. 102 (2): 179–184.
Nakamura, H.; M. Ueno, J. D. Lee, H. S. Ban and E. Justus. 2007.
Synthesis of dodecaborate-conjugated cholesterols for
efficient boron delivery in neutron capture therapy. Tetrahedron Letters, 48
(18): 3151-3154.
Newnham, R. E. 2002. How boron is
being used in medical practice, in Goldbach, H. E., et al.: Boron in Plant and Animal
Nutrition. Kluwer Academic Publishers, New York, p. 59–62.
Nielsen,
F. H. 2000.
The emergence of boron as nutritionally important throughout the life cycle. Nutrition, 16 (7-8): 512–514.
Niklas, K. J. 1992. Plant
Biomechanics. An engineering approach to plant form and function. Univ. Chicago
Press. Chicago.
Noguchi,
K.; T. Ishii, T. Matsunaga, K. Kakegawa,
H. Hayashi and T. Fujiwara. 2003. Biochemical properties of the cell wall in the Arabidopsis mutant bor1–1 in
relation to boron nutrition. J. Plant Nutr. Soil Sci. 166 (2): 175–178.
Nyomora, A. M. and P. H.
Brown. 1999. Rate and time of boron application increase almond productivity
and tissue boron concentration. Hort Sci., 34 (2):
242-245.
Nyomora, A. M.; P. H.
Brown, K. Pinney and V. S. Polito.
2000. Foliar application of boron to almond trees affects pollen quality. J.
Am. Soc. Hort Sci., 125 (2): 265-270.
Obermeyer, G.; R. Kriechbaumer, D. Strasser, A. Maschessnig and F. W. Bentrup. 1996. Boric acid
stimulates the plasma membrane H+-ATPase
of ungerminated lily pollen grains. Physiol. Plant. 98 (2): 281–290.
O‘Neill,
M.; S. Eberhard, P. Albersheim
and A. Darvill. 2001. Requirement of borate
cross-linking of cell wall rhamnogalacturonan II for Arabidopsis growth. Science 294 (5543): 846–849.
O‘Neill,
M. A.; T. Ishii, P. Albersheim and A. G. Darvill. 2004. Rhamnogalacturonan II:
Structure and function of a borate cross-linked cell wall pectic
polysaccharide. Ann. Rev. Plant Biol. 55
(1): 109–139.
Park,
M.; Q. Li, N. Shcheynikov, W. Z. Zeng
and S. Muallem. 2004. NaBC1 is an ubiquitous electrogenic Na+-coupled borate transporter essential for
cellular boron homeostasis and cell growth and proliferation. Molecular Cell, 16 (3): 331–341.
Park,
M.; Q. Li, N. Shcheynikov, S. Muallem
and W. Z. Zeng. 2005. Borate transport and
cell growth and proliferation: not only in plants. Cell Cycle, 4 (1): 24–26.
Parr,
A. J. and B. C. Loughman. 1983. Boron and membrane
function in plants, In Robb, D. A., et al.: Metals and micronutrients:
uptake and utilization by plants. Academic Press, New York. p. 87–107.
Pawa, S. and S. Ali. 2006. Boron ameliorates fulminant
hepatic failure by counteracting the changes associated with the oxidative
stress. Chem. Biol. Interact. 160 (2): 89–98.
Pérez Almeida, I. y N. C. Carpita. 2006. Las b-galactosidasas y la
dinámica de la pared celular. Interciencia, 31 (7): 476-483.
Power,
P. and W. Woods. 1997. The chemistry of boron and its speciation in plants. Plant Soil, 193 (1-2): 1-13.
Queiroz,
C. G. S.; A. Alonso, M. Mares Guia and A. C.
Magalhaes. 1998 Chilling-induced changes in membrane fluidity and antioxidant enzyme activities in Coffea arabica L. roots. Biol. Plant. 41 (3): 403–413.
Ralston,
N. V. C. and C. D. Hunt. 2000. Biological boron interactions: Charge and
structure characteristics required for boroester
formation with biomolecules. FASEB J. 14:
A538-538.
Ralston,
N. V. C. and C. D. Hunt. 2001. Diadenosine phosphates
and S-adenosylmethionine: novel boron binding
biomolecules detected by capillary electrophoresis. Biochim. Biophys.
Acta, 1527 (1-2): 20–30.
Redondo Nieto, M. 2002. Boron and Calcium Relationship in Rhizobium–Legumes Symbioses, Ph.D. Tesis,
Universidad Autónoma de Madrid,
Madrid-España.
Redondo Nieto, M.; I. Bonilla y L. Bolaños. 2007. El boro (B) y la
relación boro-calcio (B-Ca2+).
http://www.uam.es/personal_pdi/ciencias/bolarios/Investigacion/boro.htm. Última
visita 18 de diciembre de 2007.
Redondo Nieto, M.; P. Mergaert, A. Kondorosi, E. Kondorosi, I.
Bonilla and L. Bolaños. 2002. Nutritional Influence of Boron and Ca2+ on
Nodule Organogenesis in
Legumes, Fifth European Nitrogen Fixation Conference, Abstract 8.22, Norwich.
Redondo Nieto, M.; A. Wilmot, A. El-Hamdaoui, I. Bonilla and L. Bolaños. 2003. Relationship
between boron and calcium in the N2-fixing legume–rhizobia
symbiosis, Plant Cell Environ., 26 (11): 1905–1915.
Reuhs, B. L.; J. Glenn, S. B. Stephens, J. S. Kim,
D. B. Christie, J. G. Glushka, E. Zablackis,
P. Albersheim, A. G. Darvill
and M. A. O‘Neill. 2004. L-Galactose replaces L-fucose in the pectic
polysaccharide rhamnogalacturonan II synthesized by the L-fucose-deficient
mur1 Arabidopsis mutant. Planta, 219
(1): 147–157.
Rodgers, G. 1995. Química Inorgánica.
McGraw-Hill/Interamericana de España. 415 p.
Rowe,
R. I. and C. D. Eckhert. 1999. Boron is required for zebrafish embryogenesis. J. Exp. Biol. 202 (12): 1649–1654.
Ryden, P.; K. Sugimoto Shirasu,
A. C. Smith, K. Findlay, W. D. Reiter and M. C. McCann. 2003. Tensile
properties of Arabidopsis cell walls depend on both a xyloglucan cross-linked microfibrillar network and rhamnogalacturonan
II-borate complexes. Plant Physiol. 132
(2): 1033–1040.
Samman, S.; M. R. Naghii, P. M. Lyons Wall and A. P. Verus.
1998.
The nutritional and metabolic effects of boron in humans and animals. Biol. Trace Elem. Res., 66 (1-3):
227–235.
Stacey,
N. J.; K. Roberts, N. C. Carpita, B. Wells and M. C.
McCann. 1995.
Dynamic changes in cell surface molecules are very early events in the differentiation of mesophyll cells from Zinnia
elegans into
tracheary elements. Plant J. 8 (6): 891–906.
Taiz, L. and E. Zeiger. 1991. Plant physiology. The Benjamin/Cumming Publish
Company, Inc. California, USA. 559 p.
Takano, J.; K. Noguchi, M. Yasumori, M. Kobayashi, Z. Gajdos, K. Miwa, H. Hayashi, T. Yoneyama and T. Fujiwara. 2002. Arabidopsis boron transporter for
xylem loading. Nature, 420
(6913): 337–340.
Takano,
J.; K. Miwa, N. von Wiren and T. Fujiwara. 2005a. Boron
dependent endocytosis and degradation of boron transporter AtBOR1. Plant Cell Phys., 46, S151–S151.
Takano,
J.; K. Miwa, X. Yuan, N. von Wiren and T. Fujiwara. 2005b. Endocytosis
and degradation of BOR1, a boron transporter of Arabidopsis thaliana,
regulated by boron availability. Proc.
Natl. Acad. Sci. Unit. States
Am., 102 (34): 12276–12281.
Takano,
J.; M. Wada, U. Ludewig, G. Schaaf,
N. von Wiren and T. Fujiwara. 2006. The Arabidopsis major intrinsic protein
NIP5;1 is essential for
efficient boron uptake and plant development under boron limitation. Plant
Cell 18 (6): 1498–1509.
Wang,
Z. Y.; Y. L. Tang, F. S. Zhang and H. Wang. 1999. Effect of boron and low
temperature on membrane integrity of cucumber leaves. J. Plant Nutr. 22 (3): 543–550.
Weber, L. and R. Tavanga.
2007. On the influence of active element content on
the thermal conductivity and thermal expansion of Cu–X (X = Cr, B)
diamond composites. Scripta Materialia,
57 (11): 988-991.
World
Health Organization (WHO). 1998. Environmental health criteria 204: boron.
Geneva, Switzerland: World Health Organization.
Wimmer, M. 2000. Untersuchungen zur Funktion von Bor im Apoplasten der Ackerbohne (Vicia faba L.).
Bonner agrikulturchemische Reihe,
Vol. 3, Agrikulturchemisches Institut,
University Bonn, Bonn, Germany, p. 115.
Wimmer, M. A. and H. E. Goldbach. 1999. Influence of Ca2+ and pH on the
stability of different boron fractions in intact roots of Vicia
faba L. Plant
Biol. 1 (6): 632–637.
Wimmer, M. A.; E. S. Bassil, P. H. Brown and A. Läuchli.
2005.
Boron response in wheat is genotype-dependent and related to boron uptake,
translocation, allocation, plant phenological
development and growth rate. Funct. Plant
Biol. 32 (6): 507–515
Winans, S. 2002. Bacterial esperanto, Nat. Struct. Biol. 9 (1):
83–84.
Xue,
Z. M.; K. N. Wu and B.
Liu. 2007. New lithium salts with croconato-complexes of boron for lithium
battery electrolytes. J. Power Sources, 171 (2): 944-947.
Yanagie, H.; Y. Sakurai,
K. Ogura and T. Kobayashi.
2007. Evaluation of neutron dosimetry
on pancreatic cancer phantom model for application of intraoperative boron
neutron-capture therapy. Biomedicine & Pharmacotherapy, 61 (8): 505-514.
Ye,
Z. Q.; R. W. Bell, B. Dell and L. B Huang. 2000. Response of sunflower to
boron supply at low root zone temperature. Commun. Soil Sci. Plant Anal.
31 (11-14): 2379–2392.
Ye,
Z. Q.; L. B. Huang, R. W. Bell and B. Dell. 2003. Low root zone temperature
favours shoot B partitioning into young leaves of oilseed rape (Brassica napus). Physiol.
Plant. 118 (2): 213–220.
Yu,
Q.; A. Hlavacka, T. Matoh,
D. Volkmann, D. Menzel, H. E. Goldbach
and F. Baluska. 2002. Short-term
boron deprivation inhibits endocytosis of cell wall pectins in meristematic cells of
maize and wheat root apices. Plant Physiol. 130 (1): 415–421.
Zhou, W.; S. Qi, Q. An and H. Zhao.
2007. Thermal conductivity of boron nitride reinforced
polyethylene composites. Materials Research Bulletin, 42
(10): 1863-1873.
Página diseñada
por Prof. Jesús Rafael Méndez Natera
TABLA DE CONTENIDO DE LA REVISTA CIENTÍFICA UDO
AGRÍCOLA