Revista Científica UDO Agrícola Volumen 7.
Número 1. Año 2007. Páginas: 58-67
Regeneración
in vitro de Laelia anceps ssp. dawsonii
In vitro regeneration of Laelia anceps ssp. dawsonii
Hilda
E. Lee Espinosa ![]() 1,2, Antonio Laguna Cerda1, Joaquin Murguía González2, Pablo Elorza Martínez3, Lourdes Iglesias Andreu4, Benjamin García
Rosas1, Felipe A. Barredo
Pool5 y Nancy Santana
Buzzy5
1,2, Antonio Laguna Cerda1, Joaquin Murguía González2, Pablo Elorza Martínez3, Lourdes Iglesias Andreu4, Benjamin García
Rosas1, Felipe A. Barredo
Pool5 y Nancy Santana
Buzzy5
1Universidad
Autónoma del Estado de México. Programa de Maestría y Doctorado en Ciencias
Agropecuarias y Recursos Naturales, Centro Universitario “El Cerrillo” Km. 15
Carretera Toluca-Ixtlahuaca, Veracruz, México; 2Universidad Veracruzana.
Facultad de Ciencias Biológicas y Agropecuarias, Laboratorio de Cultivo in vitro de Tejidos Vegetales. Carretera
Peñuela-Amatlán Km. 1, Peñuela, Municipio de Amatlán de los Reyes, Veracruz. Tel-Fax: ![]() Autor para correspondencia.
Autor para correspondencia.
|
Recibido: 29/10/2007 |
Fin de primer arbitraje: 21/11/2007 |
Primera revisión recibida: 23/11/2007 |
|
Fin de segundo arbitraje: 15/12/2007 |
Segunda revisión recibida:
19/12/2007 |
Aceptado: 29/12/2007 |
RESUMEN
Se germinaron in
vitro semillas de Laelia anceps ssp. dawsonii, una orquídea silvestre
amenazada, originaria de México y Mesoamérica, con alto potencial ornamental,
utilizando el medio Murashige & Skoog (1962) suplementado con ácido 1-naftalén-acético
(ANA), 6-benzyl-amino-purina (BAP), Kinetina (Kin) y ácido indol-3-acético (AIA), 2 mg L-1 de
cada uno, el cual resultó óptimo para la
inducción de callo bajo fotoperiodo de 16/8 h (20.2 µmol•m-2•s-1).
El callo fue subcultivado a intervalos de 45 días en
el mismo medio de cultivo, produciendo en promedio 524 embriones somáticos en el tercer subcultivo. Los embriones somáticos producidos se
convirtieron en plantas completas con brotes y raíces en el mismo medio, y
fueron transferidas al medio VW suplementado con BAP 2 mg L-1, AIA 1
mg L-1 y carbón activado 0.2 % para su desarrollo. Después de aproximadamente tres meses, las
plántulas fueron aclimatizadas en el invernadero con
un 100 % de tasa de sobrevivencia.
Palabras clave:
Orchidaceae, morfogénesis, callos embriogénicos,
embriones somáticos, embriogénesis somática.
ABSTRACT
Seeds of Laelia anceps ssp. dawsonii were germinated in vitro, this is a wild endangered orchid, originated in México
and Mesoamerica, with a high ornamental potential. Murashige
& Skoog (1962) culture media, supplemented with
1-naftalen-acetic acid (ANA), 6-benzyl-amino-purine (BAP), Kinetin (Kin) and
indol-3-acético (AIA) acid, 2 mg L-1 each one, was optimum for
callus induction under 16/8 h photoperiod
(20.2 µmol•m-2•s-1). Callus was subcultured
every 45 days in the same culture medium producing 524 somatic embryoids in average, at the end of the third subculture.
Somatic embryoids germinated in plants with shoots
and roots in the same culture medium, and were transferred to VW supplemented
with 2 mg L-1 BAP, 1 mg L-1 AIA and 0.2 % active charcoal
to induce their develop. Three months later, plantlets were acclimatized in a
greenhouse, with 100 % survivence.
Key words: Orchidaceae, morphogenesis, embryogenic
callus, somatic embryos, somatic embryogenesis.
Abreviaturas:
ANA=ácido 1-naftaleno acético; BAP=6, benzyl-amino-purina;
AIA=ácido indol-3-acético; Kin= kinetina;
MS= Murashige & Skoog;
KC= Knudson C; VW= Vacin & Went; ESs=embriones somáticos.
INTRODUCCIÓN
Laelia anceps es una orquídea silvestre, epífita, que actualmente
se encuentra en grave peligro de extinción, debido principalmente al fuerte
saqueo al que ha sido expuesta desde hace muchos años. El género Laelia está
compuesto por 11 especies, epífitas, todas ellas sobresalientes por su gran
atractivo.
Esta especie se encuentra localizada
principalmente en las vertientes del Golfo y Pacífico mexicanos (Halbinger, 1993) y
fue clasificada por Soto (1993) quien reporta dos distintas formas, la forma chilapensis,
de Guerrero, y la forma dawsonii con inflorescencias de

Cultivada en forma tradicional,
actualmente se encuentra en muy grave peligro de extinción al enfrentar severos
problemas de conservación como resultado de su colecta excesiva para venderla
como planta para maceta, así como sus flores cortadas (Halbinger,
1993), por lo que se incluye en la Norma Oficial Mexicana del 2002. Aunada a
esta situación, posee una extremadamente baja tasa de propagación, ya que sus
semillas poseen únicamente del 1-5 % de potencial germinativo requiriendo la
presencia de micorrizas para elevar este porcentaje (Martin & Pradeep, 2003). El cultivo de tejidos vegetales resulta de
gran utilidad para la propagación de plantas, a escalas mayores que las
obtenidas por métodos tradicionales (Rao, 1998; Murthy y Pyati, 2001; Lee y Lee,
2003; Shimura y Koda, 2004)
y una de sus principales rutas de diferenciación morfogenética.
La embriogénesis somática, actualmente permite la propagación masiva mediante
la germinación in vitro de semillas
inducidas a la formación de callos que producen embriones somáticos
(estructuras bipolares, independientes del tejido original) elevando su
capacidad reproductiva a través del manejo adecuado de las condiciones físicas
y químicas del ambiente de cultivo. Existen numerosos protocolos de
embriogénesis somática en orquídeas, a partir de explantes,
tales como yemas axilares, ápices, secciones de hoja y semillas fecundadas e
inmaduras (Cheng
y Chang, 2000, 2003, 2004b; Huan, et al., 2004), existiendo reportes en
híbridos comerciales como Phalaenopsis amabilis var. Formosa shimadzu (Cheng y Chang, 2004a) y
otros más. En el género Laelia,
reportes de Santos-Hernández et al, 2005, Potisek
et al, 1994, Avila
y Salgado, 2006, mencionan la germinación de semillas en Laelia albida, Laelia rubescens
Lindley, Laelia autumnalis, etc. no existiendo reportes de
embriogénesis somática para esta especie.
En el presente trabajo se desarrolló una
metodología para la regeneración in vitro
de Laelia anceps ssp. dawsonii, como estrategia inicial de rescate, y con el
objetivo de permitir eventualmente su uso sustentable y la repoblación de
hábitats
MATERIALES Y
MÉTODOS
Material
vegetal utilizado
Se seleccionó a la especie Laelia anceps ssp. dawsonii, cultivada en el municipio de Fortín en el
estado de Veracruz en México. Las semillas maduras fueron extraídas de las
cápsulas, antes de su dehiscencia, y
establecidas in vitro,en
diferentes medios de cultivo que fueron probados de manera preliminar, para la
inducción inicial de morfogénesis, y obtención del material utilizado en
experimentos posteriores.
Medios de
cultivo básicos.
Se utilizaron tres medios básicos: Murashige & Skoog (MS,
1962), Knudson
C (KC, 1946) y Vacin & Went
(VW, 1949), suplementados con 100 mg L-1 de myo-inositol,
30 000 mg L-1 de sacarosa, 5 mL L-1
de solución de vitaminas de MS y como agente gelificante
se utilizaron 2 500 mg L-1 de
Phytagel. En los medios MS y KC el pH fue ajustado a
5.7±0.1 y en el medio VW a 4.8±0.1 con NaOH 1 N o HCl, antes de la esterilización en autoclave durante 17 min
a
Inducción de
la germinación in vitro
Se utilizaron los medios de cultivo
básicos de MS y VW, suplementados como se indicó anteriormente y adicionados
con las combinaciones de reguladores de crecimiento vegetal: ANA, BAP, AIA, 2.0
mg L-1 c/u y ANA, BAP, 2.0 mg
L-1 c/u. Estos medios de cultivo,
fueron esterilizados, dosificándose en cajas de Petri a razón de 15 mL en cada una, inoculándose posteriormente con 5 mg de semillas. Se utilizaron 20
repeticiones para cada combinación de reguladores de crecimiento vegetal,
consistentes en 5 mg de semillas que fueron depositados en la superficie del
medio de cultivo. Los cultivos fueron incubados bajo condiciones de fotoperiodo
de 16/8 h (20.2 µmol•m-2•s-1 de lámparas de luz
fluorescente marca Phillips tipo blanco frío), a una temperatura de 23 ±
Efecto de
las condiciones de cultivo (oscuridad y el fotoperiodo de 16/8 h) sobre la
morfogénesis de Laelia anceps ssp. dawsonii
Para evaluar el efecto de las condiciones
de incubación sobre la regeneración y diferenciación de estructuras morfogenéticas, se
estableció un experimento completamente aleatorizado, probando los medios de
cultivo: MS, KC y VW, bajo condiciones de fotoperiodo de 16/8 h (33.78 µmol•m-2•s-1)
y oscuridad. Los medios de cultivo
fueron suplementados con la combinación de reguladores de crecimiento vegetal
ANA, BAP, AIA, 2.0 mg L-1 c/u. utilizando diez repeticiones por
tratamiento, consistentes cada una en un callo con la misma textura,
consistencia y coloración en todos los tratamientos, distribuyéndose
individualmente en frascos de cultivo conteniendo cada uno 20 mL del medio, siendo éstas 10 repeticiones; los
experimentos se repitieron dos veces en el tiempo. Las evaluaciones del número
de embriones somáticos, coloración y vigor de los callos, se realizaron a las
cinco semanas de cultivo en incubación.
Efecto de
reguladores de crecimiento sobre la morfogénesis de los embriones somáticos
Porciones de callo embriogénico de
aproximadamente
Efecto
de los subcultivos
sobre la multiplicación de los embriones somáticos
Se cultivaron in vitro 60 embriones somáticos en estadio temprano de ~

Germinación
de embriones somáticos y regeneración de plantas
Los embriones somáticos que maduraron
adecuadamente hasta un estado avanzado de desarrollo, se transfirieron a frascos de cultivo conteniendo 40 mL del medio basal VW, suplementado de la manera antes
descrita y adicionado con BAP 2 mg L-1, AIA 1 mg L-1 y carbón
activado 0.2% para el desarrollo de las plántulas.
RESULTADOS
Inducción de
la germinación in vitro
Se logró un 100 % de prendimiento de las
semillas, que evolucionaron formando abundante callo (Figura
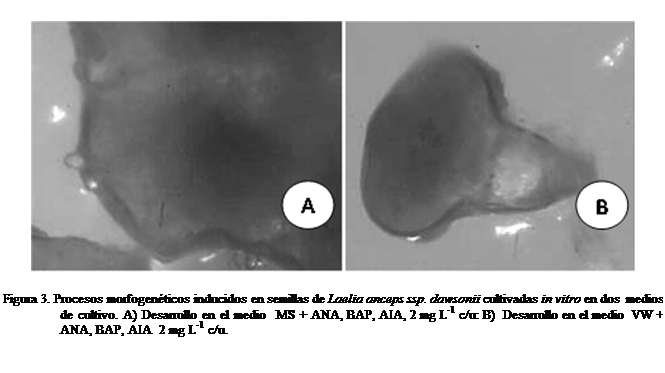
Efecto de
las condiciones de cultivo (oscuridad y el fotoperiodo de 16/8 h) sobre la
morfogénesis de Laelia anceps ssp. dawsonii
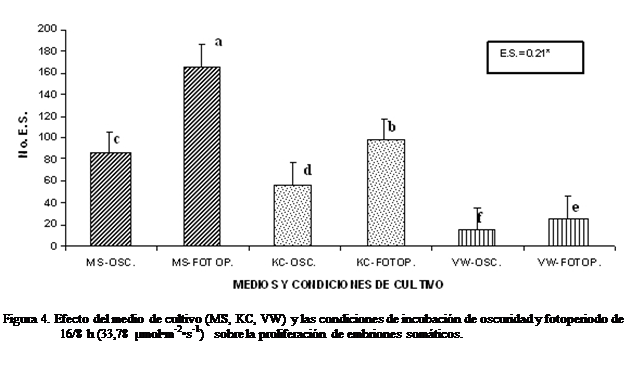
Como resultado de la exposición de los
callos a condiciones de fotoperiodo (33.78 µmol•m-2•s-1)
y oscuridad, en los diferentes medios basales de cultivo, fue posible observar
una mayor eficiencia en la proliferación de callo y la formación de embriones
somáticos bajo condiciones de fotoperiodo, y medio MS en el cual se formó un
promedio de 165.2 embriones somáticos y abundante callo embriogénico de color
verde intenso; con el medio KC se indujo la formación de 97.6 embriones
somáticos. En condiciones de oscuridad
el medio MS logró inducir en promedio 86 embriones somáticos y el medio Knudson C indujo la formación de 56.6 embriones somáticos.
El medio de cultivo VW, al parecer, resultó tener la menor capacidad morfogenética, mostrando en las dos condiciones evaluadas,
los menores promedios de formación de embriones somáticos, de apenas 26 en fotoperíodo y bajo condiciones de oscuridad produjo apenas
15,2 ESs (Figura 4).
Efecto de
reguladores de crecimiento sobre la morfogénesis de los embriones somáticos
Los segmentos de callo mostraron
diferentes capacidades morfogenéticas en cada una de
las combinaciones de RCV utilizadas; se pudo observar que con la combinación de
las auxinas ANA y AIA con BAP en RCV1 se logró estimular la mayor
proliferación de callo embriogénico apreciando una muy escasa proliferación en
esta respuesta al disminuir el aporte de auxinas endógenas, y elevar el contenido de citocininas
en RCV2 con un detrimento en el rendimiento del proceso, en los dos
períodos de tiempo evaluados; sin embargo, en RCV3, conteniendo una citocinina y una auxina se observó una respuesta
intermedia, probablemente debido al equilibrio en la relación auxina-citocinina,
utilizado en este último tratamiento.
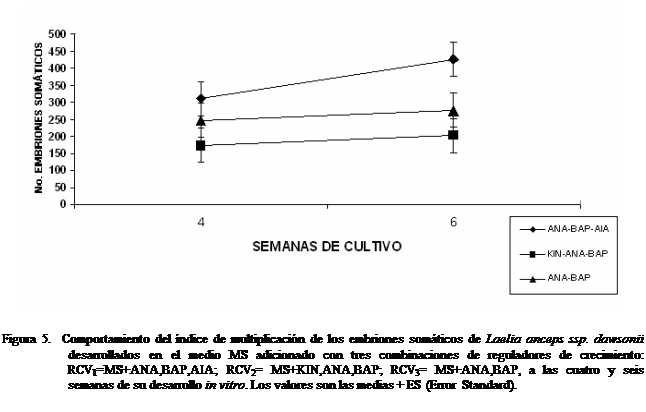
Respecto a la producción de embriones
somáticos, el análisis estadístico mostró diferencias significativas entre
combinaciones de reguladores de crecimiento vegetal, los tiempos de subcultivo y su interacción, constatando que la producción
de embriones somáticos (ESs) alcanzó su máxima
eficiencia a las seis semanas de establecido el experimento, en los tres
tratamientos probados, encontrando que la combinación RCV1 indujo el
valor más alto con un promedio de ESs 425.75
inducidos; RCV2 mostró la menor capacidad multiplicativa, produciendo 202.75 ESs en promedio. Sin embargo, RCV3, que contenía
solamente una citocinina
y una auxina, produjo en promedio 275.5 ESs a las seis semanas de cultivo (Figura 5); a las cuatro
semanas de cultivo, se observó una menor producción de embriones somáticos, con
promedios de 311, 172 y 245.75 ESs en RCV1, RCV2
y RCV3, respectivamente.
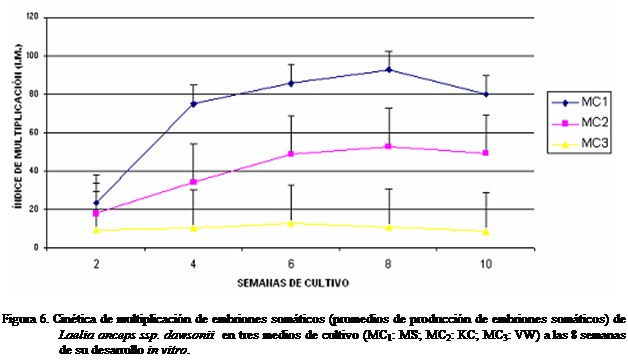
En todos los casos, se observó un
descenso en el índice de multiplicación, una vez alcanzado el nivel óptimo, ya
que los embriones somáticos inician el proceso de conversión a plántula por
carecer del subcultivo a medio fresco lo cual provoca
la inhibición del proceso de multiplicación, activando su germinación.
Se
pudo constatar que el medio de cultivo MS resultó mejor para inducir la
proliferación de embriones somáticos a partir del callo embriogénico inicialmente
establecido en contraste con los medios KC y VW aunque el período de tiempo en
que se logra la máxima proliferación fue el más prolongado, de 8 semanas
(Figura 6); sin embargo, con el medio KC también se logró inducir
proliferación, lo cual podría ser suficiente para el inicio, ya que se trata de
un medio menos complejo.
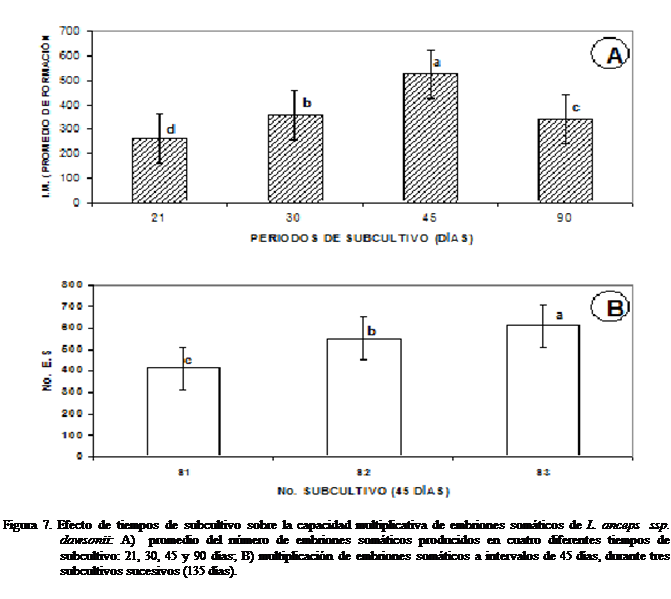
Efecto
de los subcultivos
sobre la multiplicación de los embriones somáticos
Los embriones somáticos que fueron
sometidos a diferentes intervalos de subcultivo,
mostraron incremento al final del tercer subcultivo;
esta tendencia fue observada (21, 30 y 45 días) cuando los subcultivos
se realizaron a intervalos de 45 días. Posteriormente se observó un sensible
descenso en la multiplicación de los embriones somáticos, en el recuento
efectuado a los 90 días sin subcultivos sucesivos.
El análisis de varianza de los resultados
obtenidos, mostró diferencias significativas entre el tiempo de subcultivo y el número de subcultivos
realizados, con un promedio total de de 524 ESs producidos durante los tres subcultivos,
a intervalos de 45 días (Figura
Regeneración
de plantas
Los embriones somáticos formados en la
superficie del callo continuaron su
desarrollo, produciendo brotes y raíces (Figura

DISCUSIÓN
El manejo adecuado de los factores
involucrados en este estudio, permitió el desarrollo de un protocolo inicial
para la producción de embriones somáticos, que posteriormente se desarrollaron
en plantas completas.
Las condiciones de incubación influyeron en
el desarrollo de los callos embriogénicos, observándose pequeños y
blanquecinos, particularmente los que se formaron en el medio VW, bajo
condiciones de oscuridad, sin superar los
Las hormonas son los candidatos más
viables en la regulación de señales del desarrollo. Las auxinas y las citocininas son los principales reguladores del crecimiento
en plantas, involucradas en la regulación de la división y diferenciación
celular. De a cuerdo a Dudits
et al., 1991, el 2,4-D (ácido
2,4-diclorofenoxiacético) es la auxina exógena preferencial para la inducción
de embriogénesis somática. Sin embargo, el desarrollo embriogénico ha sido
reportado en ausencia de reguladores del crecimiento (Choi
et al., 1998) así como en presencia
de otros reguladores del crecimiento, tales como las citocininas
(Sagare et al.,
2000), y de otro tipo de auxinas como el AIA, el cual en concentraciones
relativamente altas (1–2 mg L-1) ha mostrado estar asociado con el incremento
en la respuesta embriogénica de varias especies vegetales (Rajasekaran
et al., 1987); en Oncidium
(Orchidaceae) Cheng y Chang
(2000) reportaron el uso de dosis desde 3 hasta10 mg L-1 de 2,4-D en
combinación con TDZ (1-phenyl-3-(1,2,3-thidiazol-5-yl)-urea) para inducir callo
embriogénico y posteriormente ANA (ácido naftalén-acético) en combinación con TDZ, en explantes de hoja y ápices de raíz, para promover la
formación de embriones somáticos a partir del callo; en contraste, los
resultados obtenidos en nuestro trabajo, utilizando las auxinas ANA y AIA en
combinación con las citocininas BAP y Kin, mostraron la posibilidad de inducir callo embriogénico
y la posterior regeneración y proliferación de embriones somáticos en L. anceps ssp. dawsonii (Orchidaceae).
En general, la utilización de BAP con las
auxinas ANA y AIA, indujo la mejor respuesta tanto a la inducción de
morfogénesis como a la multiplicación eficiente de embriones somáticos, ya que al utilizar las citocininas
BAP y Kin en combinación con una sola auxina (ANA),
esta mayor dosis de citocininas provocó una
muy marcada disminución del
índice de multiplicación y la morfogénesis de los callos con una pobre
respuesta a la inducción, lo que demuestra el hecho de que un balance hormonal
tanto a favor de las auxinas como de las citocininas,
resulte adecuado para la multiplicación de los ESs,
en la especie estudiada, puede deberse a que las células de la periferia de la
semilla son las que responden para des diferenciarse, formar callo y luego dar
lugar a la formación de los embriones somáticos. Así, el crecimiento del explante hacia cualquier sentido, provocado por la acción
de las auxinas a nivel celular, provee
un área mayor de tejido, capaz de reaccionar al proceso de inducción y
formación de ESs. Estos resultados van de acuerdo con
las observaciones de Seeni y Latha
(1992) quienes reportaron que altas concentraciones de citocininas
en el medio de iniciación y de
multiplicación, pueden inhibir el enraizamiento. Por su parte, George y Sherrington (1984), también observaron que, los elevados
niveles endógenos de citocininas en algunas especies
inhiben el enraizamiento, por lo que se
requiere de varios subcultivos sin concentraciones
altas de citocininas a fin de reducirlos y suprimir
el bloqueo que ejerce su efecto. Por otra parte, es importante señalar que en nuestro caso, los ESs
no presentaron problema para la activación y desarrollo del ápice radical y el
ápice caulinar, obteniéndose la maduración y conversión de los embriones
somáticos en plántulas completas, cuando se
cultivaron en el medio de cultivo para multiplicación (MS suplementado
con ANA, BAP, AIA 2 mg L-1 de cada uno), después de 45 días de
iniciado el subcultivo, e incubado en fotoperiodo de
16/8 h. Martin (2003), trabajando en la propagación clonal
de Ipsea malabárica (Reichb
.f.) J. D. Hook, una orquídea silvestre amenazada, endémica de la India y Sri
Lanka, obtuvo resultados similares, reportando la inducción de raíces fuertes y
carnosas cuando las plántulas permanecían en
el medio de proliferación múltiple.
CONCLUSIONES
Se logró un mayor índice de
Multiplicación de los callos embriogénicos de Laelia anceps ssp. dawsonii con la combinación de reguladores de crecimiento ANA, BAP y AIA, 2
mg L-1 de cada uno, en el medio de cultivo MS.
Bajo condiciones de fotoperiodo de 16/8 h
se indujo morfogénesis en las semillas,
que formaron callos embriogénicos, que proliferaron y regeneraron embriones
somáticos cuando se realizan tres subcultivos sucesivas
a intervalos de 45 días. El papel de las auxinas en mayor número adicionadas al
medio de cultivo es importante para el control de la morfogénesis de los
callos, promoviéndola positivamente. Esta combinación de reguladores de
crecimiento en el medio MS, permite además la maduración y conversión de
embriones somáticos en plántulas completas, eliminando la necesidad de realizar
la fase de enraizamiento in vitro de
la micropropagación. Estos resultados integran un
protocolo inicial para la regeneración de
Laelia anceps ssp. dawsonii, relativamente
rápido y no implica el uso de medios de cultivo muy diversos, simplificando un
sistema de inducción de proliferación de embriones somáticos a partir de
semillas.
La regeneración de plantas del callo a
través de embriones somáticos en Laelia anceps ssp. dawsonii
puede ser útil para estudios posteriores, previa caracterización del proceso
embriogénico y con el objetivo de eficientizar el proceso de micropropagación.
AGRADECIMIENTOS
Los autores desean agradecer a Antonio
Bustos Melgarejo, por proporcionar las plantas de Laelia anceps ssp. dawsonii fuente
de explantes en este estudio, y a la Universidad
Veracruzana por el soporte financiero para la realización del presente
trabajo.
LITERATURA
CITADA
Avila, I. y R. Salgado. 2006. Propagación y mantenimiento in vitro de orquídeas mexicanas, para
colaborar en su conservación. Facultad de Biología de la Universidad Michoacana
de Hidalgo (Ed.). 8:138-149.
Bechtel, P. G. 1990. The Laelias of México.
American Orchid Society Bulletin. 59(12):1229-1234.
Cheng, J. T. and W. C. Chang. 2004a. Induction of repetitive embryogenesis
from seed-derived protocorms of Phalaenopsis amabilis var. Formosa Shimadzu. In vitro Cell. Dev. Biol. Plant.
40:290-293.
Cheng, J. T. and W. C. Chang. 2004b. TIBA affects the induction of direct
somatic embryogenesis from leaf explants of Oncidium.
Plant Cell, Tissue and Organ Culture 79:315-320.
Cheng, J. T. and W. C. Chang. 2003. Effects of GA3, ancymidol,
cycocel and paclobutrazol
on direct somatic embryogenesis of Oncidium in vitro.
Plant Cell, Tissue and Organ Culture 72:105-108.
Cheng, J. T. and W. C. Chang. 2000. Efficient plant regeneration through
somatic embryogenesis from callus cultures of Oncidium (Orchidaceae).
Plant Science 160:87-93.
Choi, Y. E.; D. C. Yang; J. C. Park; W. Y. Soh
and K. T. Choi. 1998. Regenerative ability of somatic single and multiple
embryos from cotyledons of Korean ginseng on hormone-free medium. Plant Cell
Rep. 17:544-551.
Dudits, D.; L. Bögre
and J. Györgyey. 1991. Molecular and cellular
approaches to the analysis of plant embryo development from somatic cells in vitro. J. Cell Sci. 99:475-484.
Fehér, A.; T. P. Pasternak and D. Dudits. 2003. Transition of somatic plant cells to an embryogenic state. Plant Cell, Tissue and Organ Culture
74:201-228.
George, E. F. and P. D. Sherrington. 1984. Plant propagation by tissue
culture. Exegetics Ltd. Eversley, England. 1333 p.
Halbinger, F. 1993. Laelias de México. Asociación Mexicana de Orquideología, A.C. (Ed.) México, D.F. 71 pp.
Huan, L. V.; T. Takamura and M. Tanaka. 2004. Callus
formation and plant regeneration from callus through somatic embryo structures
in Cymbidium orchid. Plant Science
166:1443-1449.
Knudson, L. 1946. A new nutrient
solution for germination of orchid seed. Am. Orchid Soc. Bull. 15: 214-217.
Lee, Y. I. and N. Lee. 2003. Plant regeneration from protocorm-derived
callus of Cypripedium formosanum.
In vitro Cell. Dev. Biol. Plant.
39:475-479.
Martin, K. P. 2003. Clonal propagation, encapsulation and reintroduction
of Ipsea malabarica (Reichb .f.) J.D. Hook., an endangered orchid. In vitro Cell. Dev. Biol. Plant
39:322–326.
Martin, K. P. and A. K. Pradeep. 2003. Simple
strategy for the in vitro
conservation of Ipsea malabarica an
endemic and endangered orchid of the Western Ghats of Kerala, India. Plant
Cell, Tissue and Organ Culture. 74:197-200.
Murashige, T. and F. Skoog.
Murthy, H. N. and A. N. Pyati. 2001. Micropropagation of Aerides maculosum Lindl. (Orchidaceae). In vitro Cell.
Dev. Biol. Plant.
37:223-226.
Norma Oficial Mexicana
NOM-059-ECOL-2001.2002. Protección ambiental-especies nativas de México de
flora y fauna silvestres: Categorías de riesgo y especificaciones para su
inclusión, exclusión o cambio: Lista de especies en riesgo. Diario Oficial (6
de marzo 2002), México, D.F.
Piven, N. M.; F. A. Barredo Pool,
I. C. Borges Argáez, M. A. Herrera Alamillo, A. Mayo
Mosqueda, J. L. Herrera and M. L. Robert. 2001. Reproductive biology of henequén (Agave fourcroydes) and its wild ancestor Agave angustifolia (Agavaceae). I.
Gametophyte development. American Journal of Botany. 88(11):1966-1976.
Potisek, M. C.; M. Sarmiento y L. N. Puc. 1996. Germinación
de semillas y su establecimiento in vitro
de Laelia rubescens Lindley y Epidendrum stamfordianum Batem. INIFAP.
CIR-SURESTE (Eds.) Campeche, Camp. México. 1:187-192.
Rajasekaran, K; M. B. Hein; G. C.
Davis, M. G. Carnes and I. K Vasil.1987. Exogenous growth regulators in
leaves and tissue cultures of Pennisetum purpureum Schum. J. Plant
Physiol. 130:13-25.
Rao, A. T. 1998. Conservation of
wild orchids of Kodagu in the Western Ghats.
Bangalore: The Technology Development and Agricultural Technologies and
Services Pvt. Ltd.; 242 p.
Sagare, A. P.; Y. L. Lee, T. C. Lin,
C. C. Chen and H. S. Tsay. 2000. Cytokinin-induced
somatic embryogenesis and plant regeneration in Corydalis yanhusuo (Fumariaceae)
– a medicinal plant. Plant Sci. 160:139-147.
Santos Hernández, L.;
M. Martínez García; J. E. Campos and E. Aguirre León.
SAS System. 1989–1997. Version 6.12, SAS Institute Inc., Cary, NC, USA.
Seeni, S. and P. G. Latha. 1992. Foliar regeneration of the endangered Red
Vanda, Renanthera imschootiana
Rolfe (Orchidaceae). Plant-Cell-Tissue-Organ-Culture
29(3):167-72.
Shimura, H. and Y. Koda. 2004. Micropropagation of Cypropedium macranthos var. rebunense
through protocorms-like bodies derived from mature
seeds. Plant Cell, Tissue and Organ Culture. 78:273-276.
Soto Arenas, M. A. 1993. Clasificación infraespecífica de Laelia anceps. Orquídea (Méx.) 11:233-277.
STATISTICA. 1998. STAT SOFT, Inc. Statistica
for Windows. Version 5. (Computer program manual). Statistica:
user guide. 2325 East 13th Street, Tulsa, Ok. 74104. USA.
Steel, R. G. and J. H. Torrie. 1980.
Principles and Procedures of Statistics a Biometrical Approach. 2nd Mc Graw Hill (Eds.). New York.
633 p.
Vacin, E. F. and F. W. Went. 1949.
Some pH changes in nutrient solutions. Botanical
Gazette, 110: 605-613.
Página diseñada por Prof. Jesús Rafael Méndez Natera
TABLA DE CONTENIDO DE LA REVISTA CIENTÍFICA UDO
AGRÍCOLA


