Revista Científica UDO Agrícola Volumen 7.
Número 1. Año 2007. Páginas: 228-236
Efecto del tipo de tutor
sobre el contenido de vainillina y clorofila en vainas de vainilla (Vanilla planifolia Andrews) en Tuxpan,
Veracruz, México
Effect of tutor type on vanillin and chlorophyll contents in Vanilla
beans (Vanilla planifolia Andrews) in
Tuxpan, Veracruz, México
Pablo ELORZA MARTÍNEZ ![]() 1,3, Maritza LÓPEZ HERRERA1,
Alma Delia HERNÁNDEZ FUENTES2, Gerardo OLMEDO PÉREZ3,
Consuelo DOMÍNGUEZ BARRADAS3 y José Manuel MARURI GARCÍA3
1,3, Maritza LÓPEZ HERRERA1,
Alma Delia HERNÁNDEZ FUENTES2, Gerardo OLMEDO PÉREZ3,
Consuelo DOMÍNGUEZ BARRADAS3 y José Manuel MARURI GARCÍA3
1Laboratorio de Morfofisiología Vegetal, Centro de
Investigaciones Biológicas (CIB), Universidad Autónoma del Estado de Hidalgo
(UAEH), Carretera Pachuca-Tulancingo s/n, Ciudad Universitaria. México. CP
42184; 2Instituto de Ciencias Agropecuarias de la Universidad Autónoma
del Estado de Hidalgo. Av. Universidad km. 1 Col. Rancho Universitario CP 43600
Tulancingo, Hidalgo y 3Universidad Veracruzana Facultad de Ciencias
Biológicas y Agropecuarias, Universidad Veracruzana. Km. 7,5 Carretera
Tuxpan-Tampico, Tuxpan, Veracruz, México. E-mails: pelorzam70@hotmail.com,
pelorza@uv.mx; maritza_lh2003@yahoo.com.mx; almadhf@yahoo.com.mx y
jmmarurig@hotmail.com ![]() Autor para correspondencia
Autor para correspondencia
|
Recibido: 29/10/2007 |
Fin de primer arbitraje: 21/11/2007 |
Primera revisión recibida: 25/11/2007 |
|
Fin de segundo arbitraje: 03/12/2007 |
Segunda revisión
recibida: 12/12/2007 |
Aceptado: 28/12/2007 |
RESUMEN
El cultivo de la vainilla se remonta a la época de los
Aztecas quienes lo cultivaban a bajas densidades de siembra, siendo hasta hace
menos de 10 años que se han explorado otros sistemas de sombreado para su
cultivo, destacando el sistema en casa sombra que proporciona hasta un 70% de
reducción de luz, utilizándose además Citrus,
Erythrina y Gliricidia. El objetivo fue determinar la influencia del tipo de
tutor sobre los contenidos de vainillina y clorofila en los frutos de la
vainilla. Se observó que el mayor contenido de clorofila se produjo en plantas
bajo los sistemas de Malla Sombra, seguido del tutor Erythrina, mientras que los sistemas con tutores de Citrus y Gliricidia produjeron los mayores valores de vainillina.
Palabras
clave: Vanilla planifolia, sombreado, vainillina, tutores
ABSTRACT
The vanilla crop
started in the time of the Aztecs who cultivated the vanilla under low plant
stands. Over the past 10 years, there has been a search for better ways of
giving shade to this crop. The Casa Sombra system seems to be the best way to
achieve this goal, been this system able to reduce light in 70%, also Citrus sp., Erythrina sp. and Gliricidia had been used as a tutor. The objective was to determine the
tutor influence on the vanillin and chlorophyll contents. It was observed that
the biggest chlorophyll content was produced on plants under the Casa Sombra
system followed by tutor Erythrina,
while Citrus and Gliricidia systems had the biggest vanillin contents.
Key words: Vanilla
planifolia, shading, vanillin, tutors
INTRODUCCIÓN
La vainilla, llamada en náhuatl,
“Tlixochitl”
que significa flor negra, era uno de los
tributos que exigían los aztecas
a los pueblos conquistados en los territorios del Este. Más adelante, con la
llegada de los europeos, la vainilla comenzó un largo peregrinar: las vainas
iban a España donde las utilizaban en la confección de perfumes y también para
aromatizar el chocolate, como hacían los indígenas mexicanos; la planta salió rumbo a
Inglaterra por el año 1800, para continuar más tarde hacia los jardines
botánicos franceses. La migración no se detuvo aquí y la vainilla siguió su
viaje hacia las islas del Océano Indico. Se estima que la vainilla es
originaria de América Tropical. De los
bosques tropicales de México, Centro América, la parte norte de Sur América y
Tahití.
Existen varias referencias sobre el uso de la vainilla por los aztecas, entre
ellas: Los que escupen sangre se curan bebiendo el
cacao hecho con aquella especie aromática que se llamaba “Tlixochitl”. Los indios Totonacas fueron los pioneros en el desarrollo
de la vainilla, cultivándola desde el siglo XII en la región Totonacapan y la
vainilla no sería conocida en el resto de la región Mexicana hasta 1427 y por
el resto del mundo en 1521 con el arribo de Hernán Cortés (Gaya, 2005). De
acuerdo a los datos históricos, las primeras noticias que se tienen de la
vainilla datan de los años 1427-1440 (Pérez, 1992).
Entre las especies de orquídeas, la
vainilla es una de las más importantes en el mercado nacional e internacional,
derivado de los grandes beneficios que de ella se adquieren (Curti, 1995). La
vainilla se utiliza en la elaboración de bebidas, postres, perfumes, licores,
cigarros y medicinas. Es el saborizante de mayor uso a nivel mundial (Gobierno
del Estado de Puebla, 2007). Aunque se encuentran muchos compuestos en el
extracto de vainilla, el responsable predominante de su característico olor y
sabor es la vainillina. Esta esencia se comercializa de dos formas: el extracto
proviene de la vaina incluyendo las semillas y la esencia sintética, más barata,
que consiste básicamente en una solución de vainillina sintética
(4-hidroxi-3-metoxibenzaldehído). Sin embargo, es difícil determinar la
diferencia entre ambas (Flores González, 2007). Valdez Flores y Cañizares
Macías (2007) indicaron que la extracción de vainillina a partir de vainilla es
un método muy largo y tedioso y que la eficiencia de extracción es mínima y por
lo tanto es costosa, así, los extractos artificiales son más vendidos porque
sintetizar vainilla es más barato, pero una ventaja de los extractos naturales
de vainilla con respecto a los extractos artificiales es la excelente propiedad
antioxidante.
La
vainilla se desarrolla en clima húmedo cálido.
Una precipitación de
En la actualidad los mayores productores
de vainilla son Madagascar e Indonesia. Se estima que, en México existen
aproximadamente
En el estado de Veracruz los municipios
productores son: Papantla de Olarte, Martínez de la Torre, Gutiérrez Zamora,
Tecolutla y Poza Rica de Hidalgo. Se estima que tan sólo la zona del
Totonacapan que comprende a esta región produjo el 80% de la producción total
de vainilla verde (Romeu, 1999). Se puede señalar que aunque
existen más de 110 especies de plantas de vainilla en el mundo, que pertenecen
a la familia de las orquidáceas, sólo cinco son productoras de la cápsula que
sirve para la elaboración de extractos aromáticos y dentro de estas se
encuentra Vanilla planifolia A. (Curti, 1995). El mercado exterior de la
vainilla tiene gran importancia económica en México, siendo los mercados de
Nueva York y Filadelfia, los que absorben casi el total de las exportaciones.
Los Estados Unidos, el principal consumidor mundial, prefiere la vainilla
mexicana que es considerada como la de mejor calidad comercial (Tapia, 2001).
La vainilla comienza a producir a partir
del tercer año desde la plantación y permanece en producción durante
Las características botánicas y las
necesidades de agua y nutrimentos de la planta, determinan que el suelo ideal
para el cultivo de la vainilla debe ser fértil, con abundante materia orgánica
y buen drenaje. El primer paso para
preparar el terreno de cultivo es la selección de tutores de la vainilla, los
cuales forman parte del huerto y son tan importantes como la misma planta de la
vainilla. Por lo tanto, se deben seleccionar meticulosamente y darles los
cuidados necesarios para su formación y los arbustos que serán seleccionados
como tutores deben cumplir dos funciones principales (Curti, 1995): (1)
Sostener la planta de la vainilla y (2) proporcionar la sombra necesaria para
su desarrollo. En los estados de Veracruz, Puebla y Oaxaca es posible encontrar
los siguientes sistemas de producción: a) en el hábitat natural (bosques
lluviosos tropicales); b) en asociación con árboles de naranja (Citrus sinensis), café (Coffea arabica), árbol de palma (Chamaedorea elegans) y otros cultivos y c) en sistemas intensivos como
monocultivos con pichoco (Erythrina)
y cocuite (Gliricidia) (Hernández
Hernández, 2005). La producción de vainilla en asociación con árboles de café (Coffea arabica), naranjo (Citrus sinensis), cocuite (Gliricidia sp.) y pichoco (Erythrina sp.) se inició en el Estado de
Puebla, México hace 6 años y está relacionada con la altura sobre el nivel del
mar. Es decir, que alturas entre
El naranjo dulce (C. sinensis) pertenece a la familia de las Rutaceae, es un árbol de
tronco robusto de tres a cinco metros de altura con denso follaje, hoja
perenne, flores perfumadas y fruto redondeado con la corteza rica en aceites y
esencias muy aromáticas que contienen una pulpa ácida y perfumada. Estos
árboles son originarios de Asia, en particular de China e India. En México se
siembran en estados con clima tropical: Veracruz, Tamaulipas, San Luis Potosí,
Hidalgo, Oaxaca, Nuevo León, Yucatán, Tabasco, Chiapas y Colima, entre otros
(Ibáñez Olea, 2007). Por su parte, G.
sepium pertenece a la familia de las Fabaceae (Leguminosae), es un árbol,
arbusto caducifolio, de
La vainilla, la cual cae dentro de la
categoría de plantas “amantes” de la sombra, muestra todas las características
típicas exhibidas por este grupo de plantas. Una alta intensidad de luz cayendo
sobre las plantas “amantes” de la sombra puede causar inactivación de los
centros de reacción acompañado por una inhibición del transporte de electrones
a través de los fotosistemas (Puthur, 2005).
El objetivo fue evaluar el efecto del
tipo de tutor sobre el contenido de vainillina y clorofila en vainilla en
Tuxpan, Veracruz, México.
MATERIALES Y
MÉTODOS
Se delimitó la zona de
cultivo, en la que se localizaron cuatro sitios por cada uno de los
tratamientos establecidos y los sistemas de cultivo en la zona, seleccionando
para ello en Tuxpan, Veracruz, México dadas las condiciones de homogeneidad en
la edad, variedad, suelos y clima que presenta.
Se
seleccionaron cuatro plantaciones establecidas con tutores diferentes, los
cuales conformaron los tratamientos: a) tutores artificiales: postes de madera
y/o concreto; b) Tutor Erythrina, c) Tutor Citrus sp. y d) Tutor Gliricidia. La cosecha se realizó cuando el fruto tomó un color
verde-amarillento opaco que se inicia en el ápice del fruto. Se midieron las
variables: a) Concentración de clorofila: se utilizaron hojas del tercio
superior de las plantas de vainilla en el tiempo de cosecha mediante el uso del
equipo SPAD 502(R). Los valores SPAD se basan en el principio de que
parte de la luz que llega a la hoja es absorbida por la clorofila y el resto
que se refleja entra en contacto con la celda detectora del SPAD-502 y es
convertida en una señal eléctrica. La cantidad de luz captada por la celda es
inversamente proporcional a la cantidad de luz utilizada por la clorofila, la
señal es procesada, y la absorbancia es cuantificada en valores dimensionales
que van de
Se
realizó un análisis de suelo en los cuatro tratamientos con el método 5 de
oros, es decir, se seleccionaron 5 puntos de muestreo, los puntos de muestreo
se ubicaron en forma de carta o naipe 5 de oros, un punto en cada esquina y uno
al centro del área estudiada (COFUPRO, 2005).
El
diseño experimental utilizado para la concentración de clorofila fue un
completamente aleatorizado con nueve repeticiones y a los resultados obtenidos
se les realizó el análisis de varianza y la prueba de la mínima diferencia
significativa. En el caso del contenido de vainillina sólo se realizaron dos
determinaciones debido al deterioro de las vainas en Italia.
RESULTADOS Y
DISCUSIÓN
Al estudiar las características
físico-químicas de los suelos donde se cultivaron las plantas de vainilla en
los cuatro tipos de tutores se pudo observar que los suelos con Gliricidia presentaron los mayores
contenidos de materia orgánica y nitrógeno, mientras que la mayor cantidad de
fósforo se observó en el suelo cultivado con Citrus, superando ampliamente a los otros tres tratamientos. El
contenido de potasio fue similar en los cuatro suelos. Por otra parte, se
reconoció que tres sitios poseen suelos franco-arcillosos y solo el de Gliricidia es arcilloso (Cuadro 1).
|
Cuadro 1. Propiedades
físico-químicas de los suelos en Tuxpan,
Veracruz, México bajo cuatro tipos de tutores en vainilla (Vanilla planifolia Andrews) en el
2007. |
||||
|
|
Tutores |
|||
|
Características |
Erythrina |
Gliricidia |
Tutor artificial + Malla Sombra |
Citrus |
|
Materia
Orgánica (%) |
2,58 |
4,24 |
3,75 |
3,41 |
|
Nitrógeno total (%) |
0,129 |
0,212 |
0,187 |
0,170 |
|
Fósforo (mg/kg de suelo) |
299,2 |
228,8 |
378,0 |
900,0 |
|
Potasio (cmol/kg de suelo) |
0,328 |
0,525 |
0,508 |
0,569 |
|
Textura |
Franco arcilloso |
Arcilloso |
Franco arcilloso |
Franco arcilloso |
El análisis de varianza para el contenido
de clorofila indicó diferencias significativas entre los tratamientos (Cuadro
2).
|
Cuadro
2. Análisis de varianza para el contenido de clorofila en vainilla (Vanilla planifolia Andrews) en Tuxpan,
Veracruz, México bajo cuatro tipos de tutores en el 2007. |
|||||
|
Fuente de |
Grados de |
Suma de |
Cuadrados |
|
|
|
Variación |
Libertad |
Cuadrados |
Medios |
F |
Probabilidad |
|
Tratamientos |
3 |
745,559 |
248,520 |
360,35 |
0,0000 * |
|
Error Experim. |
32 |
22,069 |
0,690 |
|
|
|
Total |
35 |
767,628 |
|
|
|
|
C. V. = 1,48 % |
|
|
|
|
|
|
* Significativo (p ≤ 0,01) |
|||||
El
mayor contenido de clorofila se observó en plantas cultivadas en tutores
artificiales (postes de madera y/o concreto) y malla sombra, seguido de
aquellas cultivadas bajo tutores de Erythrina. Los contenidos más bajos de clorofila se
observaron en plantas con los tutores Citrus
y Gliricidia (Cuadro 3). Estos resultados indicaron que el sistema
de cultivo con tutores artificiales y malla sombra, es el que mayor contenido
de clorofila presentó, lo cual a su vez sugiere que hubo una mayor asimilación
de nitrógeno ya que este último es parte fundamental de la molécula de
clorofila. Siendo esto atribuible a que en ningún momento de la fenología se
somete la planta a stress por exceso de luminosidad. Esto sugiere que los
tutores de madera y/o concreto y los de Erythrina proporcionan una
adecuada sombra a las plantas de vainilla debido a que usualmente las plantas “amantes”
de la sombra como la vainilla tienen más clorofila en sus hojas que plantas
adaptadas al sol, haciéndolas más susceptibles a la luz y hacer un mejor uso de
una cantidad reducida de luz, sin embargo, esta susceptibilidad no permitirá
una exposición directa a la luz solar por un tiempo prolongado (Universidad de
Nebraska, 2001). Es sabido que más sombra resulta en la síntesis de más
clorofila como una estrategia de adaptación para captar aún una luz débil la
cual alcanza a las hojas (Anderson, 1986).
La disminución en el contenido de clorofila en las plantas de vainilla en los tutores Citrus y Gliricidia podría deberse a que permitieron una mayor captación
de luz por parte de las plantas de vainilla, a pesar de existir un contenido
más alto de nitrógeno en el suelo en comparación con Erythrina. Esta disminución en el contenido de clorofila puede ser
un resultado de un incremento de la degradación de clorofila debido a que
plantas adaptadas a la sombra con ramas largas es sabido que reciben mucha luz
cuando se exponen a condiciones de luz alta pero debido a una falta de
canalización de esta energía en reacciones fotoquímicas, esta energía culminará
en la decoloración de la clorofila y esta energía no utilizada se desvía y
finalmente culmina en la producción de radicales libras, estos radicales libres
pueden causar daño al metabolismo de las plantas resultando en una tasa
retardada de síntesis (Powles, 1984; Anderson, 1986; Puthur, 2005). Por otra parte,
cuando una planta “amante” de la sombra recibe mucha luz ocurre un quemado de
las hojas, que causa la descomposición de la clorofila en las hojas y aparece
un daño con áreas pálidas o blancas (Garden Artisans. 2002). Las plantas con
características adaptativas a la sombra son altamente susceptibles a la alta
intensidad de luz.
|
Cuadro 3. Promedios para el contenido
de clorofila en vainilla (Vanilla
planifolia Andrews) en Tuxpan, Veracruz, México bajo cuatro tipos de
tutores en el 2007. |
||
|
Tratamientos |
Contenido de
Clorofila (Unidades SPAD) † |
|
|
TA+ MS ‡ |
62,81 |
A |
|
Tutor Erythrina |
57,49 |
B |
|
Tutor Citrus |
52,04 |
C |
|
Tutor Gliricidia |
51,69 |
C |
|
†
Prueba de la Mínima Diferencia Significativa (MDS). Letras diferentes indican
promedios estadísticamente diferentes (p ≤ 0,05). MDS = 0,80 %. ‡
TA = Tutores artificiales de madera o concreto MS = Malla Sombra |
||
Los
valores SPAD variaron entre 62,81% para los tutores artificiales + Malla sombra
y 51,69% para el tutor Gliricidia, a pesar
de que este último tuvo el mayor contenido del nitrógeno en el suelo,
sugiriendo que las plantas de vainilla aprovecharon en menor cantidad el
nitrógeno producido por el cultivo de esta leguminosa. Se ha encontrado una
alta correlación entre los valores de SPAD y el contenido de nitrógeno en las
hojas en otros cultivos: en tomate (Rodríguez Mendoza et al., 1998); en papa (Arregui et
al., 2000); en maíz (Novoa y Villagrán, 2002); en café (Rodrigues dos Reis et al., 2006) y en dos cultivares de Brachiaria (B. brizantha cv. Marandu y B.
decumbens cv. Basilisk (Carvalho Santos et
al., 2007).
En cuanto a los valores de SPAD
reportados por la literatura, Rodrigues dos Reis et al. (2006) indicaron valores entre 45 y 57 % para café. Pero muy
superiores a los reportados por Carvalho Santos et al. (2007) para Brachiaria
brizantha cv. Marandu y Brachiaria
decumbens cv. Basilisk con 23,0 y 20,1% respectivamente y Novoa y
Villagrán, (2002) en maíz con valores de
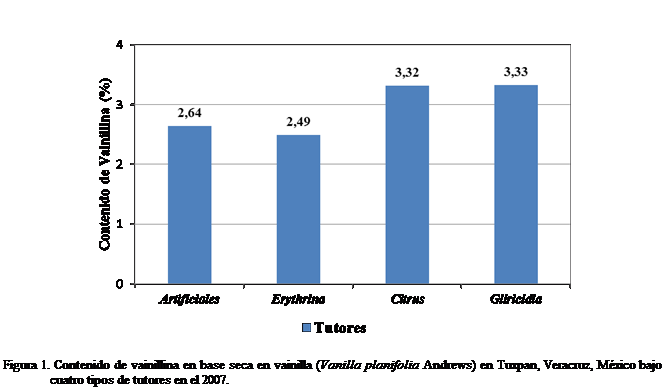
En relación a la variable contenido de
vainillina se pudo observar que en las plantas de vainilla cultivadas en los
tutores de Gliricidia y Citrus se presentaron los frutos con un
mayor contenido de vainillina. Mientras que aquellas plantas cultivadas bajo
tutores artificiales de concreto o madera y en tutores de Erythrina, produjeron frutos con un menor contenido (Figura 1). A
pesar de que los tutores artificiales + malla sombra fue uno de los
tratamientos que presentó un menor contenido de vainillina, esto se compensa
con el número de plantas/ha, toda vez que en malla sombra, la densidad de
siembra es el triple de la utilizada en los demás tutores sobre todo con respecto
al Citrus. Asimismo, la utilización
de casa sombra es una alternativa para la explotación de la vainilla para
extractos toda vez que se puede incrementar grandemente la densidad de siembra
y no se tiene el problema de los tutores de Gliricidia
y Erythrina los cuales son
caducifolios y eso provoca que la planta sea sometida a estrés cada vez que los
tutores dejan caer las hojas, teniendo plantas de mejor calidad en Citrus y por supuesto en las casas
sombra por mantener constante la cantidad de sombreado. En relación al menor
contenido de vainillina en las plantas de vainilla bajo Erytrina, Ramírez et al. (1999)
indicaron que en Costa Rica no existe un manejo adecuado de la sombra en
vainilla, por un lado no existe una sombra alta que proteja a las plantas de la
vainilla de los estragos del exceso de luz durante la estación seca y los
tutores que se utilizan (Erythrina
lanceolata), se defolian con facilidad ante el estrés hídrico, de esta
manera las plantas de vainilla sufren el exceso de exposición a la luz solar,
se blanquean y agobian. En las plantas bajo Gliricidia
y Citrus se presentaron valores
superiores 3,3 % de vainillina, Krishna Kumar (2004) y Mathew (2004) indicaron
que el contenido de vainillina de las vainas es tan alto como 3,5 %. A pesar de
que las plantas de vainilla con tutores de Erythrina
presentaron el menor contenido de vainillina, según López Méndez y Mara
García (2006) el árbol de mayor utilización como tutor es la leguminosa
conocida como “pichoco” Erythrina sp.
y se prefiere por la facilidad de enraizamiento y la rapidez con que ramifica y
forma el follaje para sombrear la vainilla desde que emergen los primeros
brotes.
En general, los contenidos de vainillina
son altos si se comparan con aquellos reportados en la literatura.
Rosado-Zarrabal et al. (2005a)
realizaron un estudio cuyo objetivo fue caracterizar las variables del proceso
y la evolución de glucovainillina, vainillina, p-hidroxibenzaldehido, acido
vainillico y ácido p-hidroxibenzoico durante el proceso de curado tradicional
de la vainilla en Cerro Quemado, Oaxaca, México durante más de cuatro meses en
dos cosechas diferentes (2003 y 2004) y encontraron que para los
pretratamientos, horneado e inmersión, el contenido de glucovainillina
disminuyó alrededor del 50 %. Sin embargo en el horneado no se encontró una
producción apreciable de vainillina mientras que en inmersión se obtuvo
En
otro experimento, Rosado-Zarrabal et al. (2005b)
analizaron el efecto de la temperatura y la humedad relativa en la evolución de
glucovainillina y los compuestos aromáticos en vainas de vainilla y encontraron
que la velocidad de degradación de la glucovainillina en todos los tratamientos
fue más rápida que la observada durante el beneficio tradicional. Los
resultados mostraron que para los tres tipos de marchitamiento (inmersión en
agua caliente, horneado en humedades altas y congelación), el tratamiento a
Todos los tratamientos a excepción de aquellas
plantas cultivadas bajo tutores de Erythrina
presentaron contenidos de vainillina superiores a 2,5, clasificándose como de
calidad extra, mientras que para Erythrina,
la clasificación es de una vainilla de primera (Pérez Silva et al., 2007). Según Naturland (2000)
las mejores calidades de frutos de vainilla acusan un contenido de humedad de
23-25% y de vainillina de 2,5% (en estado seco). Se observó que el mayor
contenido de vainillina en las vainas se dio en las plantas con menor contenido
de clorofila.
CONCLUSIONES
El mayor contenido de clorofila se
produjo en plantas bajo los sistemas de Malla Sombra, seguido del tutor Erythrina, mientras que los sistemas con
tutores de Citrus y Gliricidia produjeron las plantas de
vainilla con los mayores valores de vainillina.
LITERATURA
CITADA
Anderson, J.M., 1986. Photoregulation of
the composition, function, and structure of thylakoid membranes. Annual Review
of Plant Physiology 37: 93-136.
Arregui, L. M.; M. Merina y A. M.
Mingo Castel. 2000. Aplicación del
medidor portátil de clorofila en los programas de fertilización nitrogenada en
patata de siembra. En: Pascualena J. y Ritter E. (Editores). Libro de Actas del
Congreso Iberoamericano de Investigación y Desarrollo en Patata. Patata 2000. 3-6
Julio, Vitoria–Gastéis, España. p 157-170.
Association of Official Analytical Chemists (AOAC). 1995. Flavors.
Official methods of analysis. Vol. 2, 15th Edition. Arlington,
Virginia, U. S. A. p. 891.
Brito Fuentes, I del C. 2005. Zompantle
o colorín (Erythrina americana
Miller). Tlahui-Medic. 20 (2). Accesado 20
de Octubre de 2007. http://www.tlahui.com/medic/medic20/colorin.htm
Carvalho Santos, L.; P. Bonomo; J. Alves dos Santos, F. Martins de
Jesus; A, Dias Ferral y A. J. Vieira Pires. 2007. Concentração de nitrogênio em
folhas de dois cultivares de Braquiária através de leitura com o
clorofilômetro. REDVET Revista
Electrónica de Veterinaria. 8 (9): Septiembre. Accesado 15 de Octubre de 2007.
http://www.veterinaria.org/revistas/redvet/n090907.html
Coordinadora Nacional
de las Fundaciones Produce, A.C. (COFUPRO). 2005. Propuesta de Continuación
folio 11-2005-2660. Desarrollo de un sistema interactivo de apoyo a la toma de
decisiones para el manejo fitosanitario de los cultivos. 333/04. Accesado 01 de
Diciembre de 2007.http://www.sifp.org.mx/RELOAD/02.extenso/
reporteprintigral.php?sproyid=11-2005-2660& EtapaID=2005.
Curti, D. E. 1995.
Cultivo y beneficio de la vainilla en México. Organización Nacional de
Vainilleros Indígenas. Papantla. Ver. p. 96.
Flores González, M. A. 2007. Catálogo de propiedades
nutrimentales, nutracéuticas y medicinales de la vainilla. Gobierno del Estado
de Puebla. Secretaría de Desarrollo Rural. Coordinación General de Cadenas
Productivas. 12 p.
Flores González, M. A. 2007. Manual de las 100
preguntas para las personas interesadas en iniciar el cultivo de vainilla.
Gobierno del Estado de Puebla. Secretaría de Desarrollo Rural. 25 p.
Garden Artisans.
2002. Shade Gardening. July 2002 Newsletter. Accesado 16 de diciembre de 2007.
http://www.gardenartisans.us/newsletters/July2002.html.
Gaya, N. 2005. Mexican Vanilla. Resúmenes del III
Congreso Internacional de Vainilla, 15 y 16 de noviembre. Boca del Río,
Veracruz, México. Accesado 16 de septiembre de 2007. http://www.baktoflavors.com/Gaya_poster.html.
Gobierno del Estado de Puebla. 2007. Vainilla.
Secretaría de Desarrollo Rural. Coordinación General de Cadenas Productivas. 10
p.
Hernández Hernández, J. 2005. Vanilla production in
México. Resúmenes del III Congreso Internacional de Vainilla, 15 y 16 de
noviembre. Boca del Río, Veracruz, México. Accesado 16 de septiembre de 2007.
http://www.baktoflavors.com/vanilla2005/Hernandez_abstract.html.
Ibáñez Olea, J. 2007.
Cítricos de Tehuixtla, Morelos. Accesado 20 de septiembre de 2007. Accesado 16
de septiembre de 2007. http://www.mexicocampoadentro.org/citricos.php.
Instituto Nacional de
Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP). 1993. Manual de
Producción de Vainilla en el Estado de Veracruz”. Campo experimental Papantla.
Papantla, Veracruz, México. División Agrícola, Folleto para productores No. 6
(2da. Edición).
Krishna Kumar, P. K. 2004. Vanilla is no lemon. The New Indian Express. Accesado 30 de noviembre de 2007.
http://www.banajata.org/a/s22.htm.
Krugh, B., L. Bichham
y D. Miles. 1994. The solid-state chlorophyll meter, a novel instrument for rapidly
and accurately determining the chlorophyll concentrations in seedling leaves. Maize Genetics
Cooperation. News Letter 68: 25-27.
López Méndez, S. y B. Mata García. 2006. La vainilla en el Totonacapan,
símbolo de la sustentabilidad. Extensión al Campo 1 (2): 21-28.
Mathew, R. P. 2004. About vanilla situation, India. New Directions for
Agriculture in Reducing Poverty. Accesado
30 de noviembre de 2007. http://dfid-agriculture-consultation.nri.org/
maillists/global-trade/msg00025.html.
Naturland. 2000.
Vainilla. Agricultura Orgánica en el Trópico y Subtrópico. Guías de 18
cultivos. 18 p.
Novoa S., R.; y Villagrán
A., N. 2002. Evaluación de un instrumento medidor de clorofila en la
determinación de niveles de nitrógeno foliar en maíz. Agricultura Técnica
(Chile) 62 (1): 166 -171.
Pérez, S. 1992. La Vainilla. Ed. Consejo Nacional
para la cultura y las artes. México D.F. pp. 11-21.`
Pérez Silva, A.; E. Odoux y Z. Günata. 2007.
Producción, beneficio y perfil aromático de la vainilla de la región de
Tuxtepec. Revista AGROproduce 19: 19-25.
Powles, S.B.
1984. Photoinhibition of photosynthesis induced by visible light. Annual Review
of Plant Physiology 35: 15-44.
Puthur, J. 2005.
Influence of light intensity on growth and crop productivity of Vanilla planifolia Andr. General and
Applied Plant Physiology 31(3-4): 215-224.
Ramírez, C.; B. Rapidel y J. Mattey. 1999.
Principales factores agronómicos restrictivos en el cultivo de la vainilla y su
alivio en la zona de Quepos, Costa Rica. XI Congreso Nacional Agronómico, Costa
Rica. p. 309-313.
Rodrigues dos
Reis, A.; E. Furlani Junior; S. Buzetti e Andreotti, A. 2006. Diagnóstico da
exigência do cafeeiro em nitrogênio pela utilização do medidor portátil de
clorofila. Bragantia (Campinas) 65 (1): 163-171.
Rodríguez Mendoza, M.
de las N.; G. Alcántar González, A. Aguilar Santelises, J. D. Etchevers Barra y
J. A. Santizó Rincón, 1998. Estimación de la concentración de nitrógeno y
clorofila en tomate mediante un medidor portátil de clorofila. Revista Terra
Latinoamericana 16 (2): 135-141.
Romeu, E. 1999. La vainilla: de Papantla a Papantla,
el regreso de un cultivo. Accesado 30 de noviembre de 2007. http://
www.Conabio.gob.mx/ biodiversitas/Vainilla.
Rosado Zarrabal, T. L.; P. Brat, E. Odoux, Z. Günata, M. A. Salgado
Cervantes, V. J. Robles Olvera, M. A García Alvarado y G. C. Rodríguez Jimenes.
2005a. Evolución de la glucovainillina y
de los compuestos aromáticos durante el proceso tradicional de beneficiado de
vainilla (Vanilla planifolia A.) en
México. Resúmenes del III Congreso Internacional de Vainilla, 15 y 16 de
noviembre. Boca del Río, Veracruz, México. Accesado 16 de septiembre de 2007.
http://www.baktoflavors.com/vanilla2005/Zarrabal_abstract_es.html.
Rosado Zarrabal, T.
L.; P. Brat, E. Odoux, Z. Günata, M. A. Salgado Cervantes, V. J. Robles Olvera,
M. A García Alvarado y G. C. Rodríguez Jimenes. 2005b. Efecto de la temperatura
y humedad relativa en la evolución de glucovainillina y compuestos aromáticos
en vainilla Mexicana (Vanilla planifolia
A.). Resúmenes del III Congreso Internacional de Vainilla, 15 y 16 de
noviembre. Boca del Río, Veracruz, México. Accesado 16 de septiembre de 2007.
http://www.baktoflavors.com/vanilla2005/Zarrabal2_abstract_es.html.
Tapia C. E. 2001.
Zonificación agroecológica para el cultivo de la vainilla (Vanilla planifolia Andrews), en el distrito de desarrollo rural 003
de Martínez de la Torre, Veracruz. Universidad Veracruzana, Facultad de
Ciencias agrícolas, Xalapa. Veracruz.
Valdez Flores, C. and M. P. Cañizares Macias. 2007. On-line dilution and detection of vainillin in
vanilla extracts obtained by ultrasound. Food Chemistry 105: 1201–1208.
Vázquez Yanes, C.; A. I. Batis Muñoz, M. I. Alcocer
Silva, M. Gual Díaz y C. Sánchez Dirzo. 1999. Árboles y arbustos nativos
potencialmente valiosos para la restauración ecológica y la reforestación.
Reporte Técnico del Proyecto J-084 – CONABIO. Instituto de Ecología,
Universidad Nacional Autónoma de México. México D. F., México. p. 115-120.
Universidad de Nebraska. 2001. Shade gardening. Horticulture Paradise
News Release. September. Accesado 16 de
diciembre de 2007. http://hortparadise.unl.edu/Newsrelease/News/ShadeGardening.htm.
Página diseñada por Prof. Jesús Rafael Méndez Natera
TABLA DE CONTENIDO DE LA REVISTA CIENTÍFICA UDO
AGRÍCOLA



