Revista Científica UDO Agrícola Volumen 6.
Número 1. Año 2006. Páginas: 128-137
Lista actualizada de los gasterópodos de la planicie del Arrecife
Lobos, Veracruz, México
Updated checklist of
gastropods from flat Lobos
Francisco Vicencio de
Laboratorio de Arrecifes Coralinos. Escuela
de Biología. Facultad de Ciencias Biológicas y Agropecuarias. Zona Poza
Rica-Tuxpan. Universidad Veracruzana. Carretera. Tuxpan-Tampico Km. 7,5.
Tuxpan, Veracruz, México.
Email: vicenciodelacruz@gmail.com y
cggandara@hotmail.com * Autor para correspondencia
|
Recibido: 06/09/2006 |
Fin de arbitraje: 09/08/2006 |
Revisión
recibida: 28/11/2006 |
Aceptado:
21/12/2006 |
RESUMEN
Se
presenta la lista actualizada de los gasterópodos asociados a la planicie del
Arrecife Lobos, Veracruz, México (21°
Palabras clave: Taxonomía, Gasterópodos, Arrecife Lobos, Veracruz,
México.
ABSTRACT
An updated checklist of gastropods
from flat Lobos reef,
Key words: Taxonomy, Gastropods, Lobos Reef, Veracruz,
México.
INTRODUCCIÓN
Los
arrecifes coralinos son uno de los ecosistemas más diversos y complejos del
planeta, están compuestos principalmente de rocas calcáreas que se han
depositado en un proceso que ha durado millones de años (García-Cubas et al., 1994). Se localizan en
mares tropicales y son esencialmente flora y fauna, consistentes de corales hermatípicos y algas microscópicas a las que viven
asociadas una gran cantidad de habitantes arrecifales
bentónicos y nectónicos (Quintana y Molina, 1991).
Estos ecosistemas marinos son sumamente frágiles y
vulnerables a las intervenciones humanas de toda índole (Chávez e Hidalgo,
1988). Por ejemplo, los arrecifes coralinos que se sitúan frente al puerto de
Veracruz están sujetos a un intenso tráfico portuario y a la descarga de aguas
fluviales y negras (García-Cubas et al.,
1994) y a una gran presión de pesca (Vargas-Hernández et al., 2002). Otros sistemas ubicados en el norte de Veracruz, han
sido afectados por las actividades de exploración y producción de petróleo
(Chávez e Hidalgo, 1988) y posiblemente por el drenaje doméstico, la carga y
descarga de combustible y el turismo (González-Gándara, 2003).
El conocimiento que se tiene acerca de las comunidades
biológicas ligadas a los arrecifes veracruzanos es escaso, particularmente para
los que se ubican en el norte de Veracruz, donde los estudios sobre
gasterópodos reportan datos sobre composición y distribución (Chávez et al., 1970; Sánchez-Islas, 1970;
Guadarrama, 1973; Sevilla-Hernández et al.,
1983; García et al., 1994 y
Sevilla-Hernández, 1998). Sin embargo, el inventario de este grupo está
incompleto, por lo cual, este trabajo contribuye actualizando la lista de
especies de gasterópodos presentes en la planicie arrecifal
de Lobos, Veracruz, México.
MATERIALES
Y MÉTODOS
Área de estudio: el arrecife Lobos se localiza en el
norte del estado de Veracruz, México y sus coordenadas de referencia son: 21°
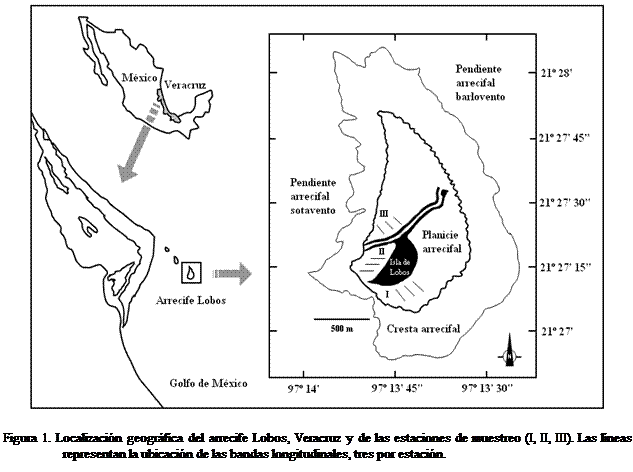
Para obtener el inventario de gasterópodos se
realizaron: (a) muestreos aleatorios en diferentes ambientes (comunidades de algas,
esponjas, corales, praderas de pastos marinos, restos de coral muerto, rocas y
zona supralitoral) de la planicie arrecifal
durante las primeras semanas de abril y octubre de 2003 y (b) muestreos
sistemáticos sobre bandas longitudinales de
Los organismos vivos se fijaron en formol al 10 % y se
preservaron en alcohol etílico al 70 % (Cruz-Abrego et al., 1994). La determinación de las especies de gasterópodos se
realizó utilizando las obras de: Warmke y Abbott
(1961), Abbott y Morris (1995) y Abbott (1996). El arreglo sistemático a nivel
de familia sigue a Rosenberg (2005), mientras que
géneros y especies se ordenaron alfabéticamente. El material biológico quedó
incorporado al Laboratorio de Arrecifes Coralinos (LAC) de
RESULTADOS
Se registraron 77 especies pertenecientes a 65 géneros
y 37 familias. Cenchritis muricata, Caecum plicatum, Bursa granularis, Melanella conoidea, Aplysia parvula, Elysia subornata, Tridachia crispata y Diacavolinia longirostris constituyen nuevos
registros para el arrecife Lobos. Al
adicionar esta información a los datos publicados anteriormente, el número
total de especies de gasterópodos en esta localidad es de 171, distribuidas en
120 géneros y 61 familias. Las familias
con mayor riqueza específica son: Pyramidellidae (12
especies), Caecidae (11 especies), Fissurellidae (10 especies) y Rissoidae
(8 especies). La lista actualizada de gasterópodos se refiere en el Cuadro 1.
|
Cuadro 1. Listado sistemático de los gasterópodos
del arrecife Lobos, Veracruz, de acuerdo al criterio de Rosenberg
(2005). Entre corchetes se citan los autores que han registrado a las
especies previamente: Chávez et al.
(1970) [1]; Sánchez-Islas (1970) [2]; Guadarrama (1973) [3];
Sevilla-Hernández et al. (1983)
[4]; García et al. (1994) [5]; Sevilla-Hernández (1998) [6]; el
presente estudio [7]. Con un asterisco (*) se señala los nuevos registros. |
||
|
Familia |
Género |
Especie |
|
Lottiidae |
Patelloida |
Patelloida pustulata (Helbling, 1779) [6,7] |
|
Scissurellidae |
Sinezona |
Sinezona confusa Rolán y Luque, 1994 [6] |
|
Fissurellidae |
Diodora |
Diodora cayenensis (Lamarck, 1822) [2,5,7] |
|
|
|
Diodora listeri (d'Orbigny, 1848) [6] |
|
|
|
Diodora minuta (Lamarck, 1822) [5] |
|
|
|
Diodora sayi (Dall, 1889) [1] |
|
|
|
Diodora variegata (Sowerby II, 1862) [1,2,5] |
|
|
Emarginula |
Emarginula pumila A. Adams, 1852 [1,2] |
|
|
|
Emarginula tuberculosa Libassi,
1859 [6] |
|
|
Fissurella |
Fissurella sp [5] |
|
|
Lucapina |
Lucapina suffusa (Reeve, 1850) [1] |
|
|
Rimula |
Rimula frenulata (Dall, 1889) [2,6] |
|
Trochidae |
Pseudostomatella |
Pseudostomatella coccinea (Adams, 1850)
[6] |
|
|
Tegula |
Tegula fasciata (Born, 1778) [1,2] |
|
|
|
Tegula lividomaculata (C. B. Adams, 1845) [2] |
|
Turbinidae |
Astralium |
Astralium phoebium (Röding, 1798) [6] |
|
|
Lithopoma |
Lithopoma tectum (Lightfoot, 1786) [1,5,7] |
|
Neritidae |
Nerita |
Nerita fulgurans Gmelin, 1791 [1,5] |
|
|
|
Nerita tessellata Gmelin, 1791
[1,7] |
|
|
|
Nerita versicolor Gmelin, 1791 [1,7] |
|
|
Neritina |
Neritina usnea (Röding, 1798) [1,5] |
|
|
|
Neritina virginea (Linné, 1758) [1,2,7] |
|
|
Smaragdia |
Smaragdia viridis (Linné, 1758) [1,5,6,7] |
|
Phenacolepadidae |
Plesiothyreus |
Plesiothyreus hamillei (P. Fischer, 1857) [2] |
|
Batillariidae |
Batillaria |
Batillaria minima (Gmelin, 1791) [1] |
|
Cerithiidae |
Bittiolum |
Bittiolum varium (Pfeiffer, 1840) [1,7] |
|
|
Cerithium |
Cerithium atratum (Born, 1778) [2,5,7] |
|
|
|
Cerithium eburneum Bruguiere, 1792 [1,2,5,7] |
|
|
|
Cerithium litteratum (Born, 1778) [1,2,5,6,7] |
|
|
|
Cerithium lutosum Menke, 1828 [1,2,7] |
|
Litiopidae |
Alaba |
Alaba incerta (d'Orbigny, 1841)
[1,5,6,7] |
|
Modulidae |
Modulus |
Modulus modulus (Linné, 1758)
[1,6,7] |
|
Planaxidae |
Angiola |
Angiola lineata (da Costa, 1778) [1,7] |
|
Potamididae |
Cerithidea |
Cerithidea sp [2] |
|
Scaliolidae |
Finella |
Finella dubia (d'Orbigny, 1840) [2,7] |
|
Turritellidae |
Vermicularia |
Vermicularia fargoi Olsson, 1951 [2] |
|
|
|
Vermicularia knorrii
(Deshayes,
1843) [1] |
|
Vermetidae |
Petaloconchus |
Petaloconchus erectus (Dall, 1888) [2] |
|
Littorinidae |
Cenchritis |
*Cenchritis muricata (Linné, 1758) [7] |
|
|
Echinolittorina |
Echinolittorina ziczac (Gmelin, 1791) [1,5,7] |
|
|
Littoraria |
Littoraria angulifera (Lamarck, 1822) [1,7] |
|
|
|
Littoraria nebulosa
(Lamarck, 1822) [1] |
|
Caecidae
|
Caecum |
Caecum antillarum Carpenter,
1858 [2,3] |
|
|
|
Caecum circumvolutum Folin, 1867 [6,7] |
|
|
|
Caecum condylum Moore, 1969 [3] |
|
|
|
Caecum cooperi S. Smith, 1860 [3] |
|
|
|
Caecum cycloferum de Folin, 1867 [3,6] |
|
|
|
Caecum imbricatum Carpenter,
1858 [2] |
|
|
|
*Caecum plicatum Carpenter,
1858 [7] |
|
|
|
Caecum pulchellum Stimpson, 1851 [2,6,7] |
|
|
|
Caecum textile Fölin,
1867 [6] |
|
|
Meioceras |
Meioceras cornucopiae Carpenter, 1858 [2,3] |
|
|
|
Meioceras nitidum (Stimpson, 1851) [3,6,7] |
|
Hydrobiidae |
Littoridina |
Littoridina sp [2] |
|
Rissoidae |
Alvania |
Alvania auberiana
(d'Orbigny,
1842) [1,2,4,5,6,7] |
|
|
Rissoina |
Rissoina cancellata Philippi,
1847 [2,4,6,7] |
|
|
|
Rissoina decussata (Montagu,
1803) [2,4,6] |
|
|
Schwartziella |
Schwartziella bryerea (Montagu, 1803)
[1,4,5,6,7] |
|
|
|
Schwartziella chesnelii (Michaud, 1830) [2] |
|
|
|
Schwartziella fischeri (Desjardin, 1949)
[1,4,5,6,7] |
|
|
Stosicia |
Stosicia aberrans (C. B. Adams, 1850) [2,4,6,7] |
|
|
Zebina |
Zebina browniana (d'Orbigny, 1842) [1,4,5,6,7] |
|
Vitrinellidae |
Cochliolepis |
Cochliolepis parasitica Stimpson, 1858 [6,7] |
|
|
Cyclostremiscus |
Cyclostremiscus pentagonus (Gabb, 1873) [6,7] |
|
Strombidae |
Eustrombus |
Eustrombus gigas (Linné, 1758) [1,5] |
|
|
Strombus |
Strombus alatus Gmelin,
1791 [1,5,7] |
|
|
Tricornis |
Tricornis raninus (Gmelin, 1791) [1,5,7] |
|
Calyptraeidae |
Calyptraea |
Calyptraea centralis (Conrad, 1841) [2] |
|
|
Crepidula |
Crepidula fornicata (Linné, 1758) [1,5] |
|
|
Cheilea |
Cheilea equestris (Linné, 1758) [6] |
|
Hipponicidae |
Hipponix |
Hipponix sp [5] |
|
Cypraeidae |
Erosaria |
Erosaria acicularis (Gmelin, 1791) [1] |
|
|
Luria |
Luria cinerea (Gmelin, 1791) [1,7] |
|
|
Macrocypraea |
Macrocypraea zebra (Linné, 1758) [1,7] |
|
Ovulidae |
Cyphoma |
Cyphoma gibbosum (Linné, 1758) [1] |
|
Triviidae |
Niveria |
Niveria suffusa (Gray, 1827) [2] |
|
Naticidae |
Neverita |
Neverita duplicata (Say, 1822) [1,5] |
|
|
Polinices |
Polinices lacteus (Guilding, 1834)
[1,2,5,6,7] |
|
|
Tectonatica |
Tectonatica pusilla (Say, 1822) [1] |
|
Bursidae |
Bursa |
*Bursa granularis (Röding, 1798) [7] |
|
Cassidae |
Sconsia |
Sconsia striata (Lamarck, 1816) [5] |
|
|
Semicassis |
Semicassis cicatricosa (Gmelin, 1791) [1] |
|
|
|
Semicassis granulata (Born, 1778) [1] |
|
|
Cypraecassis |
Cypraecassis testiculus (Linné, 1758) [1,5,7] |
|
Personidae |
Distorsio |
Distorsio clathrata (Lamarck, 1816) [1] |
|
Ranellidae |
Cymatium |
Cymatium aquatile (Reeve,
1844) [1,7] |
|
|
|
Cymatium cynocephalum (Lamarck, 1816) [1,5] |
|
|
|
Cymatium muricinum (Röding,
1798) [1] |
|
|
|
Cymatium nicobaricum (Roding, 1798) [1,5,7] |
|
|
|
Cymatium vespaceum (Lamarck, 1822) [1,7] |
|
|
Charonia |
Charonia variegata (Lamarck, 1816) [1,5,7] |
|
Tonnidae |
Tonna |
Tonna galea (Linné, 1758) [5] |
|
|
|
Tonna pennata (Mörch, 1852) [1,5,7] |
|
Epitoniidae |
Epitonium |
Epitonium candeanum (d'Orbigny,
1842) [1,7] |
|
|
|
Epitonium echinaticosta
(d'Orbigny,
1842) [6] |
|
|
|
Epitonium lamellosum (Lamarck, 1822) [1] |
|
|
|
Epitonium multistriatum (Say, 1826)
[6,7] |
|
|
Opalia |
Opalia burryi Clench and Turner, 1950 [6] |
|
|
|
Opalia pumilio (Mörch, 1875) [6] |
|
Janthinidae |
Janthina |
Janthina janthina (Linné, 1758) [1,5] |
|
Eulimidae |
Balcis |
Balcis sp [2] |
|
|
Eulima |
Eulima fulvocincta C. B. Adams, 1850 [2,7] |
|
|
Melanella |
*Melanella
conoidea (Kurtz and Stimpson, 1851) [7] |
|
Cerithiopsidae |
Cerithiopsis |
Cerithiopsis albovittata (C. B. Adams, 1850) [1,6] |
|
|
|
Cerithiopsis greenii (C. B. Adams, 1839) [1,2,6,7] |
|
|
Retilaskeya |
Retilaskeya bicolor
(C. B. Adams, 1845) [1,2,7] |
|
|
Seila |
Seila adamsii (H.C. Lea, 1845) [2,6] |
|
Triphoridae |
Cosmotriphora |
Cosmotriphora melanura (C. B. Adams, 1850) [6] |
|
|
Iniforis |
Iniforis turristhomae (Holten, 1802) [2,6] |
|
|
Marshallora |
Marshallora nigrocincta (C. B. Adams, 1839) [2,6] |
|
Muricidae |
Mancinella |
Mancinella deltoidea (Lamarck, 1822) [1,5,7] |
|
|
Trachypollia |
Trachypollia nodulosa (C. B. Adams, 1845) [1,2,5,6,7] |
|
|
Stramonita |
Stramonita haemastoma (Linné, 1767) [1,5] |
|
|
|
Stramonita rustica
(Lamarck, 1822) [1] |
|
Coralliophilidae |
Coralliophila |
Coralliophila aberrans (C.B. Adams, 1850) [1] |
|
|
|
Coralliophila galea (Dillwyn, 1823) [1] |
|
Columbellidae |
Columbella |
Columbella mercatoria (Linné, 1758) [1,2,5,6,7] |
|
|
Cosmioconcha |
Cosmioconcha nitens (C. B. Adams, 1850) [6] |
|
|
Nitidella |
Nitidella nitida (Lamarck, 1822) [1,6,7] |
|
|
Parvanachis |
Parvanachis obesa (C.
B. Adams 1845) [2,7] |
|
Buccinidae |
Antillophos |
Antillophos candeanus (d`Orbigny 1842) [2] |
|
|
Bailya |
Bailya intricata (Dall, 1884) [1,5,6,7] |
|
|
Colubraria |
Colubraria testacea (Mörch, 1854) [1,7] |
|
|
Engina |
Engina turbinella (Kiener, 1836) [1,6] |
|
|
Engoniophos |
Engoniophos unicinctus (Say, 1826) [6,7] |
|
|
Pisania |
Pisania pusio (Linné, 1758) [1,5,7] |
|
|
Pollia |
Pollia tincta Conrad,
1846 [1,7] |
|
Fasciolariidae |
Fasciolaria |
Fasciolaria lilium hunteria (G.
Perry, 1811) [1] |
|
|
|
Fasciolaria tulipa (Linné, 1758) [1,5] |
|
|
Pleuroploca |
Pleuroploca gigantea (Kiener, 1840) [1] |
|
Melongenidae |
Busycon |
Busycon sinistrum Hollister, 1958 [1,5] |
|
|
Busycotypus |
Busycotypus spiratus (Lamarck, 1816) [1,5] |
|
Nassariidae |
Nassarius |
Nassarius albus (Say, 1826) [1,7] |
|
Mitridae |
Mitra |
Mitra nodulosa (Gmelin, 1791) [1,5,7] |
|
Olividae |
Oliva |
Oliva sayana Ravenel, 1834 [5] |
|
|
|
Oliva scripta Lamarck, 1811 [1] |
|
Turbinellidae |
Turbinella |
Turbinella angulata (Lightfoot, 1786) [1,5] |
|
Cystiscidae |
Gibberula |
Gibberula lavalleana (d'Orbigny, 1842)
[1,2,6,7] |
|
Conidae |
Conus |
Conus anabathrum Crosse, 1865 [5] |
|
|
|
Conus mus Hwass, 1792 [1,5] |
|
|
|
Conus spurius Gmelin,
1791 [1,5] |
|
Turridae |
Crassispira |
Crassispira sp [1,5] |
|
Architectonicidae |
Architectonica |
Architectonica nobilis Roding, 1798 [1] |
|
|
Heliacus |
Heliacus cylindricus (Gmelin,
1791) [1] |
|
Pyramidellidae |
Boonea |
Boonea impressa (Say, 1822) [1] |
|
|
|
Boonea bisuturalis (Say, 1822) [6,7] |
|
|
|
Boonea seminuda (C. B. Adams, 1839) [1,5] |
|
|
Chrysallida |
Chrysallida terryi (Olsson & McGinty, 1958) [6] |
|
|
Odostomia |
Odostomia solidula C. B. Adams, 1850 [6] |
|
|
Peristichia |
Peristichia agria Dall, 1889 [6] |
|
|
Pseudoscilla |
Pseudoscilla babylonia (C. B. Adams, 1845) [2,6,7] |
|
|
Stylopsis |
Stylopsis resticula (Dall, 1889) [6] |
|
|
Turbonilla |
Turbonilla abrupta Bush
1899 [1,2,5,6,7] |
|
|
|
Turbonilla interrupta (Totten, 1835) [1,2,5,7] |
|
|
|
Turbonilla substriata (C. B. Adams, 1850) [6] |
|
|
Triptychus |
Triptychus niveus (Mörch, 1875) [2,6,7] |
|
Bullidae |
Bulla |
Bulla striata Bruguière, 1792 [1,2,5,6,7] |
|
Haminoeidae |
Atys |
Atys riiseanus Mörch,
1875 [6,7] |
|
|
Haminoea |
Haminoea antillarum (d'Orbigny,
1841) [5] |
|
|
|
Haminoea elegans (Gray, 1825) [1,7] |
|
|
|
Haminoea succinea (Conrad, 1846) [6] |
|
Cylichnidae |
Acteocina |
Acteocina candei (d'Orbigny, 1841) [2,7] |
|
Retusidae |
Pyrunculus |
Pyrunculus caelatus (Bush, 1885) [6] |
|
Aplysiidae |
Aplysia |
Aplysia dactylomela Rang,
1828 [1,7] |
|
|
|
*Aplysia parvula Morch, 1863 [7] |
|
|
|
Aplysia willcoxi Heilprin,
1886 [1] |
|
|
Bursatella |
Bursatella leachii Blainville, 1817 [1] |
|
Elysiidae |
Elysia |
*Elysia subornata A. E.
Verril, 1901 [7] |
|
|
Tridachia |
*Tridachia crispata (Mörch, 1863) [7] |
|
Cavoliniidae |
Diacavolinia |
*Diacavolinia longirostris (Blainville, 1821) [7] |
|
Siphonariidae |
Siphonaria |
Siphonaria pectinata (Linné, 1758) [1,5,7] |
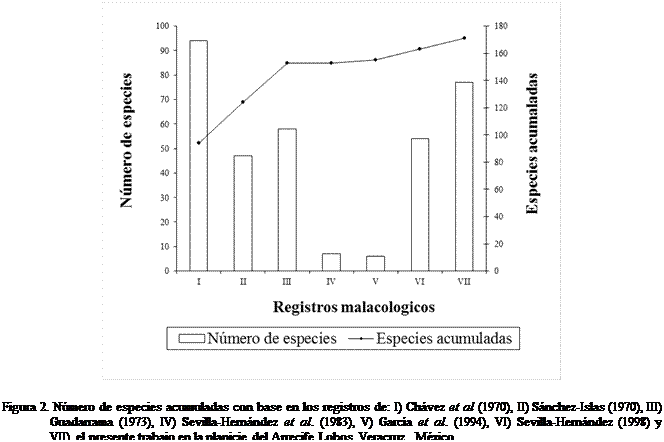
La composición específica reportada previamente se
incrementa en un 4,7 % con los registros del presente trabajo. En la figura 2
se presenta el número de especies registradas por autor y una curva acumulativa
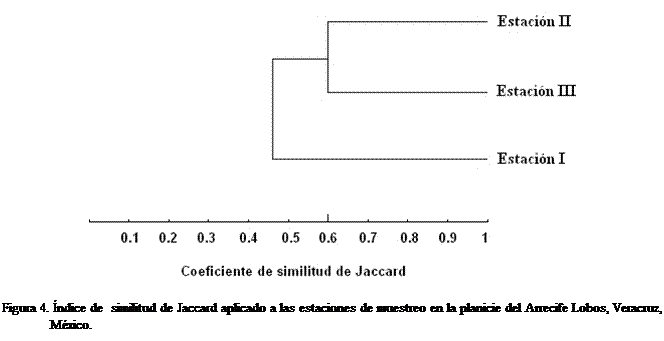
de especies. La riqueza malacológica fue mayor en la estación I y menor en las
estaciones II y III (Figura 3) las cuales son parecidas de acuerdo al índice de
Jaccard (Figura 4).
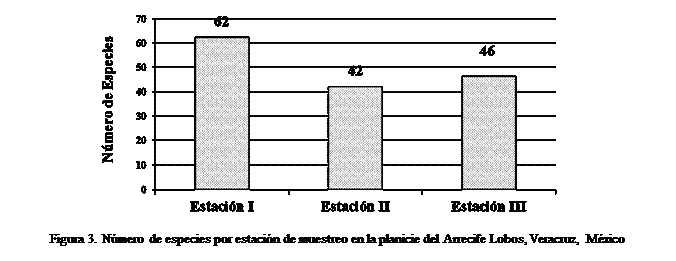
DISCUSIÓN
El inventario de los gasterópodos bentónicos en
arrecifes coralinos depara ciertas dificultades (Álvarez, 1998), por lo que la
toma de muestras sedimentológicas resulta conveniente como complemento
(García-Cubas, 1981; García-Cubas y Reguero, 1990; 1995) debido a que permite
el registro de especies pequeñas que enriquecen los inventarios malacológicos.
Sin embargo, esta estrategia incluye conchas vacías que han sido transportadas postmortem, las
cuales presentan señales de disolución y fragmentación variable en función de
la especie, además de que tienden a depositarse en forma diferencial de acuerdo
a su peso, tamaño y la velocidad de las corrientes (Sevilla-Hernández et al., 1983).
El muestreo sedimentológico ha sido empleado en los
trabajos previos, con cantidades variables desde
La malacofauna registrada en
este trabajo aunado a los reportes de Chávez et al. (1970); Sánchez-Islas (1970); Guadarrama (1973);
Sevilla-Hernández et al. (1983);
García et al. (1994) y
Sevilla-Hernández (1998) hacen un total de 171 especies, dato que es menor al
reconocido para el arrecife Alacranes, donde se registran 249 especies y mayor
que el número registrado para Cayo Arcas (110 especies) (Rosenberg,
2005). Estos contrastes pueden explicarse por las diferentes estrategias
metodológicas y de esfuerzo de muestreo. En el presente estudio no se detectó
la presencia de Eustrombus
gigas, Fasciolaria tulipa, Pleuroploca
gigantea y Turbinella angulata, previamente registradas
por Chávez et al. (1973) y que son
extraídas para consumo humano y ya se consideran amenazadas por extracción en
otras regiones del Golfo de México y el Caribe (Pérez-Pérez y Aldana-Aranda,
2000; de Jesús-Navarrete, 2001 y Aldana-Aranda et al., 2003). Esta
situación puede ser resultado de las actividades de pesca y turismo que se
practican en al arrecife Lobos (González-Gándara, 2003). Con los nuevos
registros de especies, se amplia el ámbito de
distribución en México para A. parvula, E. subornata y T. crispata.
CONCLUSIONES
Un total de 77 especies de gasterópodos
pertenecientes a 65 géneros y 37 familias fueron recolectados en esta
investigación.
Cenchritis muricata, Caecum plicatum, Bursa granularis, Melanella conoidea, Aplysia parvula, Elysia subornata, Tridachia crispata y Diacavolinia longirostris son registradas por primera vez
para el arrecife Lobos, Veracruz, México.
La fauna de gasterópodos del Arrecife Lobos está
conformada hasta el presente trabajo por 171 especies, 120 géneros y 61
familias.
AGRADECIMIENTOS
A los revisores anónimos por sus comentarios y
sugerencias. A
LITERATURA
CITADA
Abbott,
T. R.
Abbott,
T. R. and P. A. Morris. 1995. Shells of the Atlantic and
Aldana-Aranda, D., M. Sánchez-Crespo,
V. Patiño-Suárez, A. George-Zamora, E. Baqueiro-Cárdenas,
E. Carillo y S. Pérez. 2003. Abundancia, frecuencia de tallas y distribución
espacial del caracol rosa Strombus gigas en
el parque Xel-Há, México. pp. 47-55. En:
Aldana-Aranda, D. (ed.). 2003. El caracol
Strombus
gigas: conocimiento integral para su
manejo sustentable en el caribe. CYTED. Programa Iberoamericano de Ciencia y
Tecnología para el desarrollo, Yucatán, México. 165 p
Álvarez
F., M. A. 1998. Shallow water molluscs
(Gastropoda y Pelecypoda) from Cayos Cochinos Biological
Reserve, Honduras. Moluscos (Gastropoda y Pelecypoda) de aguas someras, Reserva Biológica de Cayos
Cochinos, Honduras. Revista de Biología Tropical 46 (Suppl.
4): 103-107.
Chávez, A. y E. Hidalgo. 1988. Los
arrecifes coralinos del Caribe
Noroccidental y Golfo de México en el contexto socioeconómico. Anales
del Instituto de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México 15 (1):
167-176.
Chávez, E., E. Hidalgo y M. Sevilla.
1970. Datos acerca de las comunidades bentónicas del Arrecife Lobos, Ver.
Revista de
Cruz-Ábrego, F. M., P.
Hernández-Alcántara y V. Solís-Weiss. 1994b. Estudio
de la fauna de poliquetos (Annelida) y moluscos (Gastropoda
y Bivalvia) asociada con ambientes de pastos marinos
(Thalassia testudinum) y
manglares (Rhizopora
mangle) en la laguna de Términos,
Campeche, México. Anales del Instituto de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México 21
(1-2): 1-13.
De Jesús-Navarrete, A. 2001
Crecimiento del caracol Strombus
gigas (Gastropoda:
Strombidae) en cuatro ambientes de Quintana Roo,
México. Revista de Biología Tropical. 49 (1): 85-91.
García, C. I., A. Martínez, P.
Moreno-Casasola y G. Vázquez-Hurtado. 1994. Informe del estudio de la zona arrecifal Isla de Lobos. Informe técnico. Instituto de
Ecología. Xalapa, 23 p.
García-Cubas, A. 1981. Moluscos de un
sistema lagunar tropical en el sur del Golfo de México (Laguna de términos,
Campeche). Anales del Instituto de Ciencias del Mar y Limnología,
Universidad Nacional Autónoma de México. Publicación Especial. 1: 1-182.
García-Cubas, A., M. Reguero y L.
Jácome. 1994. Moluscos Arrecifales de Veracruz,
México. Universidad Nacional Autónoma de México. México, 1443 p.
García-Cubas. A. y M. Reguero. 1990.
Moluscos del sistema lagunar Tupilco-Ostión, Tabasco,
México (Sistemática y Ecología). Anales del Instituto de Ciencias del Mar. Limnología, Universidad Nacional Autónoma de México. 17
(2): 309-343.
García-Cubas. A. y M. Reguero. 1995.
Moluscos de
González-Gándara, C. 2003. Síntesis sobre
la biodiversidad del arrecife Lobos, Veracruz, México. BioTam
Nueva serie. 14 (3): 75-78.
Guadarrama, G. M. R. 1973.
Distribución de las especies del género Caecum en el arrecife Lobos, Veracruz. Tesis Profesional.
Escuela Nacional de Ciencias Biológicas Instituto Politécnico Nacional, México.
24 p.
Hammer,
Ö,; D. A. T. Harper and P. D. Ryan. 2001. PAST: Palaeontological
statistics software package for education and data analysis. Palaeontologia Electronica 4 (1): 9 p.
Pérez-Pérez, M. y D. Aldana-Aranda.
2000. Distribución, abundancia, densidad y morfometría
de Strombus
gigas (Mesogastropoda:Strombidae)
en el Arrecife Alacranes Yucatán, México. Revista de Biología Tropical. 48 (Suppl. 1): 51-57.
Quintana y Molina, J. 1991. Resultados
del programa de investigaciones en Arrecifes Veracruzanos del Laboratorio de
sistemas bentónicos litorales. Hidrobiológica. 1 (1): 73-86.
Rosenberg,
G. 2005. Malacolog 4.0: A database of
Sánchez-Islas, L. 1970. Estudio cualitativo y cuantitativo de los micromoluscos de la isla de Lobos, Veracruz, México. Tesis Profesional. Universidad Nacional Autónoma de México. México. 52 p.
Sevilla-Hernández, M. L. 1998. Datos
acerca de los micromoluscos del arrecife isla Lobos,
Veracruz. México. Anales de
Sevilla-Hernández, M. L., E. Hidalgo y
A. M. Bolívar de Carranza. 1983. Distribución de algunos moluscos de la superfamilia Rissoacea (Clase Gastropoda) en sedimentos del arrecife isla Lobos,
Veracruz, México. Anales de
Vargas-Hernández, J. M., M. L.
Jiménez-Badillo y V. Arenas-Fuentes. 2002. El sistema arrecifal
veracruzano y las pesquerías asociadas. In: Guzmán, A. P., C. Quiroga,
B., C. Díaz, L., D. Fuentes, C, C. M. Contreras y G. Silva-López (Eds). La pesca en Veracruz y sus perspectivas de
desarrollo. Instituto Nacional de
Warmke, L. G. and T. R. Abbott.
1961.
Página diseñada por Prof. Jesús Rafael
Méndez Natera
TABLA
DE CONTENIDO DE LA REVISTA CIENTÍFICA UDO AGRÍCOLA



