Revista Científica UDO Agrícola Volumen 6.
Número 1. Año 2006. Páginas: 138-149
Composición y abundancia del ictioplancton durante la temporada de
estiaje en la laguna de Tampamachoco, Veracruz,
México
Ichthyoplankton composition and
abundance during dry season at the Tampamachoco
Lagoon, Veracruz, México
Ubaldo Román Hernández1*, José Valdez Zenil1 y
Faustino Zavala García2
1Universidad
Veracruzana. Facultad de Ciencias Biológicas y Agropecuarias. Km 7.5 Carretera Túxpam-Tampico. Túxpam, Veracruz,
México. Tel/Fax: 017838344350. 2Universidad Autónoma de México
(UNAM). Instituto de Ciencias del Mar y Limnología, México,
D.F. Apdo. Postal 70-305. Tel: (55)
5622-5785, Fax: (55) 5616-0748.
E-mails: ubis777@hotmail.com; valzenil@hotmail.com
y zavgar@icmyl.unam.mx. *Autor para
correspondencia
|
Recibido: 16/08/2006 |
Fin de arbitraje:
11/11/2006 |
Revisión recibida:
23/11/2006 |
Aceptado:
12/12/2006 |
RESUMEN
Se
estudió la composición y abundancia ictioplanctónica
y la influencia de las variables termo-halinas, en la
boca del Canal Nuevo de
Palabras Clave: Ictioplancton, estiaje,
laguna costera, laguna de Tampamachoco.
ABSTRACT
The influence of temperature
and salinity on the composition and abundance of ichthyoplankton
of the entrance of the new channel of Tampamachoco
lagoon of
Key words: Ichthyoplankton, dry season, coastal lagoon, Tampamachoco lagoon.
INTRODUCCIÓN
Las lagunas costeras al ser ecosistemas donde
interactúan el mar, pantanos, marismas y sistemas fluvio-lagunares,
generan una gran variedad de hábitats, lo que crea condiciones favorables para
el desarrollo de especies dulceacuícolas, marinas y salobres (Castro-Aguirre,
1986). Los canales interlagunares por ejemplo,
constituyen zonas lo suficientemente productivas y de condiciones favorables
para la inmigración o reclutamiento de larvas de peces (Richards y Vásquez-Yeomans, 1996). Es sabido que una gran cantidad de peces
marinos dependen de los ambientes estuarino-lagunares
en alguna fase de su ciclo de vida y otros, al llegar a determinadas tallas, se
dirigen hacia el mar donde son objeto de pesca en mayor escala (Castro-Aguirre,
1986). Por otro lado, un alto porcentaje de los peces costeros desovan en el
mar y sus larvas migran o son transportadas a los sistemas lagunares a través
de sus bocas en busca de alimento y refugio (Flores-Coto et al., 1986), interactuando con factores bióticos como
productividad, nichos ecológicos, depredación, competencia por alimento y
espacio, ciclo biológico, entre otros; y abióticos como temperatura, salinidad,
oxígeno disuelto, pH, mareas, etc (Flores-Coto y
Álvarez-Cadena, 1980; Castro-Aguirre, 1987 y
Bulit et
al., 1989). Los eventos antropogénicos como la
contaminación, los asentamientos industriales y humanos en torno a las lagunas
costeras, ocasionan una alteración en la ecología que se ve reflejada en la
disminución del ictioplancton (Richards y Vásquez-Yeomans, 1996).
La laguna de Tampamachoco ha
sido estudiada ampliamente en diversos aspectos. En el ámbito ictiológico
destacan los trabajos de Chávez (1972), Kobelkowsky
(1985), Castro-Aguirre (1986); Cota y Santiago (1992) y Pérez-Hernández y
Torres-Orozco (2000). Sobre las fases larvales de los peces (ictioplancton) se tienen los trabajos de Ríos-Salazar et al., 1989; Bedia-Sánchez,
1990; Ocaña et al., 1990; Cruz y
Rodríguez, 1993), que ofrecen datos de composición y abundancia. Sin embargo,
en ninguno de los estudios mencionados se consideran las zonas de canales de
mangle, que con frecuencia son ricos en organismos pláncticos,
pero por ser sitios someros y estrechos, resultan inaccesibles con la
metodología convencional (Richards y Vásquez-Yeomans,
1996). Con el presente trabajo se desea aportar información referente a la
composición y abundancia de la comunidad ictioplanctónica,
así como de las variables termo-halinas de las aguas
que se encuentra en el canal de la boca de la laguna de Tampamachoco,
Veracruz (México) durante el periodo de estiaje y en una jornada horaria.
MATERIALES Y MÉTODOS
La laguna de Tampamachoco se
localiza al norte del estado de Veracruz, aproximadamente a
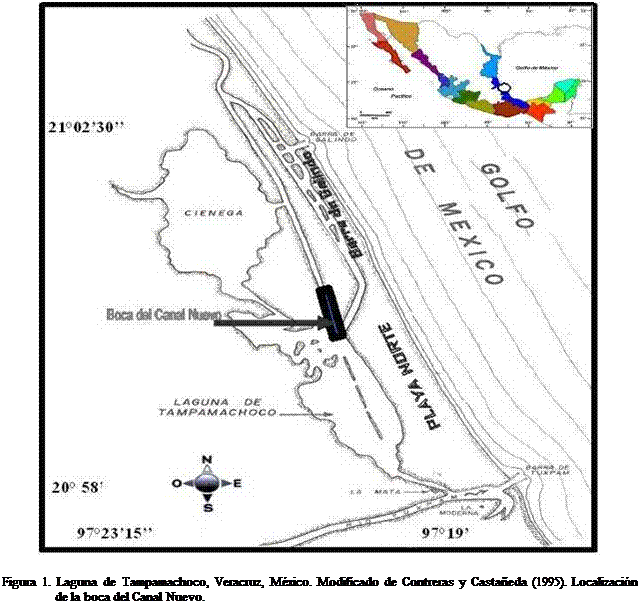
El material biológico fue colectado en el Canal nuevo
de la Laguna de Tampamachoco durante los meses de
diciembre a mayo (temporada de estiaje). Se realizaron 12 muestreos quincenales
en una jornada con intervalos de dos horas de las 17:00 a 24:00 h, quedando así
incluido el día, ocaso y noche, obteniendo un total de 60 muestras.
Para la colecta del ictioplancton
se efectuaron arrastres horizontales desde una lancha con motor fuera de borda,
en trayectoria lineal durante 10 minutos, utilizando una estructura de acero
diseñada para muestrear en áreas someras y de canales (Zavala-García y
Flores-Coto, 2005). En ella se montó una red cónica de
Las muestras se lavaron con agua corriente y se
colocaron en etanol al 70 % para su conservación. Se separó y cuantificó la
totalidad de larvas de peces, y fueron identificadas a nivel Familia mediante
las claves ilustradas de Lipson y Moran (1974),
Martin y Drewry (1978), Álvarez-Cadena y Flores-Coto
(1981), Fahay (1983), Leis
y Trnski (1989) y Moser
(1996).
La abundancia numérica fue estandarizada para
NL/100 m3 = (NL/VF) * 100 (1)
Donde,
NL/100 m3: Número de larvas en 100m3;
NL: Número de larvas de la muestra analizada
VF: Volumen de agua filtrada para la muestra en
estudio.
A su vez, el volumen de agua filtrada (VF) se obtuvo a
partir de la siguiente fórmula:
VF = (A * B * R)/999999 (2)
Donde,
VF: Volumen de agua Filtrada en m3; A: área
de la boca de la red expresada en m2
B: Factor de calibración del flujómetro;
R: Número de revoluciones del flujómetro durante el
arrastre.
La abundancia promedio se expresó como la sumatoria
total de NL/100 m3 dividida entre el número de muestras.
RESULTADOS
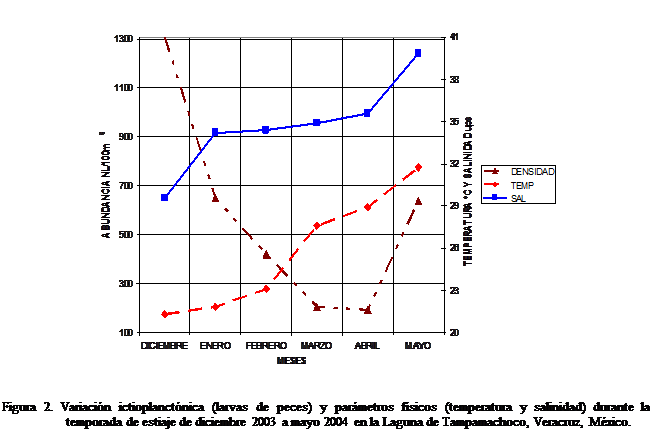
Parámetros ambientales
Variación
de la temperatura y salinidad en la temporada de estiaje
La temperatura promedio fue de 26,34 ° C, con valores
mínimos en los meses de diciembre (21,30 ° C) y enero (21,84 ° C), y ascenso
constante de febrero hasta mayo en donde se registró el valor máximo (31,75 °
C), con una oscilación térmica de 10,45 ° C. El promedio de salinidad fue de
34,86 ups, con el valor mínimo en diciembre (29,55 ups); aumentando en enero
(34,2 ups) y nuevamente en abril (35,58 ups) y mayo (39,85 ups) donde alcanzó
el valor máximo. La oscilación salina fue de 10,35 ups. (Figura 2)
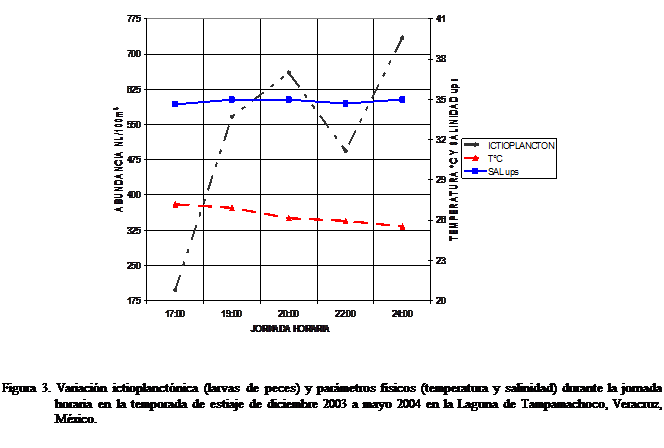
Variación
de la temperatura y salinidad en la jornada horaria
La temperatura registró un descenso gradual,
observándose las máximas a las 17:00 h y las más bajas a las 24:00 h, con
fluctuaciones de
Ictioplancton
Composición
Se identificaron 16 familias de larvas de peces, pertenecientes
a
|
Cuadro 1. Clasificación taxonómica (Nelson, 1994), número de larvas
(NL/100m3) y valores de Abundancia (A %), Frecuencia (F %) y
Dominancia (IVI %) del ictioplancton en la
temporada de estiaje de diciembre |
|||||
|
Orden |
Familia |
NL/100m3 |
A % |
F % |
IVI % |
|
Elopiformes |
Elopidae |
20,58 |
3,88 |
10,05 |
13,93 |
|
Anguilliformes |
Ophichthidae |
0,77 |
0,14 |
2,51 |
2,65 |
|
Clupeiformes |
Engraulidae |
200,67 |
37,81 |
14,82 |
52,63 |
|
|
Clupeidae |
24,52 |
4,62 |
8,79 |
13,41 |
|
Batrachoidiformes |
Batrachoididae |
0,04 |
0,01 |
0,75 |
0,76 |
|
Mugiliformes |
Mugilidae |
0,09 |
0,02 |
0,50 |
0,52 |
|
Atheriniformes |
Atherinidae |
1,38 |
0,26 |
3,02 |
3,28 |
|
Gasterosteiformes |
Syngnathidae |
0,06 |
0,01 |
1,26 |
1,27 |
|
Perciformes |
Gerreidae |
3,14 |
0,59 |
7,04 |
7,63 |
|
|
Sciaenidae |
11,05 |
2,08 |
10,80 |
12,88 |
|
|
Blenniidae |
1,91 |
0,36 |
8,54 |
8,90 |
|
|
Gobiidae |
259,64 |
48,92 |
13,57 |
62,49 |
|
|
Microdesmidae |
0,40 |
0,07 |
4,02 |
4,09 |
|
Pleuronectiformes |
Bothidae |
0,57 |
0,11 |
2,01 |
2,12 |
|
|
Achiridae |
0,24 |
0,04 |
2,26 |
2,30 |
|
|
Cynoglossidae |
0,01 |
0,01 |
0,25 |
0,26 |
Variaciones de abundancia en
la temporada de estiaje
La mayor abundancia promedio se registró en diciembre
con 1.307,92 representando el 38,32 % de la abundancia total y coincidiendo con
los valores mínimos de temperatura (21,30 ° C) y salinidad (29,55 ups). En
enero descendió a 649,74, disminuyendo constantemente hasta el valor mínimo en
abril (191,69), incrementando nuevamente en mayo (638,45) y coincidiendo con
los valores máximos de temperatura (31,75 ° C) y salinidad (39,85 ups) (Figura
2).
Variaciones de
abundancia en la jornada horaria
De 17:00 a las 20:00 h se presentó un incremento
constante de larvas de peces (de
Abundancia,
Frecuencia y Dominancia del ictioplancton
Las familias más abundantes fueron Gobiidae
y Engraulidae, con 48,12 y 38,28 % del total,
respectivamente. Siguieron las familias Clupeidae
(4,64 %), Elopidae (4,06 %) y Sciaenidae
(2,28 %). Las restantes presentaron valores menores al 1 % y, en conjunto,
constituyeron el 1,62 %. (Cuadro 1).
La mayor frecuencia fue para Engraulidae
con 14,82 %, y Gobiidae con 13,57 %, continuando las
familias Sciaenidae (10,8 %), Elopidae
(10,05 %), Clupeidae (8,79 %), Blenniidae
(8,54 %) y Gerreidae (7,03 %). Para Microdesmidae, Atherinidae, Ophichthidae, Achiridae, Bothidae y Syngnathidae, la
frecuencia osciló entre 1 y 5 %; mientras que para Batrachoididae,
Mugilidae y Cynoglossidae,
fue menor al 1 % (Cuadro 1).
El mayor IVI fue para Gobiidae
con 61,69 % y Engraulidae con 53,10 %, seguidas por Elopidae (14,11 %), Clupeidae
(13,43 %) y Sciaenidae (13,08 %). Continuaron las
familias con IVI entre 3 y 10 %: Blenniidae, Gerreidae, Microdesmidae y Atherinidae y, por último, con IVI menor al 3 % estuvieron Ophichthidae, Achiridae, Bothidae, Syngnathidae, Batrachoididae y Cynoglossidae
(Cuadro 1).
Análisis de varianza (ANAVA) y Análisis
de varianza multivariado (MANAVA)
Las familias que se incluyeron en el ANAVA y MANAVA
fueron Gobiidae, Engraulidae,
Clupeidae, Elopidae, Sciaenidae, Gerreidae y Blenniidae, quienes presentaron un IVI mayor al 5%,
constituyendo además el 98,27 % de la abundancia total.
El ANAVA mostró diferencias significativas para todas
las familias y la prueba de grupos homogéneos (prueba de Duncan) determinó la
agrupación de las abundancias mensuales (Cuadro 2).
|
Cuadro 2. Análisis de
varianza de las abundancias mensuales para las familias dominantes en la boca
del Canal Nuevo de |
||||
|
Familia |
F |
Prob. |
Sig. |
Grupos Homógeneos
( |
|
Gobiidae |
5,77 |
0,000 |
* |
DIC≠ENE,FEB,MAR,ABR,MAY |
|
Engraulidae |
2,97 |
0,019 |
* |
ENE≠DIC,FEB,MAR,ABR,MAY |
|
Clupeidae |
24,32 |
0,000 |
* |
ENE,FEB≠DIC,MAR,ABR,MAY |
|
Elopidae |
14,71 |
0,000 |
* |
DIC,ABR,MAY≠ENE,FEB,MAR |
|
Sciaenidae |
3,71 |
0,005 |
* |
DIC,ENE≠FEB,MAR,ABR,MAY |
|
Gerreidae |
3,02 |
0,017 |
* |
DIC,ENE,FEB,MAR≠ABR,MAY |
|
Blenniidae |
6,21 |
0,000 |
* |
DIC,ENE,ABR≠FEB,MAR,MAY |
|
F (54,5) al 95 % de
probabilidad. * : Significativo (p ≤
0,05) |
||||
En la jornada, solo Gobiidae,
Engraulidae y Sciaenidae
tuvieron diferencias significativas: el “día” fue diferente del “ocaso” y
“noche”. La prueba Duncan determinó que Clupeidae, Elopidae, Gerreidae y Blenniidae presentaron homogeneidad en sus abundancias
(Cuadro 3).
|
Cuadro 3. Análisis de varianza de las abundancias
para las familias dominantes en las horas del día, ocaso y noche en la boca
del Canal Nuevo de |
||||
|
Familia |
F |
Prob |
Sig. |
Grupos Homógeneos ( |
|
Gobiidae |
26,10 |
0,000 |
* |
DÍA≠OCASO,NOCHE |
|
Engraulidae |
4,00 |
0,023 |
* |
DÍA≠OCASO,NOCHE |
|
Clupeidae |
0,09 |
0,909 |
ns |
HOMOGENEIDAD |
|
Elopidae |
1,18 |
0,313 |
ns |
HOMOGENEIDAD |
|
Sciaenidae |
11,58 |
0,000 |
* |
DÍA≠OCASO,NOCHE |
|
Gerreidae |
2,88 |
0,064 |
ns |
HOMOGENEIDAD |
|
Blenniidae |
1,18 |
0,313 |
ns |
HOMOGENEIDAD |
|
F (57,2), al 95 % de
probabilidad. * : Significativo (p ≤ 0,05)
ns : No significativo (p
> 0,05) |
||||
Con el MANAVA se encontró que la temperatura presentó
diferencias significativas (p ≤ 0,05) en las abundancias de Gobiidae, Clupeidae, Elopidae, Gerreidae y Blenniidae; mientras que la salinidad causó diferencias
significativas (p ≤ 0,05) en Elopidae (Cuadro
4). Mientras tanto, en la jornada horaria, la temperatura causó variaciones
significativas en las abundancias de Gobiidae, Clupeidae y Elopidae; y la
salinidad provocó diferencias significativas en Engraulidae
y Sciaenidae (Cuadro 4).
|
Cuadro 4. Análisis de varianza
multivariado de las abundancias mensuales y en la jornada horaria
(Día-Ocaso-Noche) para las familias dominantes, en función de la temperatura
y salinidad en la boca del Canal Nuevo de |
||||||||||||
|
|
Temperatura |
Salinidad |
||||||||||
|
Familia |
Mensual |
Horaria |
Mensual |
Horaria |
||||||||
|
F |
Prob. |
Sig |
F |
Prob. |
Sig |
F |
Prob. |
Sig |
F |
Prob. |
Sig |
|
|
Gobiidae |
6,69 |
0,012 |
* |
6,56 |
0,013 |
* |
0,80 |
0,376 |
ns |
1,35 |
0,250 |
ns |
|
Engraulidae |
2,58 |
0,114 |
ns |
1,00 |
0,322 |
ns |
0,01 |
0,921 |
ns |
6,46 |
0,013 |
* |
|
Clupeidae |
6,37 |
0,014 |
* |
59,95 |
0,000 |
* |
0,20 |
0,654 |
ns |
19,64 |
0,000 |
ns |
|
Elopidae |
5,42 |
0,023 |
* |
11,66 |
0,001 |
* |
4,05 |
0,049 |
* |
0,46 |
0,501 |
ns |
|
Sciaenidae |
2,54 |
0,117 |
ns |
0,01 |
0,906 |
ns |
2,75 |
0,103 |
ns |
6,64 |
0,012 |
* |
|
Gerreidae |
9,59 |
0,003 |
* |
1,29 |
0,261 |
ns |
1,91 |
0,172 |
ns |
0,45 |
0,507 |
ns |
|
Blenniidae |
12,3 |
0,000 |
* |
1,72 |
0,194 |
ns |
0,45 |
0,506 |
ns |
0,09 |
0,762 |
ns |
|
F (52,5,1,1) al 95 % de probabilidad. * : Significativo (p ≤
0,05) ns : No
significativo (p > 0,05) |
||||||||||||
DISCUSIÓN
Parámetros ambientales
En general, los valores mínimos y máximos de
temperatura y salinidad a lo largo de la temporada estuvieron asociados con los
meses de invierno y primavera, respectivamente, coincidiendo con lo reportado
por Sánchez-Rueda y Castro-Aguirre (1986) y Bedia-Sánchez
(1990), quienes señalan valores termo-halinos
elevados en primavera y menores durante le invierno;
sin embargo, se observó un aumento en los valores promedio, aproximadamente en
10 unidades para cada variable, que los hallados por los autores mencionados.
Este evento puede deberse principalmente a
La disminución de la salinidad en diciembre y febrero
podría explicarse principalmente a los efectos de la temporada de lluvias y a
las precipitaciones ocasionadas por los “nortes”, aunada al aporte de agua
dulce proveniente del Río Túxpam. En general los
valores elevados de salinidad se originan por la comunicación directa con el mar
en
En las horas de muestreo el aumento de salinidad puede
deberse a las mareas y corrientes que introducen agua de mayor salinidad
durante la noche; mientras que la disminución de la temperatura del agua podría
ocasionarla la temperatura del aire, como lo establece Sánchez (1994), quien
encuentra que esta es mayor durante el día y menor hacia las horas de la noche,
ya que el agua absorbe calor en las horas de luz solar y lo libera por la
noche.
Ictioplancton
Las 16 Familias ictioplanctónicas
identificadas han sido reportadas en la ictiofauna
del sistema estudiado (Pérez-Hernández y Torres-Orozco, 2000) y, de acuerdo a
Cruz y Rodríguez (1993), representan el 53 % de las Familias registradas en los
principales estuarios de Veracruz. Ríos-Salazar
et al. (1988), Bedia-Sánchez
(1990) y Ocaña et al. (1990),
reportaron en un ciclo anual 14, 12 y 17 familias, respectivamente, quedando
sin registrar en los listados de los autores mencionados las familias Batrachoididae, Microdesmidae y Cynoglossidae encontradas por primera vez en la presente
investigación, con las que ascendió a 20 las Familias ictioplanctónicas
reportadas hasta el momento para la laguna de Tampamachoco.
La máxima abundancia ictioplanctónica
en la temporada de estiaje ocurrió en diciembre y en mayo, coincidiendo con la
temporada de “nortes” que se presentan en la zona de estudio (Sánchez, 1994), y
con las temperaturas elevadas (en abril y mayo). En relación a este suceso
Ocaña et al. (1999) explica que
durante los “nortes” algunas especies con desove oceánico ingresan a las
lagunas, y en la primavera la mayoría de las especies típicas lagunares
desovan. El mismo evento ha sido determinado en otras lagunas del Golfo de
México como Tamiahua (Barba-Torres y Sánchez-Robles,
1981), Alvarado (Méndez-Vargas, 1980) y Términos (Álvarez-Cadena, 1978),
quedando de manifiesto que el aumento de larvas está determinado por el ciclo
biológico de las especies dominantes y las condiciones ambientales de cada ecosistema (clima regional).
En la jornada horaria las mayores abundancias se
presentaron a partir del ocaso (19:00 h) y en las horas de la noche (20:00 a
24:00 h), coincidiendo con la disminución de la temperatura y el aumento de la
salinidad. De acuerdo con Forward (1988), tanto la temperatura como la
salinidad determinan la distribución larval. A este respecto Hutchinson (1967)
y Wickstead (1979), agregan que las estrategias de reproducción
y alimentación en los peces están relacionadas precisamente con la luz y la
ausencia de depredadores, posiblemente es durante las horas del “ocaso” y la
“noche” cuando se presentan las condiciones para llevar a cabo esas funciones
biológicas.
Las variaciones en el número de larvas estuvieron
determinadas por las familias Gobiidae y Engraulidae, coincidiendo con lo reportado por Cruz y
Rodríguez (1993) para los estuarios Veracruzanos. La dominancia de Gobiidae y Engraulidae ha sido ya
corroborada en el Golfo de México (Álvarez-Cadena, 1978; Méndez-Vargas, 1980;
Zavala-García, 1980; Barba-Torres y Sánchez-Robles, 1981; Ocaña y Luna, 1985; Bedia-Sánchez 1990; Ocaña et al., 1990, entre otros), jugando el papel ecológico más
importante, ya que aprovechan al máximo la riqueza productiva de las lagunas
costeras.
La familia Gobiidae fue la
más importante y presentó la máxima abundancia en diciembre, con diferencias
significativas respecto del resto de los meses (F = 5,77, p = 0,0002).
Flores-Coto y Méndez-Vargas (1982) señalan que la abundancia elevada de esta
Familia a finales de otoño es producto de las fuertes precipitaciones que
provocan el descenso y desove de algunas especies que viven en la parte alta de
los ríos, como sucede con Dormitator maculatus (Familia Gobiidae)
(Flores-Coto y Zavala-García, 1982). Bedia-Sánchez
(1990) registró la dominancia de Gobiidae para la
laguna de Tampamachoco, con una abundancia mayor al
90 %, mientras que en el presente trabajo fue menor al 50 %; esta diferencia se
explica por la diferencia en salinidad de las áreas muestreadas, la cual fue
menor a 15 ups en el estudio mencionado, y mayor a 29 ups en esta
investigación, quedando de manifiesto la capacidad de los góbidos para
desarrollarse en un rango amplio de salinidad, pero mostrando una preferencia
por las aguas menos salinas. Por esta razón, se sugiere que el factor que
limitante para su desove es la temperatura (F = 6,69, p = 0,0125). Ocaña et al. (1990), reportan a las especies D. maculatus, Gobionellus hastatus, Gobioides broussonetti,
Bathygobius soporator, Eleotris pisonis, Gobiosoma bosci, G. boleosoma, Evorthodus lyricus y Gobiomorus dormitator; y
Castro-Aguirre (1986) registró en la ictiofauna a las
5 primeras especies como habitantes temporales del componente estuarino y eurihalinos del componente marino, de lo que se
desprende que la familia Gobiidae utiliza el área del
Canal Nuevo para efectuar el desove, pero también como área de crianza y
alimentación.
Los engraulidos, quienes
ocuparon el segundo lugar en importancia, ya han sido reportados para la laguna
de Tampamachoco por Bedia-Sánchez
(1990) y Ocaña et al. (1990). Las
abundancias registradas por el primer autor (< 5 %) difieren de las
encontradas en el presente estudio (> 35 %). Esta diferencia se debe
posiblemente a que el desove lo efectúan en aguas con salinidades elevadas
(Ocaña et al., 1999) como las que se
presentan en el Canal Nuevo (hasta 41 ups). Los dos periodos de máxima
abundancia (enero y mayo), indican que se trata de dos o más especies con
ciclos reproductivos diferentes, como lo mostró el ANOVA (F = 2,97; p =
0,0193). Concuerda además con Ocaña et
al. (1990), quien reporta la abundancia de A. hepsetus en febrero, mientras que De
El hecho de que las familias Clupeidae,
Elopidae, Sciaenidae, Gerreidae, Blenniidae y Microdesmidae se presenten de forma constante a lo largo de
la temporada aunque en pequeña proporción, indica que utilizan el Canal Nuevo
como zona de crianza y alimentación, ya que son eurihalinas y forman parte del
componente marino. Estas familias se encuentran representadas en la ictiofauna sistema estudiado (Pérez-Hernández y
Torres-Orozco, 2000).
La familia Achiridae
posiblemente utilice el área del Canal para desovar como sucede en la laguna de
Tamiahua en donde Barba-Torres y Sánchez-Robles
(1981) establecen que Achirus lineatus desova
dentro de la laguna de Tamiahua, y que la baja
abundancia y frecuencia de captura se debe a los hábitos bentónicos que
presenta desde la etapa larval. Cabe aclarar que en las larvas de Achiridae colectadas en este estudio no se aprecia aún la
migración del ojo como sucede en las especies de esta familia. En cuanto a la
familia Syngnathidae Bedia-Sánchez
(1990) menciona que Syngnathus scovelli y Oostethus lineatus realizan el
desove dentro de áreas lagunares durante el periodo de lluvias.
Finalmente, la escasa abundancia de Atherinidae, Ophichthidae, Bothidae, Mugilidae, Batrachoididae y Cynoglossidae,
contrasta con lo reportado por diferentes autores que han determinado el desove
y la abundancia larval de esas familias en aguas neríticas y marinas (Hoese y Moore, 1977; Hardy, 1978; Houde
et al., 1979; Sanvicente-Añorve,
1985; Pineda, 1986; Collins, 1990; Martínez, 1994), por lo que su presencia en
la zona y periodo estudiado se debe a que las larvas son arrastradas
accidentalmente al interior de la laguna, utilizándola temporalmente como área
de refugio y/o alimentación.
CONCLUSIONES
La temperatura y salinidad
presentaron comportamientos ascendentes a lo largo de la temporada de estiaje.
Los valores mínimos y máximos se relacionaron con la dominancia alternada de Gobiidae y Engraulidae,
la primera en diciembre y la segunda en mayo. Se encontró una mayor abundancia
de larvas durante el “ocaso” y la “noche” como posible manifestación de una
estrategia reproductiva para asegurar una mayor sobrevivencia. La temperatura y
salinidad influencian y las variaciones de abundancia ictioplanctónica.
Las familias Microdesmidae, Batrachoididae
y Cynoglossidae constituyeron nuevos registros para
la laguna de Tampamachoco.
AGRADECIMIENTOS
Los autores agradecen a César Flores-Coto por el
financiamiento de esta investigación y a Verónica Ramírez Cruz por su
participación en la examinación de las muestras y en la revisión del presente
documento, al igual que a los técnicos que laboran en el Laboratorio de
Zooplancton del Instituto de Ciencias del Mar y Limnología
de
LITERATURA CITADA
Álvarez Cadena, J. N. 1978.
Distribución y abundancia del ictioplancton, en la
laguna de Términos, Campeche, México. Tesis de Licenciatura. Universidad Nacional
Autónoma de México (UNAM). México. 89 p
Álvarez Cadena, J. N. y C. Flores Coto.
1981. Clave para identificación de familias de larvas de peces de la laguna de
Términos, Campeche, México. Anales del Instituto de Ciencias del Mar y Limnología 8 (1): 199-208.
Barba Torres, J. F. y J. Sánchez
Robles. 1981. Abundancia, distribución y estructura de la comunidad ictioplanctónica, en la laguna de Tamiahua,
Veracruz a través de un ciclo anual. Tesis de Licenciatura. Universidad
Nacional Autónoma de México (UNAM). México. 62 p.
Bedia Sánchez, C. M. 1990. Aspectos ecológicos del ictioplancton del sistema estuarino
de Tuxpan, Veracruz, México. Tesis de Licenciatura. Universidad Nacional Autónoma
de México (UNAM)-Escuela Nacional de Estudios Profesionales (ENEP) Iztacala.
México. 56 p.
Bulit G., C., E. Girón Botello, N. Sánchez S. y M. Signoret P., 1989. Producción primaria fitoplanctónica
en la laguna de Tampamachoco en un ciclo anual. Reporte
del proyecto Estudios Hidrobiológicos en la región estuarino-lagunar
de Túxpam-Tampamachoco, Veracruz y zona Noroccidental
del Golfo de México. CONACYT – UAM-I. Distrito Federal. 200 p.
Castro Aguirre, J. L. 1986. Estudios
Sistemáticos y ecológicos de la ictiofauna del
sistema estuarino-lagunar Túxpam-Tampamachoco,
Ver. México. Tesis doctoral. Universidad Nacional Autónoma de México (UNAM).
México. 98 p.
Castro Aguirre, J. L. 1987. Estudios
hidrobiológicos del sistema estuarino–lagunar Tuxpan-Tampamachoco, Veracruz, Zona Noroccidental del GM. Universidad Nacional Autónoma de
México (UNAM) (Ed) Distrito Federal. 227 p.
Chávez, A. E. 1972. Notas acerca de la ictiofauna del río Túxpam y sus
relaciones con la temperatura y la salinidad. Memorias IV Congreso Nacional de Oceanografía. México. p. 177.
Collins, P. E. 1990. Composición,
distribución y abundancia del ictioplancton en el sur
del Golfo de México (Otoño, 1987). Tesis de Licenciatura. Universidad Nacional
Autónoma de México (UNAM). México. 65 p.
Contreras, E. F. y O. Castañeda. 1995.
Los ecosistemas costeros del estado de Veracruz. Dirección General de Pesca.
Secretaría de Desarrollo Agropecuario, Forestal y Pesquera. México, D. F. 144
p.
Cota,
F. V. y R. Santiago 1992. Estudio
de la estructura de las comunidades de peces de la laguna de Tampamachoco, Veracruz. Resúmenes IX Congreso Nacional de
Oceanografía. México. p. 179.
Cruz,
G. A. y A. Rodríguez. 1993.
Estudios ictioplanctónicos en los sistemas estuarinos del estado de Veracruz, México. Resúmenes XII
Congreso Nacional de Zoología. México. p. 97.
De
De
Fahay, M. P. 1983. Guide to the early stages of
marine fishes occurring in the Western North Atlantic Ocean,
Flores Coto y J. N Álvarez Cadena,
1980. Estudios preliminares de distribución
y abundancia del ictioplancton en
Flores Coto, C. y F. Zavala
García.1982. Descripción de huevos y larvas de Dormitator maculatus, de la laguna de Alvarado,
Veracruz (Pises, Gobiidae). Anales del Instituto de
Ciencias del Mar y Limnología 9 (1): 127-140.
Flores Coto, C. y M. L. Méndez Vargas.
1982. Contribución al conocimiento del ictioplancton
de la laguna de Alvarado, Veracruz. Anales del Instituto de Ciencias del Mar y Limnología. 9 (1): 41-160.
Flores Coto, C.; V. Ducoing; F.
Zavala García; A. Velarde y S. Méndez. 1986. Efecto de la marea en el paso de
las larvas de algunas especies de la familia Clupeidae
(Pises), en
Forward,
R. B. Jr. 1988. Diel vertical migration: zooplancton photobiology and behavior. Oceanography Marine
Biology Annual Research. 26 (1): 361-393.
Hardy,
J. D. 1978. Development of fishes of the Mid-Atlantic Bight. An atlas of egg,
larval and juvenile stages. Vol. II. Anguillidae
Through Sygnathidae. Fish and Wildlife Service.
Hoese, H. D. and R. H. Moore. 1977. Fishes of the
Houde, E. D.; J. C. Leak; C. E. Dowd; S. A. Berkeley
and W. J. Richards. 1979. Ichthyoplanckton abundance
and diversity in the
Hutchinson,
G. E. 1967. Introduction to
Kennish, M. J. 1992. Ecology of estuaries: Anthropogenic effects.
CRC Press.
USA: 375. 459 p.
Kobelkowsky, A. 1985. Los peces de la
laguna de Tampamachoco, Veracruz, México. Biótica 10 (2): 145-156.
Lankford, R. R. 1977. Coastal lagoons of
Leis,
J. M. and J. M. T. Trnski. 1989. The Larvae Of
Indo-Pacific Shorefishes.
Lipson,
J. A. and L. R. Moran. 1974. Manual for identification of early developmental
stages of fishes of the Potomac River Estuary. Power Plant Siting Program of
the
Martin,
F. D. and G. E. Drewry. 1978. Development of fishes
of the Mid-Atlantic Bight. An atlas of egg, larval and juvenile stages. Fish
and Wildlife Service. U. S. 321 p.
Martínez, M. R. 1994. Variación
estacional del ictioplancton en la sonda de Campeche,
México (Clupeiformes a Scorpaeniformes).
Tesis de Licenciatura. Universidad Nacional Autónoma de México (UNAM). México
56 p.
Méndez Vargas, M. L. 1980. Distribución
y abundancia del ictioplancton de la laguna de
Alvarado, Veracruz a lo largo de un ciclo anual. Tesis de Licenciatura.
Universidad Nacional Autónoma de México (UNAM). México. 58 p.
Moser,
H. G. 1996. The early stage of fishes in the California Current Region.
Nelson,
J. S. 1994. Fishes of the world. Wiley.
Nueva York. USA. 600 p.
Ocaña, J. A. y A. S. Luna. 1985.
Abundancia y distribución de los huevos de Engraulidae
(Pisces) y estimación de su biomasa desovante, en la laguna de Términos, Campeche. Tesis de
Licenciatura. Universidad Nacional Autónoma de México (UNAM). México. 65 p.
Ocaña, J. A.; M. Sánchez y L. Arias. 1990. Distribución y
abundancia del ictioplancton de la laguna de Tampamachoco, Veracruz, México. Resúmenes II Congreso de
Ciencias del Mar. México. p. 121.
Ocaña, J. A.; M. Sánchez Ramírez y J.
J. Zamorano Orozco. 1999. Diversidad del ictioplancton
en la laguna Madre y Almagre, Tamaulipas, y laguna de Tampamachoco,
Veracruz. Proyecto CONABIO FB440/LO70/97. INP. México, D. F. 54 p.
Pérez Hernández, M. A. y R. E. B.
Torres Orozco. 2000. Evaluación de la riqueza de especies de peces en las
lagunas costeras mexicanas: estudio de un caso en el Golfo de México. Revista Biología
Tropical 48 (2/3): 425-438.
Pineda, L. R. 1986. Contribución al
conocimiento del ictioplancton del sur del Golfo de
México. Un ciclo anual. 1-Invierno. Tesis de Licenciatura. Universidad Nacional
Autónoma de México (UNAM). 95 p.
Richards,
W.J. y L. Vásquez Yeomans. 1996. Ictioplancton.
In: R. Gasca y E. Suárez (EDS). Introducción al estudio
del zooplancton marino. ECOSUR/CONACYT. México, D. F. p. 631-664.
Ríos-Salazar,
H.; A. Marmolejo y S. De
Ríos
Salazar, H.; S. De
Sánchez, N. L. 1994. Influencia
cualitativa y cuantitativa de los factores climáticos que inciden en la salinidad y temperatura del agua de la laguna de Tampamachoco, Veracruz (1979-1986). Tesis de Maestría. Universidad Nacional Autónoma de México (UNAM).
México. 62 p
Sánchez Rueda, P. y J. L. Castro
Aguirre. 1986. La ictiofauna del sistema Túxpam-Tampamachoco y sus aspectos ecológicos relevantes.
CONACYT (Ed.). México, D. F. 191 p.
Sanvicente Añorve, L. 1985.
Contribución al conocimiento de la fauna ictioplanctónica
en el sur del Golfo de México. Primera parte: Primavera. Tesis de Licenciatura.
Universidad Nacional Autónoma de México (UNAM). México. 88 p.
Wickstead M. K. 1979. Zooplancton marino. Cuadernos de
Biología. México, D. F. 73 p.
Zavala García, F. 1980. Contribución al
conocimiento de los huevos y larvas de Dormitator
maculatus (Pisces: Gobiidae) en la laguna de Alvarado, Veracruz. Tesis de
Licenciatura. Universidad Nacional Autónoma de México (UNAM). México. 79 p.
Zavala García, F. y C.
Flores Coto. 2005. Marco de soporte para muestreo de plancton y neuston en áreas someras y canales. Ciencia y Mar 9 (25):
21-24.
Página diseñada por Prof. Jesús Rafael
Méndez Natera
TABLA
DE CONTENIDO DE LA REVISTA CIENTÍFICA UDO AGRÍCOLA



