Revista Científica UDO Agrícola Volumen 6.
Número 1. Año 2006. Páginas: 60-66
Desinfección de ápices de
yuca (Manihot esculenta Crantz) cv. ‘Querepa Rosada’ con
hipoclorito de sodio
Disinfection
of cassava (Manihot esculenta Crantz)
shoots cv. ‘Querepa Rosada’ with
sodium hypochlorite
José
Alberto Laynez Garsaball* y
María Claudia Sánchez Cuevas
Escuela de Ingeniería Agronómica. Núcleo Monagas. Universidad de Oriente.
Avenida Universidad. Campus Los Guaritos.
Maturín, 6201. Monagas, Venezuela. E-mails: jalaynezg@yahoo.es y mariaclaudia@cantv.net. * Autor para correspondencia
|
Recibido: 09/06/2006 |
Fin de arbitraje:
22/08/2006 |
Revisión
recibida: 24/10/2006 |
Aceptado:
26/11/2006 |
RESUMEN
Esta investigación tuvo por
objetivo determinar un protocolo de desinfección de ápices de yuca del cultivar
Querepa Rosada, con soluciones de hipoclorito de
sodio bajo tres concentraciones y tres tiempos de inmersión. Se emplearon ápices meristemáticos de
Palabras Claves: Contaminación, cultivo de tejidos, yuca, desinfectante, cloro
ABSTRACT
This
research was conducted in order to develop a disinfection protocol for apical
shoots of cassava, cultivar ¨Querepa Rosada¨, using three dilutions of sodium hypochlorite and
three immersion periods. Meristems, 1mm long, from apical shoots collected in a
commercial cassava plantation located in Jusepin,
Key words: Contamination,
cassava, tissue culture, disinfectant, chlorine
INTRODUCCIÓN
La yuca ha adquirido
importancia en los últimos años, debido a los distintos usos que pueden darse a
la misma (Industrial: obtención de almidón y alcohol; consumo humano: raíces
frescas, casabe, hojuelas, gofio, naiboa, mañoco y cerveza; y consumo animal:
sustituto de cereales). Sin embargo, el incremento del área de cultivo se ha
visto limitado por la insuficiencia de semilla, ya que la producción de propágulos
es limitada. Esto obedece a que el
sistema tradicional de propagación es por estacas y el factor de multiplicación
planta/año varía entre 10 y 20, es decir, una planta
madura produce entre 10 y 20 estacas de
Se ha demostrado que la técnica del cultivo de tejidos es apropiada para la rápida y masiva propagación de plantas. La regeneración de plantas enteras a partir de ápices meristemáticos de yuca es una técnica bien establecida con beneficios adicionales a la propagación, como lo son: la eliminación de patógenos, almacenamiento in vitro y el intercambio internacional de germoplasma. Uno de los mayores inconvenientes en el cultivo de tejidos es la contaminación, la cual puede tener origen en diversas fuentes: el material vegetal, el área de trabajo, los instrumentos o herramientas, la vidriería, e inclusive, el propio investigador. Los tallos o estacas de la yuca, expuestos a la contaminación durante el largo ciclo de desarrollo del cultivo, están generalmente infectados de patógenos fungosos, bacterianos y virales, especialmente cuando la plantación de donde se tomaron está afectada (CIAT, 1982). Para el establecimiento de los explantes en condiciones in vitro, la limpieza del material es de primordial importancia. En el caso de los tejidos, los contaminantes que llevan las yemas sobre su superficie se eliminan con la desinfección. Si por el contrario se encuentran dentro del tejido, su eliminación es muy difícil, y en estos casos, es recomendada la inclusión de fungicidas y bactericidas en el medio de cultivo, o bien, el tratamiento de las plantas donantes de ápices meristemáticos con altas temperaturas (CIAT, 1980b).
El
éxito de las plantaciones rentables de yuca se inicia con la utilización de semilla de alta calidad, que represente fielmente la variedad, que sea vigorosa
y especialmente libre de plagas y enfermedades
(Mantilla, 1993). Algunas metodologías de desinfección de explantes de yuca proponen el corte de los brotes entre 1 y
Sobre estas bases, el objetivo planteado en el presente trabajo, fue evaluar el efecto de la
desinfección de ápices de yuca del cultivar “Querepa
Rosada”, con tres concentraciones de hipoclorito de sodio y tres tiempos de
inmersión.
MATERIALES
Y MÉTODOS
El presente
trabajo fue realizado en el Laboratorio de Biotecnología de
Obtención del material vegetal, corte, lavado y
desinfección de los brotes
Se
utilizaron brotes terminales de tallo de 3 ó
Aislamiento,
siembra e incubación de los ápices
En la
cámara de flujo laminar se removieron las estípulas hasta disponer de un ápice
de
Diseño
Experimental, variables evaluadas y análisis estadístico
Se utilizó un diseño estadístico completamente aleatorizado con 11 tratamientos, cada uno con 10 repeticiones, un explante por repetición y por tubo de ensayo. Los tratamientos estuvieron conformados por la combinación de las concentraciones 10, 20 y 30 % de cloro comercial, para 0,525; 1,05 y 1,575 % de hipoclorito de sodio (C10, C20 y C30, respectivamente), y los tiempos de inmersión: 10, 20 y 30 min (T10, T20 y T30, respectivamente). Se incluyeron además dos testigos: Etanol 70 % por 5 segundos y HgCl2 por 10 minutos. El efecto de los tratamientos se determinó a los 8, 16 y 24 días después de la siembra (dds), a través de la determinación del porcentaje de ápices vivos y no contaminados (sanos). Las diferencias entre los porcentajes en cada fecha de evaluación se determinaron mediante la prueba para comparar dos porcentajes en una misma evaluación, descrita en Sokal y Rohlf (1969), al 0,05 % de probabilidad.
RESULTADOS
Porcentaje de ápices vivos y no contaminados a los 8 dds
En
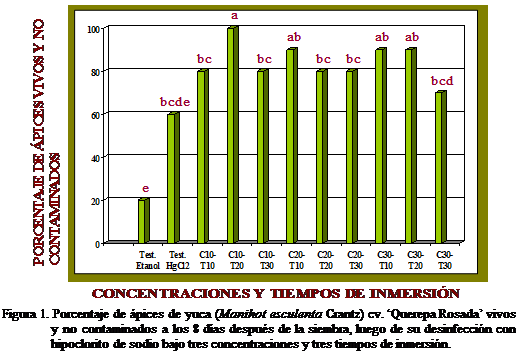
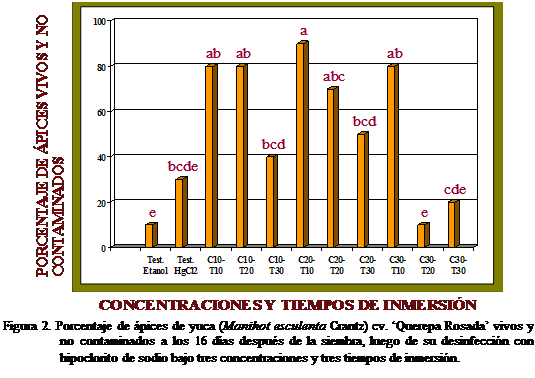
Porcentaje de ápices vivos y no contaminados a los
16 dds
En la Figura 2 se observa que los mayores
porcentajes de explantes vivos y no contaminados se
alcanzaron en los tratamientos: C10-T10, C10-T20, C20-T10, C20-T20 Y
C30-T10 (80; 80; 90; 70; y 80 %,
respectivamente), los cuales fueron estadísticamente superiores al resto de los
tratamientos y a los testigos bicloruro de mercurio y etanol con 30 y 10%,
respectivamente. Este último estadísticamente inferior al anterior.
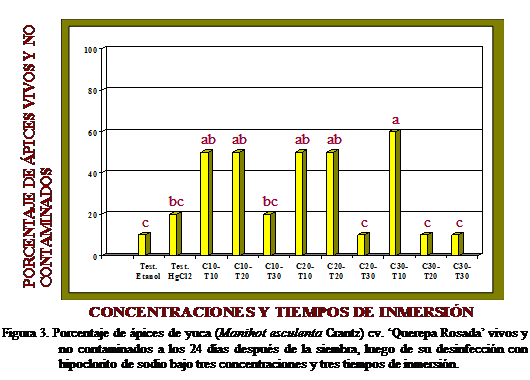
Porcentaje de ápices vivos y no contaminados a los 24 dds
En
Porcentaje de ápices contaminados a los 8, 16 y 24 dds
La
prueba de comparación de porcentajes detectó que el tratamiento con mayor contaminación a los 8, 16 y 24 dds
fue el testigo etanol 70 % (60, 90 y 100 % de explantes
contaminados, respectivamente), el cual fue estadísticamente superior al resto
de los tratamientos en los que únicamente se observó contaminación en C10-T20 y
C20-T10 (10 % y 10 % de explantes contaminados,
respectivamente) a los 16 y 24 dds (Datos no
mostrados).
DISCUSIÓN
Los resultados obtenidos muestran que el proceso de desinfección con hipoclorito
de sodio se vio afectado por la concentración y el tiempo de inmersión,
apreciándose que la solución al 10 % por 20 min, pasó de un 100 % de ápices
vivos y no contaminados a los 8 dds a un 50 % a los
24 dds, siendo estadísticamente igual en esta fecha
al tratamiento con solución al 10 % por 10 min (80 % a los 8 dds y 50 % a los 24 dds). Por lo tanto, este último tratamiento puede
ser considerado una técnica de desinfección aceptable basado en que, desde el
punto de vista práctico, se escoge el de menor concentración por menor tiempo,
con la intención de que el tejido sufra el menor daño posible dada la fitotoxicidad del cloro, logrando conseguir una metodología
de desinfección efectiva y a la vez económica, de material donante proveniente
directamente del campo.
La variación
existente entre las distintas metodologías de desinfección, aun con el empleo
de el mismo producto, (González et al., 2005;
CIAT, 1980b), posiblemente se deba al nivel de contaminación que presenta el
material vegetal de yuca de acuerdo con su procedencia. Al respecto, CIAT
(1980b), señaló que la concentración de microorganismos contaminantes presentes
en el tejido depende de las condiciones de crecimiento de las plantas donantes,
y que mayor número de microorganismos se encontrará en tejidos provenientes del
campo que del invernadero, y menos aun en tejidos
provenientes de una cámara de crecimiento controlado. Por consiguiente, es
necesaria la determinación de un protocolo de desinfección considerando las condiciones particulares del material que
se empleará como donante del explante.
Concentraciones de
hipoclorito de sodio y tiempos de inmersión semejantes a los empleados en este
trabajo han sido utilizadas en la desinfección de otras especies. Al respecto, Sánchez-Cuevas y Salaverría (2004) al estudiar el control de la
oxidación y la contaminación en el cultivo in
vitro de fresa cv. Fresno, utilizando los mismos tratamientos descritos
para la desinfección de los ápices de yuca,
encontraron que mayor efectividad con
20 % de hipoclorito de sodio durante 20 min, ya que redujo la contaminación a
10 % y obtuvieron la mayor sobrevivencia (90 %) de los explantes.
Concentraciones más altas o períodos de inmersión más prolongados causaron
necrosis en el tejido. En igual forma, Guerra y Otahola
(2005) trabajaron en la desinfección de ápices de alpinia
(Alpinia purpurata (Vieill) K. Shaum), lavando los explantes con abundante agua de chorro durante 10 minutos,
sumergiéndolos en alcohol puro (98 % de pureza) durante un minuto, para después
colocarlos en tres concentraciones de cloro comercial (5,25 % de hipoclorito de sodio en soluciones
de agua:cloro 2:1, 3:1 y 4:1), combinados con tres
tiempos de inmersión (10, 20 y 30 minutos). En las primeras evaluaciones
realizadas observaron mayor sobrevivencia de los explantes
en el tratamiento donde se utilizó la menor concentración de cloro y tiempos de
inmersión de 10 y 20 minutos; mientras que en la mayor concentración la
sobrevivencia disminuyó indicando toxicidad del cloro sobre los explantes. Estos trabajos señalan un efecto perjudicial del
cloro sobre los explantes producto del aumento de la
concentración, o bien, del incremento en el tiempo de inmersión. En la presente
investigación fue posible observar que los periodos de inmersión de 10 y 20
minutos en combinación con las concentraciones de hipoclorito de sodio de 10 y
20%, así como también la combinación 10 minutos de inmersión a concentración de
30%, presentaron los mayores porcentajes de explantes
vivos y no contaminados a los 16 y 24 dds, sugiriendo
que la disminución en este porcentaje estuvo determinada por el tiempo de
inmersión más que por las concentraciones de hipoclorito de sodio.
La inclusión como testigo del HgCl2 (inmersión 10 minutos) no resultó
ser un buen tratamiento de desinfección al evaluar la mejor combinación del
bajo porcentaje de explantes contaminados y una alta
sobrevivencia, ya que aun cuando no se presentó contaminación en ninguno de los
explantes tratados en las tres fechas de evaluación
con este producto, los porcentajes de sobrevivencia a los 24 dds fueron muy bajos (20 %). Esto demostró su alta
toxicidad, aspecto que reafirma Contreras (1991), al señalar que dentro de los
desinfectantes más comunes, el cloruro de mercurio y el nitrato de plata son
unos de los menos usados por su toxicidad, y en relación a efectividad, los
mejores son los hipocloritos y el agua de
bromo, seguidos por el peróxido de hidrógeno y el nitrato de plata. Por otra parte, Suárez (1997) indicó que cualquiera sea la metodología
seguida para el proceso de desinfección, los tratamientos con soluciones
desinfectantes que se usen, deben permitir retener la capacidad biológica de
los tejidos y al mismo tiempo destruir cualquier contaminante fúngico o bacteriano.
El tratamiento con hipoclorito de
sodio mostró ser muy efectivo para la desinfección superficial, es decir, para
el control de los microorganismos contaminantes externos del material vegetal,
en todas las concentraciones y tiempos de inmersión en estudio, ya que no se
apreció la aparición de microorganismos en un lapso de 8 días después de la
siembra, tiempo suficiente para el crecimiento de bacterias y hongos. La poca
contaminación observada en las evaluaciones posteriores (16 y 24 dds) puede atribuirse a infecciones internas de los
tejidos, no controlables por los tratamientos aplicados. Esto se corresponde
con el CIAT (1982), al señalar que los tallos o estacas de yuca se encuentran
expuestos a la contaminación durante el largo ciclo de desarrollo del cultivo,
por lo que están generalmente infectados de patógenos fungosos y bacteriales, y que algunas bacterias y casi
todos los virus son sistémicos en la planta. Así mismo, el CIAT (1980b) afirmó
que en el caso de los tejidos, los contaminantes que llevan las yemas sobre su
superficie se eliminan con la desinfección, pero si los contaminantes se
encuentran dentro del tejido, su eliminación es muy difícil y en estos casos se
recomienda la inclusión de fungicidas o bactericidas en el medio de cultivo; aunque
Suárez (1997) indicó que generalmente se considera que los tejidos de las
plantas intactas y sanas son asépticos internamente y que la principal tarea de
limpieza esta limitada a la desinfección superficial.
En
este trabajo se pudo observar también que en la medida en que se incrementó el
tiempo de inmersión de los explantes en las distintas
concentraciones de hipoclorito de sodio, disminuyó la sobrevivencia. Esto puede
ser debido a dos efectos. Uno directo relacionado con la toxicidad del producto
a nivel celular; y uno indirecto porque
el tejido se torna gomoso al incrementar la concentración de cloro, dificultando su manipulación, y por ende, el deterioro del
explante. En este sentido, Díaz (2000) observó que
todos los explantes de especies del género Pasiflora
tratados con hipoclorito de sodio por 30 minutos estaban necrosados después de
tres días de la siembra. Igualmente Sánchez-Cuevas y Salaverría (2004) al tratar explantes de fresa con
hipoclorito de sodio al 30% (30 minutos), evidenciaron la ausencia de
contaminación, pero no recomendaron su utilización porque la sobrevivencia fue
baja indicando que este tratamiento fue tóxico para los explantes.
CONCLUSIONES
1.
Para lograr un 50% de explantes
vivos y no contaminados a los 24 dds, fue necesario
que previo a la desinfección, los brotes se lavaran con agua corriente (30
min), luego fueron sumergidos en una solución de detergente líquido (5 minutos
en agitación constante) y finalmente en fungicida Kumulus
DF (3g/L por 30 min); posteriormente en la cámara de flujo laminar se
desinfectaron con una solución al 10 % (v/v) de
hipoclorito de sodio comercial (5,25%) durante 10 min, y se enjuagaron
tres veces con agua destilada estéril, manteniendo los brotes hidratados hasta
el momento de aislar los explantes.
2.
El testigo HgCl2 (inmersión 10 min) no resultó
ser un buen tratamiento, porque a pesar de que controló en 100% la
contaminación, los porcentajes de
sobrevivencia a los 24 dds fueron muy bajos (20 %).
3.
Incrementos del tiempo de
inmersión de los explantes en las distintas
concentraciones de hipoclorito de sodio, redujo el porcentaje de sobrevivencia,
ya que afectaron la consistencia del explante, al
tornar su tejido gomoso, lo cual dificultó su manipulación.
AGRADECIMIENTO
Al
Instituto de Investigaciones Agropecuarias y al Postgrado en Agricultura
Tropical del Núcleo Monagas de la Universidad de Oriente.
LITERATURA CITADA
Centro Internacional de Agricultura Tropical (CIAT). 1980a.
Sistema de
propagación rápida de la yuca. Serie 05-06-01. Cali, Colombia. 20 pp.
Centro Internacional de Agricultura Tropical (CIAT). 1980b.
El Cultivo de meristemas de yuca. Serie 04SC-02.02.
Cali, Colombia. 40 pp.
Centro Internacional de Agricultura Tropical (CIAT). 1982. Primer Taller Latinoamericano
sobre Intercambio de Germoplasma de Papa y Yuca. (Memorias). Serie
03SC-6(82).
Cali, Colombia. 295 pp.
Contreras, I. 1991. Biotecnología vegetal. Universidad de
los Andes. Facultad de Ciencias Forestales. Laboratorio de cultivos in vitro. Mérida, Venezuela. p. 37-39.
Díaz, G., M. J. 2000. Regeneración de dos especies del
género Pasiflora en cultivo de tejidos in vitro utilizando dos tipos de explantes
de plantas adultas. Trabajo de Grado. Escuela de Ingeniería Agronómica. Universidad de Oriente. Maturín,
Venezuela. p. 14.
Guerra, D. y V. Otahola, 2005.
Desinfección de ápices de alpinia (Alpinia purpurata (Vieill) K. Shaum) para
establecimiento de cultivo in vitro. In:
J. Mayz; N. Alcorcés y A. Lárez (Eds.). Memoria del XVI Congreso Venezolano de
Botánica. Maturín, del 15 al 20 de mayo del 2005. Revista Saber (Suplemento)
17: 131-133.
González, O.; J. Albarrán; G. De Martino
y F. Fuenmayor. 2005. Propagación y conservación in vitro de clones de yuca a partir de diferentes tipos de explantes. In: J. Mayz; N. Alcorcés y A. Lárez (Eds.).
Memoria del XVI Congreso Venezolano de Botánica. Maturín, del 15 al 20 de mayo
del 2005. Revista Saber (Suplemento) 17: 127-130.
Kartha, K. K.
1984. Cassava tissue culture. In Micropropagation of selected rootcrops,
palms, citrus and ornamental species. FAO/NORWAY. Roma. p. 50-67.
Mantilla, J. E. 1993. Aspectos agronómicos del cultivo de
yuca en Venezuela. In: VIII Encuentro
Nacional de Productores e Investigadores del Cultivo de
Murashige
T. and F. Skoog.
Sánchez-Cuevas, M. y J. Salaverría. 2004. Control de la oxidación y la contaminación en el cultivo in vitro de fresa (Fragaria X
ananassa Duch.). UDO Agrícola 4 (1): 21-26.
Sokal,
R. y J. Rohlf .1969. Biometría: Principios y métodos estadísticos
en la investigación biológica. H. Blume. Madrid,
España. p. 127-129.
Suárez, A. E. 1997. Métodos de asepsia y esterilización. In: M. Perea y J. Cedeño (Eds.). Cultivo
de Tejidos Vegetales y sus Aplicaciones en
Página diseñada por Prof. Jesús Rafael
Méndez Natera
TABLA
DE CONTENIDO DE LA REVISTA CIENTÍFICA UDO AGRÍCOLA



