Revista Científica UDO Agrícola Volumen 6.
Número 1. Año 2006. Páginas: 67-75
Durabilidad de la
capacidad germinativa del polen en Aloe
vera (L.) Burm. f. y A. saponaria
Haw.
Durability of the
pollen germinative capacity in Aloe vera (L.) Burm.f. and A. saponaria Haw.
José del Valle Imery Buiza*
y Yaritza Cárdenas Ramírez
Laboratorio de Genética Vegetal, Departamento de
Biología, Escuela de Ciencias, Universidad de Oriente, Cumaná 6101, Venezuela.
Apdo. 245. E-mail: jimery@sucre.udo.edu.ve * Autor para correspondencia
|
Recibido: 21/09/2006 |
Fin de arbitraje:
25/10/2006 |
Revisión
recibida: 06/11/2006 |
Aceptado:
14/11/2006 |
RESUMEN
El objetivo de este trabajo
fue evaluar la respuesta germinativa de los granos de polen (GP) de Aloe vera y A. saponaria a diferentes tiempos después de la antesis (0, 1, 2,
4, 8, 12, 24, 48, 72, 96, 120 y 144 h). Se cultivaron GP sobre medios a base de
agar (
Palabras clave:
Aloe, polen, tubo polínico,
viabilidad in vitro.
ABSTRACT
The
objective of this work was to evaluate the germinative
response of the pollen grains (PG) from Aloe vera and A. saponaria, to different times after anthesis (0, 1, 2, 4, 8, 12, 24, 48, 72, 96, 120, and 144 h).
PG on agar (
INTRODUCCIÓN
La viabilidad de los granos de polen ex situ, usualmente es determinada
empleando métodos de tinción con colorantes como acetocarmín,
yoduro de potasio, azul de metileno y fucsina básica, orceína,
búfalo black, etc. (Singh, 2003). En estas pruebas,
se consideran granos de polen viables a los intensamente coloreados y estériles
a los menos coloreados o acromáticos (Marks, 1954; Cequea,
1985). No obstante, la mayoría de estos métodos se basan en la afinidad de las
células por determinadas sustancias colorantes, que generalmente sobrestiman la
fertilidad del polen y escasamente pueden determinar el poder germinativo real
de los granos de polen o la capacidad de extensión de los tubos polínicos (Jahier, 1996). Para evaluar con mayor precisión la
fertilidad masculina de numerosas especies vegetales se han establecido
procedimientos in vitro que hacen
posible la germinación del polen bajo condiciones controladas (Hodgkin, 1983; Heslop-Harrison,
1987; Schoper et
al., 1987; Steer
y Steer, 1989; Pierson y Cresti, 1992; Singh, 2003).
La familia Aloaceae
comprende a los géneros Aloe, Gasteria, Haworthia, Lomatophyllum, Chortolirion, Poellnitzia y Astroloba, con
casi 700 especies, nativas de África, Madagascar, Arabia e islas del Océano
Índico (Carter, 1994; Rowley, 1997; Smith y Steyn, 2004). Dentro de este grupo vegetal, Aloe vera (L.) Burm.f.
(= A. barbadensis
Mill.), conocida popularmente como sábila o zábila,
se destaca como una de las especies de mayor importancia económica a nivel
mundial, debido a sus múltiples propiedades medicinales (Añez y Vásquez, 2005).
En América, esta planta fue introducida durante la ocupación española y
actualmente se cultiva desde el sur de Estados Unidos hasta el norte de
Argentina, explotándose principalmente en la industria de cosméticos, fármacos,
alimentos y bebidas terapéuticas (Davis, 1997; Judd et al., 1999).
La
creciente incidencia de bacteriosis en plantaciones
de A. vera localizadas en Aruba (De Laat et al.,
1994), México (Aranda y Fucikovsky, 1999) y Venezuela
(González et al., 1998; Hernández et al., 1999, 2001; Lugo, 1999;
Contreras et al., 2001; Lugo y
Medina, 2001; Guevara et al., 2002;
Guevara, 2004), han promovido la realización de investigaciones que conduzcan a
la obtención de variedades promisorias. Los alcances del programa de
mejoramiento que se desarrolla en el laboratorio de genética vegetal de
La necesidad de continuar generando
variabilidad genética en A. vera y en
una de sus potenciales donadoras (A.
saponaria), conlleva a considerar el tratamiento de granos de polen con
radiaciones ionizantes, antes de ejecutar futuros cruzamientos intra e interespecíficos. No
obstante, para el traslado de estas células reproductivas hacia los centros de
irradiación, se requiere de tiempo y condiciones de almacenamiento, que hasta
ahora se desconocen. En este sentido, el objetivo del presente trabajo fue
evaluar (in vitro) los efectos del
tiempo de almacenamiento post-antesis sobre la capacidad germinativa del polen
de A. vera y A. saponaria.
MATERIALES Y MÉTODOS
Material vegetal
Todas las plantas empleadas en este
trabajo se conservan en la colección in
vivo de especies suculentas (UDO-Biología), bajo los registros 104/0096 (A. saponaria) y 129/0187 (A.
vera). Los especimenes fundadores provenían
originalmente de viveros comerciales (A. saponaria) y de una población
ubicada a 10°36’34’’ N, 64°07’18’’ O (A. vera), los cuales fueron identificados morfológicamente según
Carter (1994) y Van-Wyk y Smith (1996). En diciembre
de 2004, se seleccionaron 20 plantas de cada especie, libres de enfermedades y
con presencia de inflorescencias prominentes en inicio de floración. Al momento
de la colecta (6:30 a 7:15 a.m.), se eligieron flores que presentaran una o más
anteras sin abrir. Estas flores fueron depositadas en frasco seco y trasladadas
inmediatamente al laboratorio para monitorear la dehiscencia del resto de las
anteras y colectar el polen. Se emplearon pinceles suaves para remover todo el contenido de las anteras y depositarlo
dentro de cápsulas de Petri. Las cápsulas fueron selladas con parafilm y almacenadas durante 1, 2, 4, 8, 12, 24, 48, 72,
96, 120 y 144 h, en lugar oscuro y fresco (a 24 º C, dentro de estantes
cerrados y esterilizados con hipoclorito de sodio 1,5 % v/v), antes de realizar
los cultivos in vitro. En esta investigación la antesis fue definida
como el momento en el cual abre el perianto y expone las anteras (Badillo et al., 1985). Por otra parte, tomando
en cuenta que el polen colectado provenía de flores en antesis, los tiempos de
almacenamiento del polen fueron identificados como tiempos después de antesis
(TDA).
Microcultivos
Se siguió la metodología propuesta
por Sunderland y Roberts (1977), con algunas
modificaciones estandarizadas por los autores. Se preparó una mezcla homogénea
de agua de grifo, agar-agar (
Diseño experimental
El experimento se planificó
originalmente bajo un diseño de bloques al azar con cinco repeticiones y
arreglo factorial entre especies y TDA. De esta manera se analizó el porcentaje
de germinación del polen; sin embargo, el agotamiento de la respuesta
germinativa en una de las especies dificultó la determinación de posibles
efectos de interacción de ambos factores sobre el tiempo de germinación del
polen, razón por la cual esta variable fue examinada bajo un diseño de bloques
al azar, en donde las combinaciones especie-TDA fueron consideradas de forma
integral como tratamientos. El procesamiento estadístico incluyó ANOVA,
regresión y prueba de ámbitos múltiples de Duncan a un nivel de significación
del 5 % (Sokal y Rohlf,
1979).
RESULTADOS Y DISCUSIÓN
En esta investigación, el medio de cultivo
a base de agar y sacarosa ofreció
suficiente consistencia, concentración y suministro de minerales para promover
la germinación in vitro de los granos
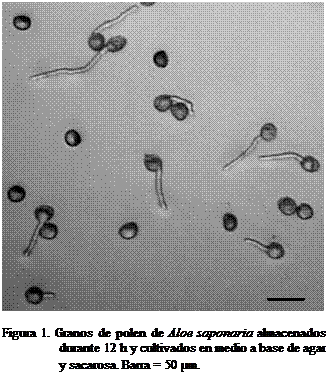
de polen de A. vera y A. saponaria (Figura 1). Durante la
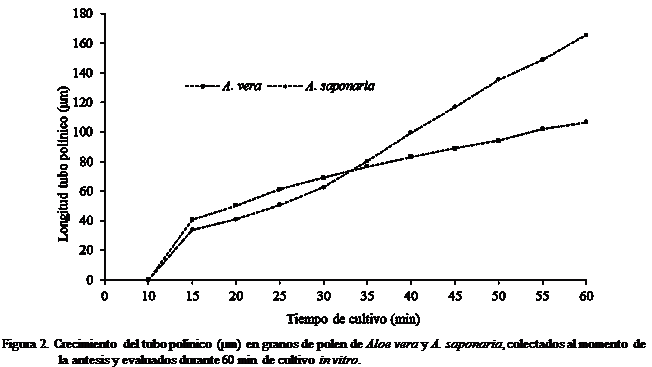
primera hora de cultivo, los tubos polínicos emitidos por algunos granos de
polen colectados al momento de la antesis, se extendieron hasta 106,7 ± 24,8 μm en A. vera
y 165,6 ± 22,5 μm en A. saponaria (Figura 2). En muchas
angiospermas, la velocidad del
crecimiento del tubo polínico in vitro
varía de
La determinación de los efectos del almacenamiento, se
realizó en 3497 ± 406 granos de polen en cada combinación de especie-TDA. La capacidad
germinativa de estas células reproductivas, manifestó una considerable
dependencia con respecto al TDA en ambas especies de Aloe (Figura 3). El porcentaje de germinación en A. vera, se redujo progresivamente desde
51 %, al momento de la antesis (0 h), a 46 % durante las primeras 24 h y luego
declinó aceleradamente hasta su inhibición completa entre las 120 y 144 h. En A. saponaria, esta tendencia fue aún más
acentuada, descendiendo la germinación por debajo del 40 % a partir de las 12
h, con inhibición completa entre 72 y 96 h (Figura 3a). Esta variabilidad
intrínseca de las especies y su interacción con los TDA fue reflejada en el
análisis de varianza (cuadro 1) y detallada por la comparación de promedios
(cuadro 2). De igual manera, el tiempo de germinación también manifestó
diferencias significativas entre los tratamientos (cuadros 3 y 4), aumentando
proporcionalmente entre las
Figura 3. Porcentaje
(a) y tiempo (b) de germinación del polen de Aloe vera y A. saponaria,
bajo condiciones in vitro y a
diferentes tiempos después de la antesis. Líneas continuas indican modelos
de regresión con sus respectivas fórmulas. (b) (b)

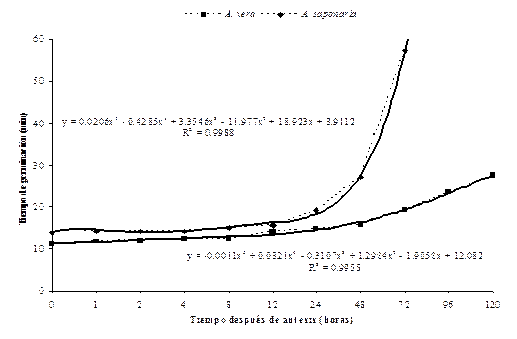
|
Cuadro
1. Análisis de varianza para el porcentaje de germinación del polen de Aloe vera y A. saponaria, bajo condiciones in vitro y diferentes tiempos después de la antesis. |
||||
|
Fuente de variación |
Grados de libertad |
Suma de cuadrados |
Cuadrados Medios |
F |
|
Repeticiones |
4 |
0,00011 |
0,000028 |
1,01 ns |
|
Especies (A) |
1 |
0,68483 |
0,684830 |
24468,57 * |
|
TDA (B) |
11 |
8,96249 |
0,814772 |
29111,44 * |
|
A * B |
4 |
0,63804 |
0,058004 |
2072,45 * |
|
Error Experimental |
92 |
0,00257 |
0,000028 |
|
|
Total |
119 |
10,28805 |
|
|
|
TDA: Tiempo después de
antesis. Resultados a partir de datos transformados con *: Significativo (p £ 0,05)
ns: no significativo (p > 0,05). |
||||
|
Cuadro
2. Prueba de promedios para el porcentaje de germinación del polen de Aloe vera y A. saponaria, bajo condiciones in vitro y diferentes tiempos después de la antesis. |
||||
|
TDA |
A. vera |
Ámbitos † |
A. saponaria |
Ámbitos † |
|
0 |
50,57 |
a |
45,50 |
c |
|
1 |
50,85 |
a |
46,04 |
b |
|
2 |
49,14 |
bc |
47,01 |
a |
|
4 |
49,55 |
b |
46,20 |
b |
|
8 |
48,63 |
c |
42,83 |
d |
|
12 |
47,25 |
d |
39,06 |
e |
|
24 |
46,19 |
e |
32,58 |
f |
|
48 |
38,57 |
f |
14,16 |
g |
|
72 |
24,06 |
g |
1,92 |
h |
|
96 |
18,17 |
h |
0,00 |
i |
|
120 |
7,59 |
i |
0,00 |
i |
|
144 |
0,00 |
j |
0,00 |
i |
|
TDA: Tiempo después de
antesis (horas). Los valores representan promedios de cinco repeticiones. †
Prueba de ámbitos múltiples de Duncan (p £ 0,05), a partir de datos transformados con Letras iguales indican promedios
estadísticamente similares dentro de cada especie. |
||||
|
Cuadro 3. Análisis de varianza para el tiempo de
germinación del polen (in vitro)
entre las combinaciones de tratamientos (especies de Aloe-tiempos después de la antesis). |
||||
|
Fuente de variación |
Grados de libertad |
Suma de cuadrados |
Cuadrados Medios |
F |
|
Repeticiones |
4 |
0,025 |
0,006 |
2,32 ns |
|
Combinaciones |
19 |
90,395 |
4,758 |
1769,93 * |
|
Error Experimental |
76 |
0,204 |
0,003 |
|
|
Total |
99 |
90,624 |
|
|
|
Resultados
a partir de datos transformados con *:
Significativo (p £
0,05) ns: no significativo (p > 0,05). |
||||
|
Cuadro
4. Prueba de promedios para el tiempo de germinación (min) del polen de Aloe vera y A. saponaria, bajo condiciones in vitro y diferentes tiempos después de la antesis. |
||||
|
TDA |
A. vera |
Ámbitos † |
A. saponaria |
Ámbitos † |
|
0 |
11,11 |
a |
13,88 |
d |
|
1 |
11,70 |
b |
14,16 |
de |
|
2 |
11,90 |
bc |
14,17 |
de |
|
4 |
12,34 |
c |
14,11 |
d |
|
8 |
12,39 |
c |
15,03 |
fg |
|
12 |
13,97 |
d |
15,49 |
gh |
|
24 |
14,69 |
ef |
19,20 |
i |
|
48 |
15,66 |
h |
27,10 |
k |
|
72 |
19,32 |
i |
57,19 |
l |
|
96 |
23,52 |
j |
|
|
|
120 |
27,47 |
k |
|
|
|
TDA: Tiempo después de
antesis (horas). Los valores representan promedios de cinco repeticiones. † Prueba
de ámbitos múltiples de Duncan (p<0,05), a partir de datos transformados
con Letras
iguales indican promedios estadísticamente similares entre todos los
tratamientos. |
||||
En general, el crecimiento del tubo
polínico estuvo afectado negativamente por el tiempo de almacenamiento del
polen antes del cultivo in vitro. Esto
puede ser provocado por numerosos factores, entre ellos, el agotamiento de las proteínas de reserva en el
grano de polen (Tanaka y Wakabayashi,
1992), o el cese de actividades enzimáticas encargadas de la elongación de la
pared del tubo polínico (Li y Linskens, 1983; Geitmann et al.,
2000). En angiospermas, la germinación y
desarrollo del tubo polínico está ya predeterminado en el grano de polen, al
tiempo que son liberados en la antesis. Los ribosomas, ARNm
y ARNt, requeridos para la germinación, son
sintetizados durante la maduración del polen y persisten hasta que son
empleados para el proceso germinativo. Esta germinación y el rápido desarrollo
del tubo polínico, así como, la presíntesis de ARNm y síntesis de proteínas, varían entre las especies vegetales
(Mascarenhas, 1975, 1978). La alteración de estos
procesos bioquímicos durante el almacenamiento del polen, debe contribuir en la
respuesta diferencial observada en las especies de Aloe, siendo el polen de A.
saponaria el más sensible a los efectos perjudiciales del envejecimiento.
Otras especies vegetales como Crotalaria retusa (Shivanna
et al., 1990, 1991) y Malus domestica (Bellani
et al., 1984), han conservado el
poder germinativo de sus granos de polen, aún luego del almacenamiento durante
30 y 365 días, respectivamente. Obviamente, la longevidad del polen en estas
especies deber estar asociada a una mayor capacidad de latencia y a la
protección proporcionada por una cubierta mucho más impermeable y robusta que
la presente en Aloe (Steyn et al.,
1998).
Finalmente, desde el punto de vista de la aplicación
de estos resultados, es recomendable realizar cualquier tratamiento mutagénico durante las primeras 24 horas después de haber
colectado el polen en antesis y ejecutar los cruzamientos lo más rápido
posible, a fin de garantizar la germinación del polen y obtención de progenies.
Por otra parte, debe tomarse en cuenta, que además de los efectos nocivos del
tiempo, las irradiaciones u otros procedimientos que conlleven a la mutagénesis de estas células, seguramente reducirán también
su capacidad germinativa, por lo cual se deberá emplear el polen inmediatamente
después del tratamiento.
CONCLUSIONES
El medio de cultivo a base de agar-agar (
LITERATURA
CITADA
Albornoz, A. R. y J. Imery.
2003. Evaluación citogenética de ocho poblaciones de Aloe vera L. de la
península de Araya-Venezuela. Ciencia (LUZ) 11: 5-13.
Añez, B. y J. Vásquez. 2005. Efecto de la densidad de población sobre el
crecimiento y rendimiento de la zábila (Aloe
barbadensis Mill.). Rev. Fac.
Agron. (LUZ) 22: 1-12.
Aranda, S. y L. Fucikovsky.
1999. Erwinia chrysanthemi
causante de la pudrición de sábila (Aloe barbadensis Mill.). http://colpos.mx/ifit/entarcar/avances/019.html.
Última visita: 09 de diciembre de 2005.
Badillo, V. M.; L. Schnee y
C. Benítez. 1985. Clave de las familias de plantas superiores de Venezuela. 7ed. Espasande,
S.R.L. Eds. Caracas, Venezuela. 270 p.
Bellani, L.; A. Tagliassacchi and
S. Sanchavinis. 1984. Viability of stored
pollen grains of Malus domestica. Borhk as evaluated by
the incorporation of labeled nucleic acid precursor. Caryologia 37: 323-330.
Brewbaker, J. and S. Majumdar. 1961. Incompatibility and the pollen grain.
Recent Adv. Bot. 2: 1503-1508.
Bryndum, K. and T. Hedegart. 1969. Pollination of teak (Tectona grandis L. f.). Silvae
Genet. 18: 77-80.
Carter, S. 1994.
Flora of tropical east
Cequea, H. 1985. Estudio citogenético de los autotetraploides
de cinco especies de Machaeranthera
(Compositae). Acta Cient. Venez. 36: 375-380.
Cequea, H.; D. Díaz; J. Imery and
M. Nirchio. 2003. Cytogenetic study of paracentric
inversions in Tridax procumbens (Compositae). Cytologia
68: 329-333.
Contreras, N.; N. Vargas; N. Gómez y A. Carrasco.
2001. Plantas de zábila afectadas por Erwinia chrysanthemi en los estados Falcón y Lara. XVII
Congreso Venezolano de Fitopatología. Maracay, Venezuela.
Davis, R. H. 1997. Aloe vera: a scientific
approach. Vantage Press. NY,
De Laat, P.; J. Verhoeven and J. Janse. 1994. Bacterial leaf rot of Aloe vera L. caused by Erwinia chrysanthemi biovar 3. Eur. J. Plant Pathol. 100:
81-84.
Geitmann,
A.; B. N. Snowman; A. M. C. Emons and V. E.
Franklin-Tong . 2000. Alterations in the actin cytoskeleton of pollen tubes are
induced by the self-incompatibility reaction in Papaver rhoeas. The Plant Cell 12: 1239-1251.
González, A.; J.
Salomón; Z. Lugo; Y. Hernández y G. Trujillo. 1998. Bacteriosis
en zábila (Aloe vera) causada por Erwinia sp. XLIV Reunión
Anual de
Guevara, J. 2004. Diagnóstico de enfermedades
bacterianas en cultivos de Aloe vera L.
de la península de Araya-Venezuela. Trabajo de grado. Departamento de Biología,
Universidad de Oriente. 41 p.
Guevara, J.; J. Imery; G.
Trujillo y Y. Hernández. 2002. Incidencia de
enfermedades bacterianas en plantaciones de Aloe
vera L. de la península de Araya-Venezuela. LII AsoVAC.
Barquisimeto, Venezuela.
Hernández, R.; Y. Romero; J. Velázquez; M. Griman; N. Contreras y N. Vargas. 2001. Problemática
fitopatológica de la zábila (Aloe vera)
en el sector Las Ventosas del Municipio Colina del Estado Falcón. XVII Congreso
Venezolano de Fitopatología. Maracay, Venezuela.
Hernández, Y.; G. Trujillo y C. Muñoz. 1999. Pudrición
bacteriana de plantas de zábila (Aloe
vera). XVI Congreso Venezolano de Fitopatología. Barquisimeto,
Venezuela.
Heslop-Harrison, J. 1987.
Pollen
germination and pollen-tube growth. Rev. Cytol. 107:
1-18.
Hodgkin, T.
Hoekstra, F.A.
1983. Physiological evolution in angiosperm pollen: possible role of pollen
vigour. In: Mulcahy, D. L. (Eds.). Pollen: Biology
and implications for plant breeding. NY Elsevier Sci. 240 p.
Imery, J. 2000. Inducción de tetraploidía
en Aloe vera (L.) Burm.f.
(Aloaceae). Tesis de Maestría. Departamento de
Biología. Universidad de Oriente. Cumaná, Venezuela. 73 p.
Imery, J. 2001. Protandría y
autoincompatibilidad en Aloe vera L.
LI AsoVAC. San Cristobal,
Venezuela.
Imery, J. 2002. Anormalidades cromosómicas en la microsporogénesis de Aloe
vera (L.) Burm.f. (Aloaceae)
Trab. Asc. Agregado.
Universidad de Oriente. 61 p.
Imery, J. 2004.
Anormalidades premeióticas en Aloe vera (L.) Burm.f. (Aloaceae). LIV AsoVAC. Valencia,
Venezuela.
Imery, J. 2005. Cruzabilidad unidireccional en Aloe vera (L.) Burm.f. (Aloaceae).
Imery, J. 2006a. Caracterización genética de parentales e
híbridos diploides [VS] y triploides [VVS]
entre Aloe vera (L.) Burm.f. [2V, 4V]
y Aloe saponaria
Haw. [2S] (Aloaceae).
Tesis doctoral. Postgrado en Botánica.
Universidad Central de Venezuela. Caracas, Venezuela. 163 p.
Imery, J. 2006b. Radiosensibilidad
y variaciones genéticas inducidas por rayos gammas en Aloe vera (L.) Burm.f. (Aloaceae). VI Congreso Científico de
Imery, J. and H. Cequea. 2001a. Colchicine-Induced autotetraploid
in Aloe vera
L. Cytologia 66: 409-413.
Imery, J. y H. Cequea. 2001b.
Evaluación citogenética de la generación M1V2 de tetraploides experimentales en sábila (Aloe vera L.). Rev. UDO Agr. 1: 29-33.
Imery, J. y H. Cequea. 2002. Anormalidades cromosómicas en la microsporogénesis de Aloe vera (L.) Burm.f. (Aloaceae). Acta Bot.
Jackson, R. C. 1976. Evolution and systematic significance of
polyploidy. Ann. Rev. Ecol. 7: 209-234.
Jackson,
R. C. 1985. Genomic differentiation and its effect on gene flow. Syst. Bot. 10:
391-404.
Jahier, J. 1996.
Techniques of plant cytogenetics. Sci. Pub., Inc.
Judd, W. S.; C. S.
Campbell; E. A. Kellogg and P. F. Stevens. 1999. Plant systematics, a
phylogenetic approach. Sinaeur Ass., Inc.
Kalinganire, A.; C. E.
Harwood; M. U. Slee and A. J. Simons. 2000. Floral
structure, stigma receptivity and pollen viability in relation to protandry and self-incompatibility in silky oak (Grevillea robusta A. Cunn.). Ann. Bot. 86: 133-148.
Li, Y. Q. and H. F.
Linskens. 1983. Wall-bound proteins of pollen tubes
after self- and cross pollination in Lilium longiflorum. Theor. Appl. Genet. 67: 11-16.
Lugo, Z. 1999.
Zábila: enfermedades y control. Rev. Fonaiap Divulga 63:
20-21.
Lugo, Z. y R.
Medina. 2001. Diagnóstico preliminar de enfermedades en plantas de zábila (Aloe vera L.) en los municipios Colina, Federación, Miranda, Falcón y Sucre del
estado Falcón. XVII Congreso Venezolano de Fitopatología. Maracay, Venezuela.
Marks, G. E. 1954. An aceto-carmine glycerol jelly for use in pollen fertility
counts. Stain Tech. 29: 277-283.
Mascarenhas, J. 1975. The
biochemistry of angiosperm pollen development. Bot. Rev. 41: 259-263.
Mascarenhas, J. 1978.
Ribonucleic acids and proteins in pollen germination. Palynology 1: 400-406.
Pierson, E. and M. Cresti. 1992. Cytoskeleton and cytoplasmic organization of
pollen and pollen tubes. Rev. Cytol. 140: 73-100.
Rowley, G. D.
Salmerón, Y. y J. Imery.
2004. Caracterización de la sintomatología causada por Erwinia chrysanthemi en 22 especies de Aloe (Aloaceae).
LIV AsoVAC. Valencia, Venezuela.
Salmerón, Y. y J. Imery. 2005. Caracterización de la tolerancia a Erwinia chrysanthemi en 22 especies de Aloe (Aloaceae).
XVI
Congreso Venezolano de Botánica. Maturín, Venezuela. Saber 17(Supl. 1): 74-76.
Schoper, J.; R. Lambert and B. Vasilas. 1987. Pollen viability, pollen shedding in maize. Crop Sci.
27: 27-31.
Shivanna, K.; H. Linskens and M. Cresti. 1990.
Responses of tobacco pollen to high humidity and heat stress: viability and germinability in
vitro and vivo. Sex. Plant Reprod. 2: 130-140.
Shivanna, K.; H. Linskens and M. Cresti. 1991.
Pollen viability and pollen vigor. Theor. Appl. Genet. 81:
38-42.
Singh, R. J. 2003.
Plant cytogenetics. 2ed. CRC Press.
Smith, G. F. and E.
M. A. Steyn. 2004. Taxonomy of Aloaceae.
In:
Aloes, the genus Aloe. Reynolds, T.
(Ed.). CRC Press.
Sokal, J. y J. Rohlf. 1979. Biometría. Principios y
métodos estadísticos en la investigación biológica. H. Blume
Edic.
Steer, M. and J.
Steer. 1989. Pollen tube tip growth. New Phytol. 111:
323-358.
Steyn, E.; G. Smith; S.
Nilsson and E. Grafstrom. 1998. Pollen morphology in Aloe (Aloaceae).
Grana 37: 23-27.
Tanaka,
Van-Wyk, B. E. and G. Smith. 1996. Guide to aloes of
Velásquez, R. y J. Imery.
2004. Estudio fenológico reproductivo de Aloe
vera (L.) Burm.f. y Aloe saponaria Haw. (Aloaceae)
en condiciones de vivero. LIV AsoVAC. Valencia,
Venezuela.
Velásquez, R. y J. Imery.
2005. Biología reproductiva de Aloe vera
(L.) Burm.f. y Aloe
saponaria Haw. (Aloaceae).
XVI Congreso Venezolano de Botánica. Maturín, Venezuela. Saber 17(Supl.1):
120-122.
Página diseñada por Prof. Jesús Rafael
Méndez Natera
TABLA
DE CONTENIDO DE LA REVISTA CIENTÍFICA UDO AGRÍCOLA



