Revista Científica UDO Agrícola Volumen 5.
Número 1. Año 2005. Páginas: 10-26
Los suelos como fuente de boro para las plantas
Soils as boron source for plants
Auristela Malavé
Acuña
Postgrado en Agricultura Tropical, Campus
Juanico, Universidad de
Oriente-Núcleo de Monagas, Maturín-estado Monagas, 6201.
E-mail: amalave@monagas.udo.edu.ve
RESUMEN
El boro (B) es un micronutrimento esencial requerido por las plantas para su
normal desarrollo y crecimiento. Sin
embargo, a través de la historia de investigación de este elemento, ha sido
establecido que los rangos de concentración en la solución del suelo que causan
síntomas de deficiencia o toxicidad en las plantas son más pequeños que para
cualquier otro elemento; esto, aunado a la situación de que dichos rangos
varían de acuerdo con la especie; es decir, un intervalo de concentraciones de
B puede ser normal para un determinado tipo de plantas mientras que para otras
puede resultar tóxico o deficiente, ha
tenido una profunda influencia para un mejor conocimiento del comportamiento
del B en los suelos. Los factores del
suelo que afectan la disponibilidad de B para las plantas son pH, textura,
humedad, contenido y calidad de materia orgánica y tipo y contenido de
arcillas. Generalmente la concentración de B de la solución del suelo está
controlada por reacciones con superficies adsorbentes que incluyen óxidos de
aluminio y hierro, hidróxido de magnesio, minerales de arcilla, carbonato de
calcio y materia orgánica. Estas reacciones de retención de B pueden ser
descritas usando modelos empíricos (la ecuación de isoterma de adsorción de Langmuir, la ecuación de isoterma de adsorción de Freundlich y el modelo fenomenológico de Keren) o modelos químicos (el modelo de capacitancia
constante, el modelo de triple capa y el modelo de cuádruple
capa) que pueden usar condiciones cambiantes de la solución en cuanto a pH y
concentración de B. Estos modelos también pueden ser usados para describir
reacciones de liberación de B para suelos aún fértiles. Un número de técnicas
analíticas han sido utilizadas para determinar concentraciones de B en
diferentes tipos de materiales siendo los métodos espectrofotométricos, que
utilizan azometina-H, los más extensivamente
aplicados en los análisis de muestras de suelos. El propósito del presente
artículo es examinar todos los avances que han contribuido a entender el
comportamiento fundamental del B en los suelos y el impacto directo sobre su
manejo en sistemas agrícolas para la producción sostenible.
Palabras clave:
Análisis de boro, suelo, toxicidad, deficiencia.
ABSTRACT
Boron
(B) is one essential micronutrient required by plants for their normal
development and growth. However, throughout the history of this element
research, it has been established that concentration ranges in the soil
solution causing either deficiency or toxicity symptoms in plants are smaller
than for any other element; in addition to this situation, those ranges change
according to the plant specie; that is, a
concentration interval of B can be normal for an specific type of plant, while
for others can be either toxic or deficient, which has had a profound influence
for a better knowledge of B behavior in soils.
Soil factors affecting availability of B to plants are pH, texture,
moisture, temperature, content and quality of organic matter, and content and
kind of clay. The B concentration of soil solution is generally controlled by
reactions with B adsorbing surfaces involving aluminium
and iron oxides, magnesium hydroxide, clay minerals, calcium carbonate, and
organic matter. These B adsorption
reactions can be described using either empirical models (the Langmuir
adsorption isotherm equation, the Freundlich
adsorption isotherm equation, and the phenomenological Keren
model) or chemical models (the constant capacitance model, the triple layer
model, and the quadruple layer model) that can use changing conditions of
solution pH and B concentration. These models can also be used to describe B
desorption reactions for non-hysteretic soils. A number of analytical
techniques have been used for determining B concentrations in different kind of
materials being the spectrophotometric methods, that use azomethine-H,
the most extensively applied to analysis of soil samples. The purpose of this
article is to examine all advances that have contributed to understand the
fundamental behavior of B in soils and the direct impact on its management in
agricultural systems for the sustainable production.
Key words: Boron
analysis, soil, toxicity, deficiency.
INTRODUCCIÓN
Desde 1857 (Ploquin,
1967) se sabe de la presencia del B en las plantas. Sin embargo, no fue sino
hasta que Warington (1923) y Somer
y Lipman (1926) mostraron que el B es un nutrimento
esencial para las mismas. En base a lo
anterior, se sugiere la posibilidad de que este elemento tenga un rol similar
en otros organismos por lo que durante las dos últimas décadas muchos intentos
han sido enfocados para su demostración.
Desde entonces, una gran cantidad de evidencia circunstancial ha sido
acumulada, la cual sugiere fuertemente que el B probablemente es un micronutrimento esencial para animales superiores y humanos
(Nielsen, 1991, 1992, 1994, 2000; Mertz,
1993; Hung, 1994, 2003; Fort, 2002; Fort et al, 1999, 2000, 2002; Sutherland et al, 1999; Sheng
et al, 2001; Dzondo-Gadet
et al, 2002; Rico et
al, 2002; Devirian
y Volpe, 2003; Barranco y Eckert,
2004; Park et al, 2004; Ralston y Hung, 2004). Para el hombre la principal fuente de consumo
de B está constituida por aquellos alimentos de origen vegetal (Gupta y Gupta, 2005) con una
dosis de consumo del elemento sugerida en un rango de seguridad aceptable para
adultos entre 1–13 mg/día (WHO/FAO/IAEA, 1996), sin obviar que su consumo en
exceso puede resultar tóxico (EPA, 2004; Malina, 2004).
A pesar de que las especies
bioquímicas involucradas en la esencialidad del B en las plantas no han sido
definitivamente probadas, aunque muchas si han sido hipotetizadas,
aún se desconoce con certeza cual es el rol
bioquímico específico de este elemento en el reino vegetal, donde se ha
sugerido su participación en los procesos de mantenimiento de la estructura de
la pared celular, mantenimiento de la función de la membrana y de soporte en
actividades metabólicas como funciones del crecimiento y desarrollo de las
plantas, y más recientemente se ha indicado que la base de su esencialidad
radica en la estabilización de moléculas con grupos diol-cis
volviéndolos efectivos indistintamente de su función en las plantas (Bolaños et al, 2004). La carencia de este micronutrimento
en las plantas causa problemas tales como la muerte del centro de crecimiento,
el desarrollo lento de las raíces y otros síntomas dependiendo de la severidad
de la deficiencia (Cakmak y Römheld,
1997; Camacho-Cristóbal et al, 2002,
2005; Golbach et
al, 2001; Molassiotis et al, 2005; Rashid et al, 1994; Zhao y Oosterhuis,
2002; Warncke, 2005; Yu y
Bell, 2002); mientras que su exceso es tóxico (Aucejo
et al, 1997; Nable
et al, 1997, Wong et al, 1998; Lægreid
et al, 1999; Ruiz et al, 2003; Apostol,
et al, 2004; Papadakis
et al, 2004a; 2004b; Reid, et al,
2004; Ghanati
et al, 2005).
Los suelos constituyen la fuente de
B para las plantas de donde es consumido a través de las raíces. Estos pueden
ser divididos en dos tipos: aquellos con bajo contenido (<10 mg g-1)
o alto contenido (10-100 mg g-1) siendo los primeros los que componen a
la mayoría; mientras que los últimos son aquellos próximos a sitios con
actividad volcánica y geológica, donde el B consumido por las plantas
generalmente está controlado por sus niveles en la solución de estos suelos más
que por su contenido total, representando usualmente alrededor del 10%
disponible para las plantas (Power y Woods,
1997). Puesto que la década actual ha
sido un período de significativo progreso en cuanto a la investigación de B, el
presente artículo tiene como finalidad revisar los diferentes avances
relacionados con el comportamiento fundamental de este elemento en los suelos
para el control de sus niveles de consumo en las plantas y al impacto directo
que ha tenido su manejo en los sistemas agrícolas.
Generalidades del boro
La
palabra boro es derivada del árabe “buraq” que
significa bórax su principal mineral. De
acuerdo con la reciente modificación de
La
química del B, con la posible excepción del carbono, es de las más interesantes
y diversas la cual surge de la tan
llamada deficiencia de electrones de muchos de sus compuestos. Esto es debido al hecho de que el B posee
sólo tres electrones de valencia por lo que cuando forma enlaces de tres pares
de electrones deja un orbital p vacío
en la capa de valencia (Power, 1997). Este elemento no se encuentra libre en la
naturaleza existiendo exclusivamente enlazado a oxígeno mayormente como
boratos, menos frecuente como ácido bórico y raramente enlazado a fluor formando el ion BF4-.
Las principales fuentes de B están constituidas por depósitos de
diferentes minerales tales como Bórax (Tincal) {Na2[B4O5(OH)4].8H2O},
ulexita {NaCa[B5O6(OH)6].5H2O},
colemita {Ca[B3O4(OH)3].2H2O}
y kernita {Na2[B4O5(OH)4].2H2O}
donde los centros de B en los anillos pueden tener número de coordinación tres,
cuatro o combinación de ambos (Power y Words, 1997). La
formación de estos anillos puede ser más fácilmente entendida en términos de la
disociación del ácido bórico [B(OH)3 o H3BO3]
en agua:
B(OH)3 + H2O
D B(OH)4- + H+
En
este caso el ácido bórico es un ácido débil (Ka = 5,9
x 10-10), utilizando más bien la definición de Lewis que la de Brfnsted-Lowry, que acepta un par de electrones del ion OH- proveniente del agua con lo que
el B pasa de hibridación sp2
a sp3 en el producto
final:
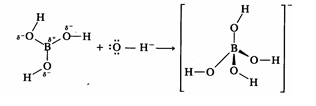
Una vez
establecido el equilibrio anterior, a bajas concentraciones (£0,02 mol L-1) sólo estarán presentes las
especies mononucleares B(OH)3 y B(OH)4-, las cuales se espera estén presentes en los fluidos
de las plantas. El ácido bórico
reacciona con los alcoholes de acuerdo con la reacción: B(OH)3 + 3ROH D B(OR)3 + 3H2O; la cual es un equilibrio desplazado hacia la
izquierda que puede ser completada por remoción del agua de acuerdo con el
principio de Le Chatelier y viene a constituir la
base para la formación de complejos
mediante reacción del ácido bórico con polialcoholes, tal como azúcares,
generando ésteres de boratos cíclicos estables con las siguientes estructuras:
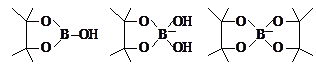
Recientemente
se ha sugerido que la capacidad que tiene el B para formar estos tipos de
complejos constituye la principal razón de su esencialidad en las plantas, la
cual radica en la estabilización de moléculas con grupos cis-diol
por previa reacción con este elemento (Bolaños et al, 2004).
Factores que afectan la
disponibilidad de boro en los suelos
El B es absorbido por las raíces, a
partir de la solución del suelo, principalmente como ácido bórico no disociado
como resultado de un proceso no metabólico pasivo (Hu
y Brown, 1997). El B adsorbido y desorbido por los suelos varia extensivamente de acuerdo
con el contenido de sus constituyentes (en su mayoría minerales de arcilla,
óxidos y materia orgánica) y con la afinidad que éstos presenten por el
elemento estando su disponibilidad afectada por diversos factores tales como
pH, textura, humedad y temperatura (Gupta,
2002). A medida que se incrementa el pH
de la solución del suelo, usualmente en un rango de
Superficies adsorbentes (fijadoras) de boro en los
suelos
El
B adsorbido por la superficie de los suelos se percibe como no tóxico para las
plantas y entre los adsorbentes que lo componen están: óxidos de hierro y
aluminio, hidróxido de magnesio, carbonato de calcio, minerales de arcilla y
materia orgánica. Los óxidos de aluminio
y hierro juegan un importante papel en el comportamiento de retención de B en
los suelos, por lo que numerosos estudios han investigado la retención del
elemento tanto en las formas amorfas como cristalinas de estos óxidos,
observándose un incremento positivo con el pH hasta una retención máxima a pH
Otra
importante superficie adsorbente de B en los suelos la constituyen los
minerales de arcilla, en el orden de retención del elemento por gramo: caolinita < montmorillonita
< illita, los cuales exhiben incrementos de
retención positivos con el pH de la solución presentando un máximo a valores
entre 8 y 10. Este proceso de retención
se considera ocurre en dos pasos, donde inicialmente el B es rápida y
exotérmicamente adsorbido sobre las partículas externas de la arcilla mediante
un mecanismo de intercambio de ligando con grupos hidroxilos con su subsecuente
migración e incorporación dentro de los sitios tetrahedrales
desplazando aluminio y silicio de la estructura a través de una lenta reacción
endotérmica de fijación. En estos procesos la magnitud de la retención del
elemento aumenta con el incremento de la fuerza iónica y con el contenido de
agua de la solución, siendo afectada no sólo por la presencia de aniones
competitivos tales como fosfato que la reducen sustancialmente, mientras que
otras especies que incluyen cloruro, nitrato y sulfato tienen muy poco efecto
sino también por el catión intercambiable incrementándose en arcillas de calcio
en comparación con las de potasio o sodio debido a la formación del par iónico
borato de calcio (Keren y Gast,
1981). Sobre la base de un gramo de
mineral se ha establecido que las arcillas adsorben significativamente menos B
que la mayoría de los óxidos minerales (Goldberg,
1997).
Una
manera efectiva de incrementar la retención de B en los suelos es mediante la
aplicación de carbonato de calcio (abono con cal) cuyo efecto es incrementar el
pH de la solución, además de actuar como una importante cavidad adsorbente del
elemento en suelos calcáreos a través de un probable mecanismo de intercambio
con grupos carbonato. En calcitas de
referencia la retención de B se incrementó con el incremento del pH de la
solución desde
Otro
importante componente de los suelos que afecta su disponibilidad de B lo
constituye la materia orgánica, existiendo una correlación altamente
significativa (muy próxima a 1) entre el B natural, el B soluble en agua
caliente, el B retenido y la retención máxima de B con respecto al contenido de
carbono orgánico en dichos suelos (Elrashidi y O’Connor, 1982).
Sobre la base de un gramo se ha establecido que la materia orgánica del
suelo adsorbe más B que sus constituyentes minerales, lo cual puede ser
incrementado por la adición de abonos contentivos de carbono orgánico a estos
tipos de suelo (Yermiyaho et al, 1995), existiendo a su vez un incremento positivo de la
magnitud de la retención con la fuerza iónica y el pH de la solución (Yermiyahu et al,
1988) con un máximo alrededor de 9 (Gu y Lowe, 1990). Este
proceso de retención de B sobre la materia orgánica ocurre rápidamente,
estableciéndose el equilibrio de reacción después de tres horas, a través de un
probable mecanismo de intercambio de ligando (Yermiyahu
et al, 1988) con la formación de
complejos B-diol, monoquelados
y biquelados a partir de los productos de ruptura de
la materia orgánica del suelo, lo cual ha sido observado mediante espectroscopía de resonancia magnética nuclear, cuyos
resultados corresponden con las siguientes estructuras (Coddington
y Taylor, 1989):
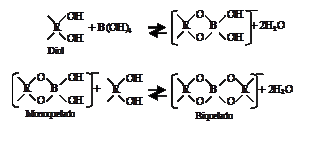
La
materia orgánica es importante en la distribución de B entre las fases sólida y
líquida en los suelos determinando su consumo por las plantas dependiendo del
contenido total. De esta manera, en un
suelo con alto contenido en B total se logra una reducción de su forma soluble
adicionando materia orgánica evitando así la toxicidad en la planta; mientras
que en suelos arenosos, donde la lixiviación reduce los niveles de B total, la
adición de materia orgánica puede reducir la lixiviación e incrementar la
nutrición del elemento en la planta (Yermiyahu et al, 2001).
Modelos de adsorción (retención)
y desorción (liberación) de boro
A través de los años las reacciones
de retención de B en los suelos han sido descritas usando diferentes modelos
clasificados como empíricos y químicos.
Los modelos empíricos continúan siendo aplicados para proporcionar
descripciones, mediante un ajuste de los datos experimentales que no necesitan
una base teórica, usando la ecuación de isoterma de adsorción de Langmuir, la ecuación de isoterma de adsorción de Freundlich (Evans, 1987; Goldberg
y Forster, 1991; Gu y Lowe, 1992; Lehto, 1995; Mondal et al,
1993) y el modelo de Keren (Keren
y Sparks, 1994; Keren et al, 1994; Yermiyahu
et al, 1988; Yermiyahu
et al, 1995). A diferencia de las ecuaciones de Langmuir y Freundlich, el modelo
de Keren, que es una ecuación fenomenológica, tiene
la ventaja de incluir la variable pH por lo que puede describir el
comportamiento de la retención de B en condiciones cambiantes del pH de la solución
(Goldberg, 1997).
Por otro lado, a través de los modelos químicos se tiene descripción de
la retención de B basada en un enfoque de equilibrio por formación de complejos
con grupos hidroxilo presentes en las superficies minerales, por lo que también
se conocen como modelos de complejación superficial,
sobre un amplio rango de condiciones experimentales que definen matemáticamente
las especies de la superficie, las reacciones químicas, el balance de masa y
carga, el coeficiente de actividad y la constante de equilibrio; siendo
extensivamente aplicables, con capacidad predictiva, en condiciones cambiantes
de la solución con respecto a la concentración de B, pH y fuerza iónica (Goldberg, 2004a).
Los tipos de modelos de complejación
superficial química aplicados para describir la absorción del B en suelos
incluyen el modelo de capacitancia constante (Goldberg,
2004a; Goldberg y Glaubig,
1988; Goldberg et
al, 1993; 2003; 2004; 2005a; Toner y Sparks, 1995), el modelo de triple capa (Goldberg, 2004b; Singh y Mattigod,
1992; Toner y Sparks, 1995)
y el modelo de cuadruple capa (Barrow, 1989; Bloesch et al, 1987). En contraste a las reacciones de retención de
B, hasta ahora es poca la investigación relacionada con las reacciones de
liberación del elemento en los suelos, donde algunos estudios indican que las
mismas son reversibles (Bloesch et al, 1987; Keren y Gast,
1981), y otros que son histeréticas (Harder, 1961; Jasmund y Lindner, 1973), con
esto último atribuido a la formación de enlaces dihidróxi-
e hidróxicarboxis entre el B y la materia orgánica (Yermiyahu et al,
1988). Los modelos de retención de B
empíricos y químicos son también utilizados para describir las reacciones de
liberación del elemento en los suelos para sistemas no histéricos en función del
tiempo, correspondiendo a una ecuación de velocidad de primer orden (Sharma et al,
1989).
Análisis de boro en muestras de
suelo
Los análisis de suelos se realizan
con la finalidad de determinar su calidad fértil a manera de tomar las previsiones
necesarias de acuerdo a los resultados obtenidos para un determinado campo de
cultivo que se pretenda utilizar para la producción agrícola sustentable (Haby y Leonard, 2005);
Así, tal investigación previa incluye determinar la cantidad de B disponible
para las plantas mediante diferentes métodos (Carter et al, 2003; Tsadilas y Kazan, 2005), para conocer si presenta deficiencia o exceso
del elemento, donde el muestreo es esencial para asegurar la obtención de una
muestra que sea representativa del campo en estudio y para asegurar la
precisión y confiabilidad de los resultados obtenidos (Bamley y Janik,
2005). Para realizar la medida del
elemento usando un sistema de detección, es necesario tratar previamente la
muestra mediante un procedimiento de extracción o de descomposición dependiendo
del tipo de material a analizar (Sah y Brown, 1997a).
Preparación de las muestras
La preparación de la muestra
constituye un paso crítico durante cualquier proceso de análisis y en el caso
de las determinaciones de B deben ser considerados diversos factores que van a
depender principalmente del tipo de muestra de suelo a ser analizada y de la
instrumentación utilizada finalmente para realizar la medida.
El B presente en los suelos comúnmente se divide en tres
categorías que son B total, B soluble en ácido y B soluble en agua, siendo este
último el indicador más confiable del contenido de B disponible para las
plantas. Una clasificación más
fraccionada corresponde a cinco tipos: 1) B fácilmente soluble, 2) B
específicamente adsorbido, 3) B enlazado a óxidos, 4) B enlazado orgánicamente
y 5) B ocluido o residual (Badr-Uz-Zaman et al,
1999; Hou et al,
1994). El procedimiento más
extensivamente utilizado para determinar el contenido de B disponible para las
plantas en suelos es el método de extracción en agua caliente, desarrollado
específicamente para este elemento en 1940 y desde entonces hasta nuestros días
ha sido objeto de numerosas modificaciones en procedimientos cuya base sigue
siendo el calentamiento con agua hirviendo durante 5 min (Keren,
1996). Algunos problemas asociados a este método son su poca adaptabilidad a
los análisis de rutina debido a que son procedimientos laboriosos con un alto
consumo de tiempo (Deabreu et al, 1994) que requieren precauciones especiales para evitar
contaminación. Otras dificultades son que la cantidad de B extraída está
afectada por el tiempo de reflujo (McGeehan et al, 1989), el tiempo de extracción y
la temperatura (Spouncer et al, 1992) ya que el B puede ser readsorbido
durante el período de enfriamiento, lo cual tiene un efecto más pronunciado en
los casos donde es necesario el uso de carbón activado, que, además de adsorber
las impurezas coloreadas del extracto caliente proveniente de algunos tipos de
suelos (Gupta, 1967), puede adsorber parte del B
disminuyendo su concentración en el extracto (McGeehan
et al, 1989).
A través de los años han surgido
diferentes alternativas del método de extracción en caliente como propuestas
convenientes para determinar la disponibilidad de B en las plantas las cuales
incluyen: extracción con agua o con 2 mmol L-1
de DTPA a temperatura ambiente (Handreck, 1990),
extracción con agua o con una solución de BaCl2 y calentamiento con
microondas (Deabreu et al, 1994), extracción con sorbitol (Vaughan
y Howe, 1994) extracción con 1 equiv-g
L-1 de NH4OAc (pH=7) (Sakal et al, 1993), extracción con CaCl2
(Ferreira et al, 2001), extracción
con agua caliente presurizada (Webb et al, 2002) y con DTPA-sorbitol (Carter
et al, 2003; Shiffler
et al, 2005a; 2005b). Una variedad de métodos de extracción han
sido reportados para determinar los niveles adecuados de B en los suelos para
el desarrollo y producción de diferentes tipos de cultivos (Chang et al, 1983; Golberg
et al, 2003; 2005b; Hue et al, 1988; Rashid et al,
1994; Sakal et
al, 1993). En un estudio reciente de
evaluaron de los diferentes extractantes utilizados
para predecir la cantidad de B disponible en los suelos para las plantas
resultando el siguiente orden: 0,01 mol L-1 de CaCl2
caliente > agua caliente > 1,0 mol L-1 de NH4OAc
(pH=4,8) > sorbitol + NH4OAc + TEA = manitol + NH4OAc
+ TEA > manitol + CaCl2 > ácido salicílico + NH4OAc
+ TEA, indicando que los dos primeros extractantes
son los más apropiados para este propósito (Chaudhary
y Shukla, 2004).
En los casos donde la muestra de
suelo a analizar requiera una completa descomposición es necesario su
tratamiento por fusión alcalina (Smith et
al, 1991) o por digestión húmeda usando HF o una mezcla de éste con otros
ácidos (Alaimo y Censi,
1992; Ricci et
al, 1994; Vanhaecke et al, 1991). En la
descomposición por fusión se ha reportado el uso de compuestos tales como NaOH, KOH, Cs2CO3 (Hofstetter et al,
1991; Mushashi et
al, 1990; Smith et al, 1991) y
CaCO3, siendo este último el más extensivamente utilizado a pesar de
que se han notado ciertas ventajas del Cs2CO3 sobre CaCO3
para ciertas determinaciones específicas por espectrometría de masa (Beary y Xiao, 1990). Más recientemente, se ha utilizad Na2CO3
combinado con ZnO como mezcla para descomposición de
la muestra (Lihareva
et al, 2000). Otra alternativa de descomposición de la
muestra vía húmeda es calentándola con una mezcla de HF, HNO3 y HClO4
prácticamente hasta sequedad (Hu, 1991) con los
inconvenientes de la pérdida de analito por
volatilidad, característica de la formación de la especie BF3
(Ishikawa y Nakamura, 1990), además de que hay
cambios del fraccionamiento isotópico (Nakamura et al, 1992). Algunas propuestas sugeridas para ayudar a
solventar estas dificultades son, además del control de la temperatura de
evaporación, adicionar manitol para formar el complejo B-manitol, evitando la
formación de la especie volátil BF3, durante la digestión con HF (Chen et al, 1991;
Karunasagar et al, 2000; Nakamura et al, 1992) y usar H3PO4
en la mezcla de digestión HNO3/HClO4/HF (Evans y Meisel, 1994).
Otras dificultades a considerar
durante la preparación de la muestra, previo a la medida con un sistema de
detección, son los problemas de interferencia de matriz comunes en los análisis
de B.
Los
métodos de reducción de estas interferencias tales como simulación de matriz,
adición estándar y dilución de isótopos son frecuentemente adecuados para
sobrellevar dichos efectos. Sin embargo,
la presencia de sustancias tales como sales en altas concentraciones en
extractos de suelos, digeridos por fusión alcalina, además de ciertas
sustancias orgánicas y especies que interfieren directamente con la señal del
B, hacen algunas matrices de muestra muy difíciles de analizar. Bajo estas condiciones, el B necesita ser
separado de la matriz de la muestra. Si
la concentración del interferente en la muestra original es muy baja para ser
medida exactamente, entonces la separación es combinada con la preconcentración del mismo en la nueva matriz. En la literatura se han reportado diferentes
métodos de separación y preconcentración de B que
incluyen extracción con solvente (García et
al, 1985; Coedo et al, 1996; Novozamsky et al, 1990; Panov
et al, 1989), separación por
intercambio iónico (Aggrawal y Palmer, 1995; Bebek et al,
1996; Chapman et
al, 1996; Coedo et al, 1993; Evan y Meisel,
1994; Gregoire, 1987; Hemming
y Hanson, 1994; Jin et al, 1996; Motomizu et al, 1990; Nakamura
et al, 1992; Ricci
et al, 1994; Smith et al, 1991; Wang et al, 1996), quelación (Gregoire, 1987; Oxspring,
et al, 1995) y separación gaseosa como metilborato (Carrero et
al, 2005; Johnson et al, 1992;
Molinero et al, 1993; Musashi et al,
1990; Novozamsky et
al, 1988; Sanz et al, 1990).
Técnicas de
análisis para la determinación de boro
Existe
una gran variedad de técnicas analíticas usadas para la determinación de B, las
cuales han evolucionado a la par de los avances en la tecnología instrumental
analítica a lo largo de la historia de la investigación de este elemento,
siendo muy pocas las que han tenido aplicación en el análisis de suelos (Sah y
Brown, 1997b). La mayoría de estos
métodos de análisis involucran la determinación espectrofotométrica, la cual
enfoca el uso de reacciones específicas del elemento con compuestos capaces de
formar un complejo coloreado, basada en
la extracción de asociaciones iónicas formadas por complejos aniónicos con colorantes
cationicos y en la formación de quelatos de ésteres de ácido bórico con
moléculas colorantes. Un número de
métodos bien conocidos usan reactivos específicos para el desarrollo del
color, el cual es medido a una longitud de onda característica, entre los
cuales se pueden mencionar: curcumina, carmina, azul de metileno, azometina-H
y otros tales como quinalizarina, arsenazo
y violeta cristal, siendo el método que utiliza azometina-H
como reactivo cromogénico el método
espectrofotométrico de determinación de B más comúnmente usado en los análisis
de suelo (Campana et al, 1992; Chaudhary y Shukla, 2004; Chen et al, 1989;
Ferreira et al, 2001; Kaplan et al, 1990; McGeehan
et al, 1989; Yermiyahu
et al, 2001; Zaijun
et al, 1999; Zarcinas,
1995); debido a su rapidez, simplicidad, sensibilidad y a que no requiere de
ácidos concentrados lo cual lo hace apropiado para la automatización mediante
el uso de sistemas que utilizan diferentes diseños bien sea por inyección en
flujo (Carrero et al, 1993; Chen et al, 1989;
Gómez et al, 2005) o por flujo
continuo (Carrero et al, 2005),
siendo este último desarrollo metodológico aplicado muy recientemente a la
determinación del estatus de B en suelos de plantaciones de café en dos
localidades cafetaleras de Venezuela (Malavé et al, 2005).
Los métodos espectrofotométricos en
general sufren interferencias de diversas especies que incluyen Al, Cu, Fe, Zn
y Mo (Arruda y Zagatto,
1990). El pH de la muestra,
especialmente en el rango de
La
introducción del plasma como fuente de ionización y el resultante desarrollo de
la espectrometría de emisión atómica (AES), también llamada espectrometría de
emisión óptica (OES), con plasma acoplado inductivamente (ICP) resultaron en
una significativa mejora en las tecnologías de determinación de B ya que
proporcionaron sensibilidades más altas y capacidades de detección más bajas en
relación con los métodos espectrofotométricos con mejores cualidades analíticas
para el análisis de suelos (Goto et al, 1992; Jeffrey y McCallum, 1988; Manzoori, 1980; Pillay et al, 2002; 2005; Pollmann
et al, 1993; Pritchard
y Lee, 1984; Spiers et al, 1990; Spouncer et al, 1992; Sun
et al, 1998).
El desarrollo de
CONCLUSIONES
El desarrollo y crecimiento óptimo
de las plantas se logra siempre y cuando las condiciones del suelo sean
adecuadas para proporcionar todos los elementos esenciales necesarios incluyendo
al B, cuyos niveles como micronutrimento son
difíciles de manejar debido no sólo al rango tan estrecho entre sus valores de
deficiencia y toxicidad en la solución del suelo, sino también al hecho que un
determinado nivel de concentración puede resultar adecuado, deficiente o tóxico
para una planta dependiendo de su especie.
Por lo tanto es necesario determinar el estatus de B en los suelos
considerando los diversos factores involucrados en su retención y liberación
por parte de los minerales que lo componen mediante correlaciones y
calibraciones en diferentes suelos utilizando diversos cultivos, a manera de
recabar la mayor cantidad de información basada en determinaciones
experimentales que permitan predecir si las cantidades de B presentes en la
solución del suelo disponible para las plantas serán beneficiosas o dañinas
para así tomar las previsiones necesarias antes de proceder a las plantaciones.
LITERATURA CITADA
Aggrawal, J. y M. Palmer. 1995. Boron isotope
analysis-A review. Analyst, 120(5): 1301-1307.
Alaimo, R. y P. Censi. 1992.
Quantitative determination of major, minor, and trace elements in USGS rock
standards by inductively coupled plasma-mass spectrometry. At. Spectrosc., 13(1-2): 113-117.
Apostol, K. y J. Zwiazek. 2004.
Boron and water uptake in jack pine (Pinus banksiana) seedlings. Envirom.
Exp. Bot., 51(2): 145-153.
Arruda, M. y
Aucejo, A.; J. Ferrer, C. Gabaldón,
P. Marzal y A. Seco. 1997.
Diagnosis of boron, fluorine, lead, nickel and zinc toxicity in citrus
plantations in
Badr-Uz-Zaman, R. y M. Salim. 1999. Plant utilization and
release of boron distributed in different fractions in calcareous soils. Arid Soil Res. Rehabil., 13(3): 293-303.
Baghour, M.; D. Moreno, G. Villora,
J. Hernández, N. Castilla, L. Romero. 2002. The influence
of the root zone temperatures on the phytoextraction
boron and aluminium with potate
plant growing in the field. J. Environ.
Sci. Health Part A. Tox. Hazard Subst. Environ.
Barranco, W. y D. Curtis. 2004. Boris acid
inhibits human prostate cancer cell proliferation. Cancer Letters, 216(1):
21-29.
Barrow,
N. 1989. Testing a mechanistic model. X. The effect of pH and electrolyte
concentration on borate sorption by a soil. J. Soil Sci., 40(3-4): 427-435.
Beary, E. y Y. Xiao. 1990.
Rapid and high-precision determination of boron isotope ratios in boron carbide
by thermal ionization mass spectrometric measurement of the dicaesium
metaborate cation. Analyst,
115(7): 911-913.
Bebek, M.; K. Mitko y J. Kwapulinsk. 1996. Determination of aluminium,
barium, molybdenum, scandium, beryllium, titanium, vanadium, fluoride and boron
in highly salinated waters. Wat.
Sci. Tech., 33(6): 349-356.
Bloesch, P.; L. Bell y J. Hugues. 1987. Adsorption and desorption of boron by
goethite. Aust. J. Soil Res., 25(4): 377-390.
Bolaños,
L. Lukaszewski, I. Bonilla y D. Blevins.
2004. Why boron?. Plant Phys. Biochem.,
42(11): 907-912.
Bramley, R. y Janik, L. 2005. Precision agriculture demands
a new approach to soil and plant sampling and analysis-examples from
Cakmak,
Camacho-Cristóbal, J.; D. Anzellotti
y A. González-Fontes. 2002. Changes in
phenolic metabolism of tobacco plants during short-term boron deficiency. J. Plant Physiol., 40(12): 997-1002.
Camacho-Cristóbal, J.; J. Maldonado y A.
González-Fontes. 2005. Boron
deficiency increases putrescine levels in tobacco
plants. J. Plant
Physiol., 162(8): 921-928.
Campana,
A.; F. barrero y M. Ceba. 1992. Spectrofluorimetric determination of
boron in soils, plants and natural waters with alizarin red-S. Analyst, 117(7): 1189-1191.
Carrero,
P.; J. Burguera, M. Burguesa y C. Rivas.
Carrero,
P.; A. Malavé, E. Rojas, C. Rondón, Y. Petit de Peña,
M. Burguera y J. Burguera. 2005. On-line
generation and hydrolysis of methyl borate for the spectrophotometric
determination of boron in soil and plants with azomethine-H,
Talanta, 68(2): 374-371.
Carter, D.; K. Harper, A. Shiffler, V.D. Jolley y J.K.
Harper. 2003. Relationship between soil extractable boron and tissue
concentrations in rosaceae shrubs in
Chang, S.;
Chapman,
V.; G. Kerven, D. Edwards, C. Asher y F.. Blammey. 1996. Determination of low boron concentrations in
nutrient solution. Plant soil, 180(1): 97-99.
Chen, D.; F. Lázaro, M. Decastro y M. Valcarcel. 1989. Direct spectrophotometric determination of total
boron in soils with ultrasonic leaching in automatic flow systems. Anal. Chim.
Acta, 222(2): 221-227
Chen, J.; H. Lin y M. Yang. 1991. Spectrophotometric
determination of trace and ultratrace levels of boron
in silicon and chlorosilane samples. Fres. J. Anal.
Chem., 340(3-4): 357-362.
Coddington, J. y M. Taylor. 1989. High field 11B and
Coedo, A.; T. Dorado, E. Escudero e I. Cobo. 1993. Boron determination
in steels by inductively coupled plasma atomic emission
spectrometry-comparative study of spark ablation and pneumatic nebulization
sampling systems. J. Anal. At. Spectrom., 8(6): 827-831.
Deabreu, C.; M. Deabreu, B. Vanraij y O. Bataglia. 1994.
Extraction of boron from soil by microwave heating for ICP-AES determination.
Comm. Soil Sci. Plant Anal., 25(19-20): 3321-3333.
Devirian,
T. y S.L. Volpe. 2003. The physiological effects of dietary boron. Crit. Rev.
Food Sci. Nutr. 43(2): 219-231.
Din, V. 1984. The preparation of
iron-free solutions from geological materials for the determination of boron
(and other elements) by inductively coupled plasma emission spectrometry. Anal.
Chim. Acta, 159(1):
387-391.
Dzondo-Gadet,
M; R. Mayap-Nzietchueng, K. Hess, P. Nabet, F. Belleville, B. Dousset.
2002. Action of boron at the molecular level effects on transcription and
translation in an acellular system. Biol. Trace Elem.
Res. 85(1): 23-33.
Elrashidi,
M. y G. O’Connor. 1982. Boron sorption and desorption in soils. Soil Sci. Soc.
Am. J., 46(1): 27-31.
Evans, L. 1987. Retention of boron
by agricultural soils from
Evans,
S. y U. Krahenbuhl. 1994. Boron analysis in
biological material-microwave digestion procedure and determination by
different methods. Fres. J. Anal. Chem., 349(3-4): 454-459.
Evans, S. y T. Meisel.
1994. Low blank determination of boron in geochemical materials. Anal.
Chim. Acta, 298(2): 267-270.
Ferreira, G.; R. F. Fontes, M.
Fontes y V. Alvares. 2001. Comparing calcium chloride,
barium chloride, and hot water extractions and testing activated charcoal plus azomethine-H dosage for boron determination in brazilian soils. Comm. Soil Sci. Plant Anal., 32(19-20):
3153-3167.
Fort, D. 2002. Boron deficiency
disables xenopus laevis
oocyte maturation events. Biol. Trace Elem. Res. 85(2): 157-169.
Fort, D.; E. Stover, R. Strong, F.
Jay Murray. 1999. Effects of boron deprivation on reproductive parameters in Xenopus laevis. J.
Trace Elem. Exp. Med. 12(3): 187-204.
Fort, D.J.; E.L. Stover, R.L.
Rogers, H.F. Copley,
Fort, D.; R. Rogers, D. Mclaughin, C. Sellers y C. Schlekat.
2002. Impact of boron deficiency on Xenopus laevis: a summary of biological effects and potential
biochemical rol. Biol. Trace Elem. Res. 90(1-3):
117-142.
García,
Ghanati,
F.; A. Morita y H. Yokota. 2005. Deposition of suberin
in roots of soybean induced by excess boron. Plant Sci., 168(2): 397-405.
Chaudhary,
D. y L. Shukla. 2004. Evaluation of extractants for predicting availability of boron to mustard
in arid soils of
Goldbach, H.; Q. Yu, R. Wingender, M. Schulz, M. Wimmer,
P. Findeklee y F. Baluska. 2001. Rapid response reactions of
roots to boron deprivation. J. Plant Nutr. Soil Sci.,
164(2): 173-181.
Goldberg, S. 1997. Reactions of
boron with soils. Plant Soil, 193(1-2): 35-48.
Goldberg, S. 2004a. Modeling boron
adsorption isotherms and envelopes using the constant capacitance model. Vadose Zone J., 3(2): 676-680.
Goldberg, S. 2004b. Inconsistency
in the triple layer model description of ionic strength dependent boron. Soil
Sci. Soc. Am., paper No 3972.
Goldberg, S y H. Forster. 1991.
Boron sorption on calcareous soils and reference calcites. Soil Sci., 152(3-4):
304-310.
Goldberg, S y R. Glaubig. 1988. Boron and silicon adsorption on an aluminum
oxide. Soil Sci. Soc. Am. J., 52(1): 87-91.
Goldberg, S.; H. Forster, y E. Heick. 1993.
Boron adsorption mechanisms on oxides, clay minerals and soils inferred from
ionic strength effects. Soil Sci. Soc. Am. J., 57(3): 704-708.
Goldberg, S.; D. Suarez, N. Basta y S. Lesch. 2004.
Predicting boron adsorption isotherms by midwestern
soils using the constant capacitance model. Soil Sci. Soc. Am. J., 68(3):
795-801.
Goldberg, S.; P. Souse,
Goldberg, S.; P. Souse,
Goldberg, S.; P. Souse,
Gómez, D.; M. Segundo, J. Lima y A. Rangel. 2005.
Spectrophotometric determination of iron and boron in soil extracts using a
multi-syringe flow injection system. Talanta, 66(3):
703-711.
Goto,
I.; J. Muramoto y M. Ninaki.
1992. application of inductively coupled plasma atomic emisión
spectrometry (ICP-AES) to soil análisis (Part 5)
determination of hot water soluble boron in soil by ICP-AES. Jap. J. Soil Sci.
Plant Nutr., 63(1): 53-57.
Gu,
B. e
Gu,
B. y
Gupta, U.
Gupta, U. 2002. Boron and its role
in crop production.
Gupta, U. y
S. Gupta. 2005. Future trends and
requirements in micronutrient research. Comm. Soil Sci. Plant Anal., 36(1-3):
33-45.
Haby,
V. y A. Leonard. 2005. Sustainable alfalfa production on coastal plain soils of
the
Handreck,
K. 1990. Methods of assessing boron availability in potting media with special
reference to toxicity. Comm. Soil Sci. Plant Anal., 21(13-14): 2265-2280.
Harder, H. 1961. Einbau von bor in detritische
tonminerale. Experimente zur erklarung des borgehaltes toniger sedimente. Geochim. Cosmochim.
Acta, 21(3-4): 284-294.
Hemming,
N. y G. Hanson.
Hou,
J.; L. Evans y G. Spiers. 1994. Boron fractionation
in soils. Comm. Soil Sci. Plant Anal., 25(11-12): 1841-1853.
Hu, W. 1991. Determination of boron
in high-purity silica using direct current plasma emission spectrometry. Anal. Chim. Acta, 245(1): 207-209.
Hu, H. y P. Brown. 1997. Absorption
of boron by plant roots. Plant Soil, 193(1-2): 49-58.
Hung, C. 1994. The biochemical
effects of physiologic amounts of dietary boron in animal nutrition models.
Environ. Health Perspect. 102(Supl.
7): 35-43.
Hung, C. 2003. Dietary boron: an
overview of the evidence for its role in immune function. J. Trace Elem. Exp.
Med. 16(4): 291-306.
Ishikawa, T. y E. Nakamura. 1990.
Suppression of boron volatilization from hydrofluoric acid solution using
boron-mannitol complex. Anal. Chem., 62(23):
2612-2616.
Jasmund,
K. y B. Lindner. 1973. Experiments on the fixation of boron by clay minerals.
Proc. Int. Clay Conf. 1972, 399-412.
Jeffrey,
A. y L. McCallun. 1988. Investigation of a hot
Jin, Q.; H. Zhang, F. Liang y W.
Yang. 1996. Determination of trace amounts of boron by microwave plasma porch
atomic emission spectrometry using an on-line separation and preconcentration technique. J. Anal. Atom. Spectrom., 11(5): 331-337.
Johnson, D.; D. Siemer
y W. Bauer. 1992. Determination of nanogram levels of
boron in milligram-sized tissue samples by inductively coupled plasma atomic
emission spectroscopy. Anal. Chim. Acta, 270(1):
223-230.
Kaplan, D.; W. Burkman, D.
Adriano, G. Mills y K. Sajwan. 1990.
Determination of boron in soils containing inorganic and organic boron sources.
Soil Sci. Soc. Am. J., 54(4): 708-714.
Karunasagar, D.; K. Dash, K. Chandrasekaran y J. Arunachalam.
2000. ICP-MS determination of trace amounts of boron in high-purity quartz. At.
Spectrosc.,
21(3-4): 216-219.
Keren,
R. 1996. Boron. In: D.L. Sparks eds. Methods of soil analyses. Part 3: chemical
methods. Soil Science Society of
Keren, R. y R. Gast. 1981. Effects
of wetting and drying, and of exchangeable cations,
on boron adsorption and release by montmorillonite.
Soil Sci. Soc. Am. J., 45(3): 478-482.
Keren,
R. y R. Gast. 1983. pH-dependent boron adsorption by montmorillonite hydroxyl-aluminum complexes. Soil Sci. Soc.
Am. J., 47(5): 1116-1121.
Keren,
R.; P. Gross y D. Sparks. 1994. Equilibrium and kinetics of borate
adsorption-desorption on pyrophyllite in aqueous
suspensions. Soil Sci. Soc. Am. J., 58(5): 1116-1122.
Keren,
R. y D.
Kucharkowski,
R.; E. Muller y D. Wustkamp. 1996. Determination of
boron in amorphous and nanostructured soft magnetic alloys ribbons and layered
materials by ICP atomic emission spectrometry. Fres. J. Anal.
Chem., 355(3-4): 256-260.
Ladrón, J.
y V. Moya. 1995. Toxicología Médica. 1ra edn, Interamericana McGraw-Hill. pp
179-184.
Lægreid, M.; O. Bøckman y O. Kaarstad. 1999. Agriculture, fertilizers, and the
environment. CABI Publishing in association with Norsk
Hydro ASA,
Lakatos, B.; K. Kaiserová,
J. Orlicky, V. Knézi, L. Varecka. 2002. The effect of boromycin on the Ca+2
homeostasis. Molec. Cell. Biochem., 231(1): 15-22.
Lehto, L. 1995. Boron retention in limed forest mor. For. Ecol. Manage, 78(1): 11-20.
Lihareva, N.; P. Kosturkova
y Ts. Vakarelska. 2000. Application of sodium carbonate-zinc
oxide decomposition mixture on ICP-AES determination of boron in tourmaline, Fres. J. Anal. Chem., 367(1): 84-86.
Malavé, A.; P. Carrero, M. Lemus y M. García. 2005. Boron
content in Coffee plantations (Coffea arabica) in two locations of
Malina, G. 2004. Ecotoxicological
and environmental problems associated with the former chemical plant in
Manzoori, J. 1980. Inductively-coupled plasma-optical emission
spectrometry. Application to the determination of molybdenum, cobalt and boron
in soil extracts. Talanta, 27(8): 682-684.
Matilainen, R. y J. Tummavuori. 1995.
Determination of boron in fertilizers by inductively coupled plasma-atomic
emission spectrometry – Studies of some spectral interferences at different
wavelengths. J. AOAC Int. 78(3): 598-604.
McGeehan,
S.; K. Topper y D. Naylor. 1989. Sources of variation in hot water extraction
and colorimetric determination of soil boron. Comm. Soil Sci. Plant Anal., 20(11-12): 1777-1786.
McGraw-Hill. 2004. Tabla Periódica.
Interamericana de España, S.A.U. Disponible en:
http://www.mcgraw-hill.es/bcv/tabla_periodica/mc.html
Mertz, W. 1993. Essential trace
metals: new definitions based on new paradigms. Nutr. Rev.
51(10): 287-295.
Molassiotis,
A.; T. Sotiropoulos, G. Tanou, G. Diamantidis
e I. Therios. 2005.
Boron-induced oxidative damage and antioxidant and nucleolytic
responses in shoot tips culture of the apple rootstock EM 9 (Malus domestica Borkh). Environ. Exp. Bot. In Press.
Molinero, A.; A. Ferrer
y J. Castillo. 1993. Volatilization of methyl borate in iron
matrix-determination of boron in steel by ICP atomic emission spectrometry. Talanta, 40(9):
1397-1403.
Mondal, A.; B. Mandal y L. Mandal. 1993. Boron adsorption characteristics of some
acidic alluvial soils in relation to soil properties. Comm. Soil Sci. Plant
Anal., 24(15-16): 2553-2567.
Motomizu,
S.; M. Oshima y Z. Jun. 1990. Anion-exchange
chromatographic behaviour of the complex of boron
with H-resorsinol-sensitive determination of boric
acid. Analyst, 115(4): 389-392.
Musashi,
M.; T. Oi, T. Ossaka y H. Kakihana. 1990. Extraction of boron from GSJ rock reference
samples and determination of their boron isotopic ratios. Anal. Chim. Acta, 231(1):
147-150.
Nable, R.; G. Bañuelos y J. Paull.
1997. Boron toxicity. Plant Soil,
193(1-2): 181-198.
Nakamura,
E.; T. Ishikawa, J. Birck y C. Allegre.
1992. Precise boron isotopic analysis of natural rock samples using a boron mannitol complex. Chem. Geol., 94(3): 193-204.
Nielsen, F. 1991. Nutritional
requirements for boron, silicon, vanadium, nickel, and arsenic: current
knowledge and speculation. FASEB J. 5(12):
2661-2667.
Nielsen, F. 1992. Facts and
fallacies about boron. Nutr. Today 27(1): 6-12.
Nielsen, F. 1994. Biochemical and
physiology consequences of boron deprivation in humans. Environ. Health Perspect. 102(Supl. 7): 59-63.
Nielsen, F. 1996. Evidence for the
nutritional essentiality of boron. J. Trace Elem. Exp. Med. 9(4): 215-229.
Nielsen, F. 2000. Trace elements in
human health and disease: an update importance of making dietary
recommendations for elements designated as nutritionally beneficial,
pharmacologically beneficial, or conditionally essential. J. Trace Elem. Exp.
Med. 13(1): 113-129.
Novozamsky, I.; R. Vaneck,
J. Vanderlee, V. Houba y G.
Ayaga. 1988. Continuous flow technique for generation
and separation of methyl borate from iron-containing matrices with subsequent
determination of boron by ICP-AES. At. Spectrosc., 9(1): 97-99.
Novozamsky, I.; y R. van Eck, V. Houba
y J. Vanderlee.
Oxspring, D.; S. McClean,
E. O`Kane, W. Smyth.
1995. Study of the chelation of boron with azomethine-H
by differential pulse polarography, liquid chromatography and capillary
electrophoresis and its analytical applications. Anal. Chim.
Acta, 317(1-3): 295-301.
Panov, V.; K. Semenko y Y. Kuzyakov. 1989. Determination of boron by extraction and molecular
emission spectrometry with pulse nebulization of extracts into flame. J. Anal.
Chem.
Papadakis,
I.; K.N. Dimassi, A. Bosabalidis,
I. Therios, A. Patakas y A.
Giannakoula. 2004a. Boron toxicity in ‛clementine’
mandarin plants grafted on two rootstocks. Plants Sci., 166(2): 539-547.
Papadakis,
I.; K. Dimassi, A. Bosabalidis,
I. Therios, A. Patakas y A.
Giannakoula. 2004b. Effects of B excess on some
physiological parameters of ‛navelina’ orange
plants grafted on two rootstocks. Environ. Exp. Bot., 51(3): 247-257.
Park, M.; Q. Li, N. Shcheynikov, W. Zeng y S. Muallem. 2004. NaBC1 is a ubiquitous electrogenic
Na+-coupled borate transporter essential for cellular
boron homeostasis and cell growth and proliferation. Molec.
Cell, 16(3): 331-341.
Peak, D.; G. Luther III y D.
Sparks. ATR-FTIR spectroscopic studies of boric acid adsorption on hydrous
ferric oxide. Geochim. Cosmochim.
Acta, 67(14): 2551-2560.
Pillay,
A.; J. Williams, M. El Mardi, S. Hassan y A. Al-Hamdi.
2002. Boron determination: a comparison between ICP-AES and 3He+-activation.
J. Radioanal. Nucl. Chem.,
254(2): 315-317.
Pillay,
A.; J. Williams, M. El Mardi, S. Hassan y A. Al-Hamdi.
2005. Boron and the alternate-bearing phenomenon in the date palm (
Ploquin, J. 1967. Le bore dans l`alimentation. Bull. Soc. Sci. Hyg. Aliment, 55(1): 70-113.
Pollmann, D.; J. Broekaert,
F. Leis, P. Tschopel y G. Tolg.
1993. Determination of boron in biological tissues by inductively coupled
plasma optical emission spectrometry (ICP-OES). Fres.
J. Anal. Chem., 346(3-4): 441-445.
Power,
P. y W. Woods. 1997. The chemistry of boron and its speciation in plants. Plant
Soil, 193(1-2): 1-13.
Pritchard, M. y J. Lee. 1984. Simultaneous determination of boron,
phosphorus and sulphur in some biological and soil
materials by inductively-coupled plasma emission spectrometry. Anal. Chim. Acta, 157(1): 313-326.
Ralston, N. y C. Hung. 2004. Transmembrane partitioning of boron and other elements in
RAW 264.7 and HL60 cell cultures. Biol. Trace Elem. Res. 98(2): 181-192.
Rashid,
A.; E. Rafique y N. Bughio. 1994. Diagnosing boron deficiency in rapeseed
and mustard by plant analysis and soil testing. Comm. Soil Sci. Plant
Anal., 25(17-18): 2883-2897.
Reid, R.;
J. Hayes, A. Post, J. Stangoulis y R. Graham.
Ricci, L.; P. Lanza y E. Lanzoni.
1994. Determination of boron in nickel-boron alloys. Ann. Chim., 84(3-4): 261-269.
Rico, H.; E. Crespo, E. Hernández, C. Seco y R. Crespo. 2002.
Influence of boron supplementation on vertebral and femoral bone mass in rats
on strenuous treadmill excercise: a morphometric, densitometric, and histomorphometric
study. J. Clin. Dens.
5(2): 187-192.
Rodgers, G. 1995. Química Inorgánica. McGraw-Hill/Interamericana de España, pp 415.
Ruiz, J.; R.M. Rosa y L. Romero. 2003.
Preliminary studies on the involvement of biosynthesis of cysteine and
glutathione concentration in the resistance to B toxicity in sunflower plants.
Plant Sci., 165(4): 811-817.
Sah, R. y P. Brown. 1997a. Techniques for boron
determination and their application to the analysis of plant and soil samples.
Plant Soil, 193(1-2): 15-33.
Sah, R. y P. Brown. 1997b. Boron determination – A
review of analytical methods. Microchem. J., 56(3):
285-304.
Sakal,
R.; S. Singh, A. Singh y N. Bhogal. 1993. Evaluation
of soil test methods for response of chickpea to boron in calcareous soil. Anal. Agric. Res., 14(3-4): 377-387.
Sanz, J.;
R. Martín, J. Galban y J. Castillo. 1990. Some
observations on the determination B in wine by flame emission spectrometry
after methyl borate generation in heterogeneous phase. Microchem.
J., 41(2): 164-171.
Seifferlein, E.; P. Jones, R. Ferguson,
R. Burt y D. Mays. 2005. Extractable acidity by a centrifuge method. Commun. Soil Sci. Plant Anal., 36(15-16): 2067-2083.
Sharma,
H.; N. Pasricha y M. Bajwa.
1989. Comparison of mathematical models to describe boron desorption from
salt-affected soils. Soil Sci., 147(1): 79-84.
Sheng,
M.; L. Tapper, H. Veit, E. Thomas, S. Ritchey y K-H.
Lau. 2001. Dietary boron supplementation enhances the effects of estrogen on
bone mineral balance in ovariectomized rats. Biol.
Trace Elem. Res., 81(1): 29-45.
Shiffler, A.; V. Jolley,
J. Christopherson, B. Webb, D. Farrer
y V. Haby. 2005a. Presurized
hot water and DTPA-sorbitol as viable alternatives for soil boron extraction.
I. Boron-treated soil incubation and efficiency of extraction. Commun. Soil Sci. Plant Anal., 36(15-16): 2179-2187.
Shiffler, A.; V. Jolley,
J. Christopherson, B. Webb, D. Farrer
y V. Haby. 2005b. Presurized
hot water and DTPA-sorbitol as viable alternatives for soil boron extraction.
I. Boron-treated soil incubation and efficiency of extraction. Commun. Soil Sci. Plant Anal., 36(15-16): 2189-2207.
Singh,
P. y S. Mattigod. 1992. Modeling boron adsorption on
kaolinite. Clays Clay Miner., 40(2): 192-205.
Smith,
F.; D. Wiederin, R. Houk,
C. Egan y R. Serfass. 1991. Measurement of boron
concentration and isotope ratios in biological samples by inductively coupled
plasma mass spectrometry with direct injection nebulization. Anal. Chim. Acta, 248(1): 229-234.
Sommer, A. y C. Lipman.
1926. Evidence of the indispensable nature of zinc and boron for higher green
plants. Plant Physiol., 1(1): 231-249.
Spiers, G.; L. Evans, S. McGeorge
y H. Moak, C. Su. 1990. Boron analysis of soil
solutions and plant digests using a photodiode-array equipped ICP spectrometer.
Comm. Soil Sci. Plant Anal.,
21(9-10): 1645-1661.
Spouncer, L.; R. Nable
y B. Cartwright.
Stavrianakou, S.; G. Liakopoulos
y G. Karabourniotis. 2005. Boron deficiency effects
on growth, photosynthesis and relative concentrations of phenolics
of Dittrichia viscose (Asteraceae).
Environ. Exp. Bot., In Press.
Su,
C. y D. Suárez. 1995. Coordination of adsorbed boron:
a FTIR spectroscopic study. Environ. Sci. Technol., 29(2): 302-311.
Sun,
D-H.; J. Waters y T. Mawhinney. 1998. Determination
of total boron in soils by inductively coupled plasma atomic emission
spectrometry using microwave-assisted digestion, Commun.
Soil Sci. Plant Anal., 29(15-16): 2493-2503.
Sutherland, B; L. Woodhouse, P. Strong
y J. King. 1999. Boron balance in humans. J. Trace Elem. Exp. Med. 12(3):
271-284.
Takagaki, M.; K. Ono, S-I. Masunaga, Y. Kinashi, Y. Sakurai,
T. Kobayashi, S-I. Miyatake y N. Hashimoto. 2001. 10B
quantitative determination in ppb range by particle tracks reading for boron
neutron capture therapy. J. Radioanal. Nucl. Chem., 247(2):
389-392.
Tjarks, W.; J.
Wang, S. Chandra, W. Ji, J. Zhuo,
A.J. Lunato, C. Boyer, Q. Li, E. Usova,
S. Eriksson, G. Morrison y G. Cosquer. 2001.
Synthesis and biological evaluation of boronated
nucleosides for boron neutron capture therapy (BNCT) of cancer. Nucleos. Nucleot. Nucl. acids, 20(4-7): 695-698.
Thellier, M.; A. Chevallier,
I. His, M. Jarvis, M. Lovell, C. Ripoll, D. Robertson, W. Sauerwein
y M. Verdus. 2001. Methodological developments for
application to the study of physiological boron and to boron neutron capture
therapy.
J. Trace Micropr. Techniq.,
19(4): 623-657.
Toner,
C. y D. Sparks. 1995. Chemical relaxation and double layer model analysis of
boron adsorption on alumina. Soil Sci. Soc. Am. J., 59(3-4): 395-404.
Tsadilas,
C. y P. Kazai. 2005. Evaluation of methods for
determination of soil boron available to apple trees. Comm. Soil
Sci. Plant Anal., 36(4-6): 695-700.
Vanhaecke,
F.; H. Vanhoe, C. Vandecasteele
y R. Dams. 1991. Precise determination of boron in titanium by inductively
coupled plasma mass spectrometry. Anal. Chim. Acta, 244(1): 115-122.
Wang, H.; Y. Chen y J. Wang. 1996.
Determination of boron in steels by on-line flow injection cation
exchange eliminating matrix inductively coupled plasma-atomic emission. Spectrom. Microchem. J. 53(1):
88-92.
Warington, K. 1923. The effect of boric acid and borax on the
broad bean and certain other plants.
Ann. Bot., 37(1): 629-672.
Warncke,
D. 2005. Ameliorating internal black spot in cranberry bean seed with boron
application. Comm. Soil Sci. Plant Anal., 36(4-6): 775-781.
Webb, B.; D. Hanks y V. Jolley.
Weissfloch,
L.; M. Wagner, T. Probst, R. Senekowitsch-Schmidtke, K. Tempel y M. Molls.
WHO.
1998. Environmental health criteria 204: boron.
WHO/FAO/IAEA.
1996. Trace elements in human nutrition and health. World Health Organization.
Wong, J.; R. Jiang y D. Su. 1998. The
accumulation of boron in Agropyron elongatum
grown in coal fly ash and sewage sludge mixture. Water Air Soil Pollut.,
106(1-2): 137-147.
Xu, L. y Z. Rao. 1986.
Determination of B in soils by sequential scanning ICP-AES using side line
indexing method. Fres.
J. Anal. Chem., 325(5): 534-538.
Yermiyahu, U., R. Keren y Y. Chen. 1988. Boron sorption on composted organic matter. Soil Sci. Soc.
Am. J., 52(5): 1309-1313.
Yermiyahu, U.,
R. Keren y Y. Chen. 1995. Boron sorption by soil in the presence of
composted organic matter. Soil Sci. Soc. Am. J., 59(2-3): 405-409.
Yermiyahu, U.,
R. Keren y Y. Chen. 2001. Effect of composted organic matter on boron
uptake by plants. Soil Sci. Soc. Am. J., 65(5): 1436-1441.
Yu, X. y
P. Bell. 2002. Boron and lime effects on yield and deficiency symptoms of rice
grown in greenhouse on acid typic glossaqualf.
Comm. Soil Sci. Plant Anal., 25(12): 2591-2602.
Zaiju, L.; Z. Zhu, T. Jan, C-G. Hsu y P. Jiaomai. 1999. 4-methoxy-azomethine-H as a reagent for the
spectrophotometric determination of boron in plants and soils. Anal. Chim. Acta, 402(1-2): 253-257.
Zarcinas, B. 1995. Suppression of iron interference in the
determination of boron using the azomethine-H
procedure. Comm. Soil Sci. Plant Anal., 26(5-6): 713-729.
Zhao, D. y
D. Oosterhuis. 2002. Cotton carbon exchange,
nonstructural carbohydrates, and boron distribution in tissues during
development of boron deficiency. Field Crops Res. 78(1):
75-87.
Página diseñada por Prof. Jesús Rafael
Méndez Natera
TABLA DE CONTENIDO DE LA REVISTA
CIENTÍFICA UDO AGRÍCOLA



