Control
de la oxidación y la contaminación en el cultivo in vitro de fresa (Fragaria X ananassa Duch.)
Control of oxidation and
contamination of strawberry (Fragaria X
ananassa Duch.) cultivated in vitro.
Maria Claudia Sánchez-Cuevas* y José Luis Salaverría
Laboratorio de Biotecnología, Departamento de
Agronomía, Escuela de Ingeniería
Agronómica, Núcleo de Monagas, Universidad de Oriente, Maturín.
E-mail: mariaclaudia@cantv.net. *
Autor para correspondencia
RESUMEN
La
fresa es cultivada en casi todo el mundo, no solamente
por sus características digestivas y tónicas, sino por el valor nutritivo de
sus frutos, fuente importante de folato, vitamina C, fibra, potasio,
flavonoides, antocianidina, fitoquímicos y antioxidantes. Las experiencias de
la micropropagación en fresas indican que las vitroplantas son más uniformes,
presentan un mayor número de estolones, tienen una mayor sobrevivencia en el
campo y el rendimiento de frutos se incrementa en un 24% que las plantas
propagadas por el método tradicional. Es
indispensable evitar la contaminación con microorganismos para lograr
éxito en el establecimiento, incubación y manipulación del tejido in vitro,
ya que éstos pueden destruir los explantes, retrasar su desarrollo al competir
con ellos o generar modificaciones en el medio que afectan negativamente su
sobrevivencia y desarrollo. La contaminación puede provenir del tejido vegetal
o ser introducida durante la manipulación del tejido. En los primeros intentos
por establecer explantes de fresa in
vitro se observó una alta contaminación por hongos y bacterias, a más del
ennegrecimiento de algunos cultivares.
En el presente trabajo se evaluó el efecto del tiempo de inmersión (10,
20 y 30 min) y tres concentraciones (10, 20 y 30%) de cloro comercial (5,25% de
hipoclorito de sodio) en la desinfección de explantes de fresa cv. Fresno. El
tratamiento 20 min en cloro comercial al 20% mostró la menor contaminación y la
mayor sobrevivencia de los explantes, y mayor formación de brotes. La oxidación
de los explantes del cv. Aiko fue completamente eliminada con la adición de
cisteina (4 g/l) en presencia de luz, permitiendo la sobrevivencia del 100% de
los explantes.
Palabras clave:
Fresa, cultivo de tejidos, contaminación, oxidación, desinfección
ABSTRACT
Strawberry is cultivated all
around the world, not only for its digestive and tonic properties, but because
of the nutritional value of its fruits,
important source of folate, vitamin C, fiber, potassium, flavonoids,
antocianidin, phytochemicals and antioxidants.
Prior experiences with strawberry micropropagation indicate that
vitroplants are more uniform, produce higher number of runners, have better
survival in the field, and the fruit yield increases in 24% than plants
propagated by the traditional method. It
is necessary to avoid the contamination with microorganisms in order to achieve
success in the establishment, incubation and manipulation of the tissue in vitro, since contaminants can destroy
the explants, delay their development by competing with them or generate changes
in the culture medium that negatively affect their survival and growth. Contamination can come from the explant or can be introduced during the
manipulation of plant tissue. In the initial attempts to introduce strawberry
plants to in vitro conditions, a high
contamination by fungi and bacteria was observed, besides tissue blackening in
some cultivars. In the present work, disinfection of the strawberry explants
cv. Fresno was done by means of immersion of the shoots in the plant crown in
commercial chlorine (sodium hypoclorite, 5.25%) for different time intervals
(10, 20 and 30 min) and various chlorine concentrations (10, 20 and 30%). The best treatment was 20% chlorine with a 20
min immersion time, which better reduced the contamination, allowing a greater
survival of the explants and a higher shoot formation. The treatment that
reduced more efficiently tissue oxidation was cystein (4 g/l) with light, which
allowed 100% explant survival.
Key words: Strawberry, tissue
culture, contamination, tissue oxidation, disinfection.
INTRODUCCIÓN
La fresa, una planta pequeña de la familia Rosaceae, se cultiva en Venezuela en pequeñas
plantaciones, con una producción baja a pesar de la gran demanda que siempre ha
tenido, tanto para el consumo fresco como para el uso industrial. Las
condiciones agroecológicas del Municipio Caripe del estado Monagas son aptas
para el desarrollo del cultivo: altitud de 1100 msnm, temperatura promedio
anual de
Las plantas de fresa procedentes de cultivo de tejidos producen mayor
número de estolones que las plantas propagadas por los métodos tradicionales
(Boxus et al., 1984), son más uniformes y sobreviven más en el campo (Swartz y
Lindstrom, 1986). Experiencias llevadas
a cabo en Venezuela señalan que las plantas micropropagadas poseen un excelente
vigor y una óptima producción de estolones y frutos en el campo (FUSAGRI,
1984).
Los explantes para el cultivo de tejidos de fresa pueden provenir de la
corona o de los estolones, aunque es más fácil la extracción y la desinfección
de los explantes de los estolones (Villegas, 1990). La alta pubescencia de los tejidos y su
contacto directo con el suelo inducen una alta contaminación de los explantes,
especialmente cuando éstos son extraídos de plantas provenientes del campo
(Villalobos y Pérez, 1979). Estos contaminantes pueden ocasionar la muerte de
los tejidos, competir con ellos o modificar el medio (Mroginski y Roca, 1991).
Existen diversas técnicas para el control de la contaminación in vitro,
tales como el uso de fungicidas y antibióticos en la planta madre, el explante
y/o el medio de cultivo; sin embargo, no se recomienda la adición de
antibióticos al medio para controlar la contaminación bacteriana porque no son
efectivos en la mayoría de los casos (Pierik, 1987), aunque algunos autores
señalan que su adición es necesaria cuando el tejido tiene infecciones
sistémicas (Phillips et al., 1981). Ocasionalmente ocurre el ennegrecimiento del tejido, con posterior
necrosis del explante. Para evitarlo se
sugiere disminuir la intensidad de la luz, agregar antioxidantes al medio y el
explante, subcultivar con frecuencia, incrementar las sales de calcio, reducir
el nivel de nitrato en el medio y sumergir el explante en medio líquido por un
día (Swartz y Lindstrom, 1986).
El objetivo de este trabajo fue evaluar procedimientos de desinfección
superficial con hipoclorito de sodio y el uso de antioxidantes durante el
establecimiento in vitro de explantes de fresa, para controlar la
contaminación y el ennegrecimiento de los tejidos de los cv. Fresno y Aiko.
MATERIALES Y MÉTODOS
Los explantes
fueron extraídos de plantas procedentes de siembras comerciales ubicadas en
En el ensayo de
antioxidantes, los explantes del cv. Aiko fueron desinfectados con una solución
de cloro comercial (5,25% de hipoclorito
de sodio) al 20% durante 20min. A cada explante se le agregó, previo a la
siembra, los antioxidantes: cisteína (4 g/l), ácido cítrico (150 mg/l) + ácido
ascórbico (150 mg/l) o polivinilpirrolidona (5 y 10%). Los explantes sembrados en el medio de Boxus
(1977) fueron sometidos a oscuridad completa o a 12 hr/luz y 12 hr/oscuridad.
Cada tratamiento estaba compuesto por 16 explantes, en un diseño estadístico
completamente aleatorizado con 4 repeticiones. Las diferencias entre los
porcentajes de sobrevivencia, evaluada 8 días después de la siembra, se
realizaron mediante la prueba de Sokal y
Rohlf.
RESULTADOS Y DISCUSIÓN
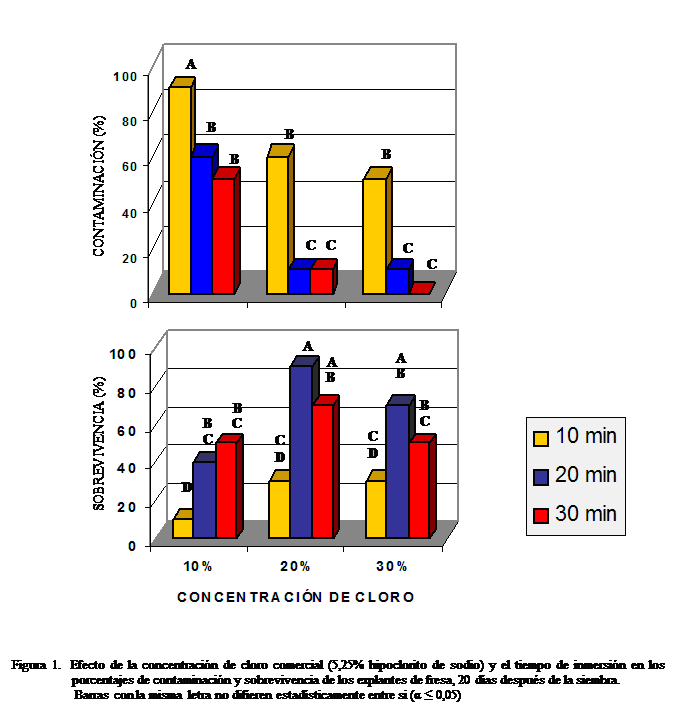
En la evaluación
de contaminación se observó que a medida que se aumentaron la concentración de
cloro comercial y el tiempo de inmersión, la contaminación de los explantes
disminuyó (Figura 1). Los menores porcentajes de contaminación se obtuvieron
con 20 y 30% de cloro comercial y
períodos de inmersión de 20 y 30 min. En el tratamiento con 30% de cloro y 30
min de inmersión, a pesar de no haber habido contaminación, la sobrevivencia
fue de tan solo el 50%, lo que indica
que este tratamiento fue tóxico para los explantes. El mayor porcentaje de sobrevivencia se
obtuvo con el tratamiento compuesto por cloro 20% y 20 min de inmersión.
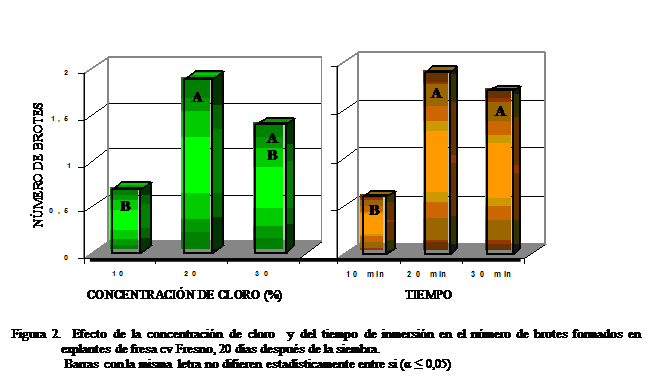
A los 20 días después
de la siembra (DDS), el tratamiento de cloro comercial al 20% registró el mayor
número de brotes por explante, sin diferencias significativas con la máxima
dosis (Figura 2). Estos resultados indicaron que el mejor comportamiento de los
explantes se obtuvo al desinfectarlos con cloro comercial al 20% durante 20min.
Otros investigadores también han utilizado cloro para desinfectar tejidos de
fresa. Dodds y Roberts (1985) recomiendan desinfectar con 10% de cloro (0,5% de
hipoclorito de sodio), mientras que Bhojwani y Razdan (1983) señalaron que una
concentración de
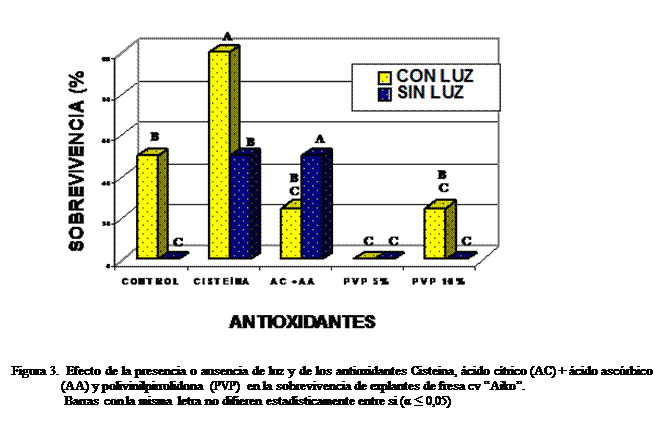
La aplicación de
antioxidantes tuvo un efecto muy marcado en la sobrevivencia de los explantes
de fresa cv Aiko. Los mejores
resultados se obtuvieron
con el tratamiento de cisteína
(4 g/l) en presencia de luz, seguidos por el control con luz, cisteína (4 g/l) sin luz y la mezcla de ácido
ascórbico y ácido cítrico (AC + AA) sin luz, en los cuales se observó un 50% de
sobrevivencia (Figura 3). La cisteína, de acuerdo con George y Sherrington
(1984), no previene la oxidación, sino que
actúa en la rápida remoción de cualquier quinona que se forma. Además, como es un aminoácido, pudo haber
inducido un rápido desarrollo de los explantes al ofrecer nitrógeno orgánico
rápidamente disponible para suplir sus requerimientos. Los explantes tratados
con polivinilpirrolidona (PVP) en dosis de 5% (con y sin luz) y 10% sin luz no
sobrevivieron, así como los que no recibieron antioxidante alguno y
permanecieron en la oscuridad (control sin luz). Estos resultados contrastan con los obtenidos
por Sánchez-Cuevas y otros (2001), quienes lograron obtener los mejores resultados de
sobrevivencia de 80% de explantes de pimentero, libres de oxidación, con la
adición de PVP (0,5 y 1,0 g/l) en presencia de luz.
De acuerdo con Davies y Creasy, citados por
George y Sherington (1984), las enzimas involucradas en la biosíntesis y la
oxidación de fenoles se incrementan con la luz, por lo que es conveniente
mantener los explantes en la oscuridad unos días antes de pasarlos a una
intensidad lumínica baja.
En este
experimento, los resultados indicaron que la sobrevivencia de los explantes
disminuyó en ausencia de luz, con o sin la adición de antioxidantes, excepto en
los explantes que recibieron la adición de AC + AA. Así mismo, a pesar de George y Sherrington
(1984) indican que en ápices de Malus la adición de la poliamida PVP fue
esencial para la sobrevivencia de los explantes, al remover los componentes
fenólicos, en fresa la mortalidad de los explantes fue muy alta cuando se
añadió PVP, probablemente porque las concentraciones empleadas hayan sido muy
altas. Por último, no es frecuente
observar oxidación de tejidos en fresa y
son pocos los cultivares que presentan ennegrecimiento (Villalobos y Pérez,
1979).
CONCLUSIONES
La alta
contaminación por hongos y bacterias de los explantes, generada por la
procedencia de las plantas directamente del campo, el contacto directo de las
yemas con el suelo por su ubicación en la corona (cuello de la planta) y por la
gran pubescencia del tejido de fresa, fue controlada efectivamente con la
inmersión de los explantes en una solución de cloro 20% durante 20 min. Concentraciones más altas o períodos de
inmersión mas prolongados causaron necrosis en el tejido. El tratamiento de los explantes con cloro 20%
y 20 min de inmersión indujeron la mayor
formación de brotes (1,8 brotes).
La oxidación
fenólica de los tejidos de fresa cv Aiko se redujo con la adición de cisteína
(4 g/l) directamente al explante antes de la siembra, manteniendo el tejido en
presencia de luz.
AGRADECIMIENTOS
Se
agradece el financiamiento de esta investigación al Consejo de Investigación de
LITERATURA CITADA
Ávila O, P. 1986. Respuesta de la fresa (Fragaria sp cv. “Aiko”) a
los días cortos y a la aplicación de melaza como medios para mejorar la calidad
de los estolones. Trabajo de Grado de
Ingeniero Agrónomo. Universidad de Oriente. Escuela de Ingeniería Agronómica.
Maturín, Venezuela. 91 p
Bhojwani, S.
S. and M. K. Razdan. 1983. Plant Tissue
Culture. Theory and Practice. Elsevier.
Boxus, P.; C. Damiano, and E. Brasseur. 1984. Strawberry. In:
P. V. Ammirato, D. A. Evans, W. R. Sharp, and Y. Yamada (EDS). Handbook of
Plant Cell, Tissue and Organ Culture. Vol 3. Macmillan.
Boxus, P. ; M. Quoirin, and M. Laine. 1977. Large Scale Propagation of Strawberry Plants
from Tissue Culture. In: J. Reinert,
and P. S. Bajaj (EDS). Applied and Fundamental Aspects of Plant Cell, Tissue
and Organ Culture. Springer-Verlag.
Dodds J. H. and L. W. Roberts. 1985. Experiments in Plant Tissue Culture. 2nd ed.
Cambridge University Press. London. 232 p.
Fundación
Servicio para el Agricultor (FUSAGRI). 1984. Producción
de plantas de fresa por cultivo de tejidos. Noticias
agrícolas. Estación Experimental de Cagua, Cagua, Estado Aragua. Vol X (24):
94-96.
George,
E.F. and P. D. Sherrington. 1984. Plant
Propagation by Tissue Culture: Handbook and Directory of Commercial Laboratories.
Exegetics. Eversley,
Mroginski,
L. A. y W. M. Roca. 1991. Establecimiento de cultivo de tejidos vegetales in
vitro. In: W. M. Roca y L. A., Mroginski. (EDS). Cultivo de tejidos
en la agricultura: Fundamentos y Aplicaciones. CIAT.
Pierik,
R. L. M.
Phillips
R.; S. M. Arnott, and S. E. Kaplan. 1981.
Antibiotics in Plant Tissue Culture: Rifampicin effectively controls bacterial
contaminants without affecting the growth of short-term explant culture of Helianthus
tuberosus. Plant Science Letters 21:
235-240.
Romero, D. 2000a. Una metodología para la
desinfección y el control de la oxidación en explantes foliares de guanábana (Annona muricata L.). Acta Científica
Venezolana 51 (Sup. 2):7.
Romero, D. 2000b. Control de la oxidación y
contaminación en explantes foliares de guanábana (Annona muricata L.). Acta Científica Venezolana 51(Sup. 2):7.
Sánchez-Cuevas, M. C.; R. J. Anés y J. R. Cedeño. 2001. Efecto de varios
antioxidantes en la sobrevivencia
de explantes de pimentero (Piper nigrum L.). Acta
Científica Venezolana 52 (Sup. 3): 58.
Swartz, H. J. and J. T. Lindstrom. 1986. Small fruit and grape
tissue culture from 1980 to 1985: Commercialization of the technique. In:
R. H. Zimmerman, R. J. Griesbach, F. A. Hammerschlag and R. H. Lawson (EDS). Tissue Culture as a plant production system for horticultural
crops. Martinus
Nijhoff Publishers.
Villegas,
M, A. 1990. Micropropagación de fresa (Fragaria x ananassa
Duch.) In: Fundamentos
teórico-prácticos
Villalobos
V. M. y M. G. Pérez. 1979. Alta producción de plantas de fresa libres de virus
a partir del cultivo de meristemos. Proc. Tropical Región ASHS 23:70-72.
Página diseñada por Prof. Jesús Rafael
Méndez Natera
TABLA DE CONTENIDO DE LA REVISTA CIENTÍFICA
UDO AGRÍCOLA



