Revista Científica UDO Agrícola Volumen 4.
Número 1. Año 2004. Páginas: 1-20
Fijación
biológica de nitrógeno
Biological Nitrogen Fixation
Juliana
Mayz-Figueroa
Universidad de Oriente, Núcleo de Monagas,
Laboratorio de Rizobiología, Campus
Juanico, Maturín, Estado Monagas. Email: julianamayz@cantv.net
RESUMEN
Esta revisión es acerca de
los organismos fijadores de nitrógeno, viviendo libres o en asociación con
plantas terrestres. Se discute su hábitat, morfología y los aspectos
fisiológicos; se incluyen, la ubicación de las estructuras involucradas en
Palabras Clave: Fijación Biológica de Nitrógeno, Microorganismos
de vida libre, Asociaciones, Nitrogenasa.
ABSTRACT
This review is about nitrogen-fixing organisms,
free-living or living in association
with terrestrial plants. Their habitat, morphology and physiological aspects
are discussed; location of the involved structures in the Biological Nitrogen
Fixation, mechanisms of nitrogenase protection, metabolic routes of fixed
nitrogen incorporation and nitrogen compounds transported via xylem or phloem
are included. In addition, genus and species of organisms or fixing-systems
located in the states of
Key Words: Biological Nitrogen Fixation, Free-living microorganisms, Associations,
Nitrogenase.
INTRODUCCIÓN
El Nitrógeno (N) es un elemento necesario
en la composición de proteínas, ácidos nucleicos y otros componentes celulares,
siendo así una molécula esencial para el
crecimiento de todos los organismos. En
la atmósfera el N ocupa aproximadamente el 80%, existiendo en la forma NºN; sin embargo, el N2, debido al triple enlace
entre los dos átomos de nitrógeno, que hace a la molécula casi inerte, no puede
ser aprovechado por la mayoría de las formas vivientes, sino sólo por un
pequeño grupo de microorganismos altamente especializados, que incluyen algas,
bacterias y actinomicetes. Para ser
utilizado en el crecimiento, este debe ser primero reducido y luego “fijado”
(combinado) en la forma de iones amonio (NH4+) o nitrato
(NO3-). El proceso
a través del cual esos microorganismos reducen el nitrógeno hasta una forma
utilizable es conocido como Fijación Biológica de Nitrógeno (FBN por sus siglas
en español). El proceso puede ser
llevado a cabo por los microorganismos en vida libre o en simbiosis con
plantas, y el mismo no sólo permite usar el nitrógeno atmosférico sino también
revertir o reducir la degradación del suelo (Allan y Graham, 2002; Parsons,
2004).
Organismos involucrados en la FBN
Entre los microorganismos involucrados en
Microorganismos de Vida Libre
Bacterias
Las bacterias fijadoras de nitrógeno son componentes
importantes del suelo y requieren una fuente de energía química si no son
fotosintéticas, las cuales a su vez utilizan la energía de la luz solar.
Entre las bacterias de vida libre pueden
encontrarse: anaeróbicas obligadas o facultativas (e.j. Clostridium
pasteurianum, Klebsiella spp., Desulfovibrio sp.), aeróbicas
obligadas (e.j. Azotobacter spp., Beijerinckia sp.) y fotosintéticas (bacterias
púrpuras sulfurosas y no sulfurosas, y bacterias verdes sulfurosas) (Allan y
Graham, 2002).
Las bacterias aeróbicas dependen fuertemente de las
condiciones de humedad, oxígeno y materia orgánica, y las anaeróbicas son
predominantes en suelos anegados donde existen las condiciones de humedad y
materia orgánica, pero el suministro de oxígeno está restringido.
Las bacterias aeróbicas
emplean dos mecanismos de protección de la nitrogenasa: la protección
respiratoria, donde se produce una elevada tasa respiratoria a expensas de un
alto consumo de carbono y energía, manteniendo así una concentración
intracelular de oxígeno baja; y la
protección conformacional, en la cual la
nitrogenasa cambia su disposición a una forma reversible inactiva (Robson y
Postgate, 1980; Segura y Espín, 1998).
Cianobacterias
Las Cianobacterias tienen una amplia
distribución y ocupan un gran rango de habitas al igual que las bacterias,
que incluyen suelo y agua, tanto de regiones tropicales
y templadas como de climas extremos
(Herrero et al. 2001),
Presentan una gran diversidad morfológica, desde unicelulares hasta
multicelulares filamentosas y con o sin la presencia de heterocistos. Stanier
y Cohen-Bazire (1977), las describen como fotoautotróficas, fijadoras de CO2
a través del Ciclo de Calvin y carentes de 2-oxoglutarato deshidrogenasa. En las cianobacterias, el amonio es
incorporado en esqueletos carbonados (2-oxoglutarato) a través del ciclo de la
glutamina sintetasa-glutamato sintasa para la biosíntesis de glutamato y
compuestos nitrogenados derivados (Herrero et al., 2001).
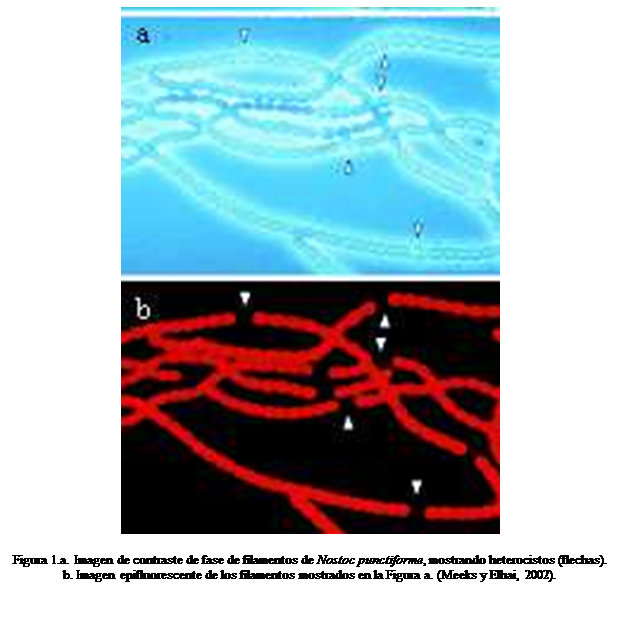
Los heterocistos (Figura 1) son células especializadas,
distribuidas a lo largo o al final del filamento (cianobacterias multicelulares
filamentosas), los cuales tienen conexiones intercelulares con las células
vegetativas adyacentes, de tal manera que existe un continuo movimiento de los
productos de la fijación de nitrógeno desde los heterocistos hacia las células
vegetativas y de los productos fotosintéticos desde las células vegetativas
hacia los heterocistos (Todar, 2004).
Debido a la sensibilidad de la enzima nitrogenasa al
oxígeno, las cianobacterias tienen como mecanismos de protección, la separación
en espacio o en tiempo de los mecanismos fotosintéticos y de fijación de
nitrógeno. Algunas algas filamentosas como Nostoc y Anabaena,
tienen la nitrogenasa confinada a los heterocistos, los cuales carecen del
fotosistema II liberador de oxígeno y rodeados de una pared glicolipídica
gruesa que reduce la difusión de éste hacia las células, cualquier oxígeno que
difunde hacia los heterocistos es
rápidamente reducido por hidrógeno;
así, la fijación de nitrógeno
está espacialmente y
metabólicamente
b
separada del proceso fotosintético; las algas
unicelulares (e.j.
Gloeocapsa) y las filamentosas sin
heterocistos (e.j. Trichodesmium), presentan los dos procesos separados en tiempo; de tal
manera que la nitrogenasa sólo ocurre en el período de oscuridad. Sin embargo, algunas cianobacterias como
mantienen la fijación de nitrógeno durante el período de luz, a expensas de una
elevada tasa respiratoria, mecanismo similar al presentado por las bacterias
aeróbicas (Capone et al., 1997; Herrero et al., 2001; Omoregie et al.,
2004; Todar, 2004).
Actinomicetes
Los actinomicetes son bacterias filamentosas Gram
positivas, comunes en el suelo, especialmente en suelos de elevado pH y poca
humedad. Se les considera como
organismos intermedios entre los hongos y las bacterias, formadores de micelios
(Lechevalier y Lechevalier, 1979; Huss, 1990).
Frankia es un
género del grupo de los actinomicetes,
cuya especie F. alni,
se ha reportado como fijadora de nitrógeno tanto en vida libre como en
asociación con algunas angiospermas (no leguminosas). Las especies de Frankia
son de crecimiento lento en cultivo y requieren de medios especializados
para su crecimiento, presentan hifas ramificadas y septadas con vesículas y
esporangios. Los esporangios
multiloculares e irregulares en forma se localizan terminal, lateralo intercalarmente
en las hifas, cuyas esporas no resistentes al calor sirven probablemente como
agentes de propagación. La actividad de
la nitrogenasa ha sido asociada con las vesículas, las cuales pueden formarse
lateral o terminalmente en las hifas y bajo condiciones de deficiencia de
nitrógeno. Cada vesícula está rodeada
por una multicapa lipídica que probablemente funciona como una barrera para la
difusión de oxígeno. Estudios estructurales en cultivo han mostrado que el
grosor de la capa lipídica aumenta en respuesta a un incremento de la
concentración de oxígeno, a fin de evitar la inactivación de la nitrogenasa
(Silvester et al., 1990; Nalin et al., 2000; Todar, 2004).
Asociaciones
Asociaciones no simbióticas
Bacterias-Filósfera
Varias bacterias fijadoras de nitrógeno pueden colonizar
la filósfera, término usado por algunos investigadores para referirse a la
superficie adaxial y abaxial de la hoja, y por otros a la hoja completa,
incluyendo el ambiente interno. Se ha observado que las bacterias más abundantes
en las hojas son las pigmentadas (e. j. Methylobacterium
mesophilicum, Pseudomonas syringae), a las cuales se les ha atribuido una
mejor adaptación a los rayos solares (Sundin y Jacobs, 1999; Hirano y Upper,
2000). Las especies de Beijerinckia
y Azotobacter son comúnmente encontradas en cultivos; y
se ha reportado su efecto benéfico en el crecimiento de las plantas
(Ching-Hong, 2001; Lindow y Brandl, 2003). Sin embargo, no está clara la
forma en que las plantas se benefician y posiblemente se ha atribuido el beneficio a la absorción
radical de compuestos nitrogenados, los cuales una vez excretados por las
bacterias en las hojas, llegan a la raíz por lavado.
Bacterias-Rizósfera
Hiltner en 1904 observó por primera vez la acumulación de
microorganismos en la zona radical y propuso el término “rizósfera”.
Los exudados radicales,
conformados por substancias diversas crean alrededor de las raíces (rizósfera)
un ambiente nutricional enriquecido que favorece el crecimiento
bacteriano. Smith (1976) y Martin y Kemp (1980) reportan la presencia de
carbohidratos y aminoácidos, y señalan que la composición y cantidad de
exudados varía con la especie presente y las condiciones abióticas, tales como
agua y temperatura.
La relación que se
establece entre las bacterias y las plantas puede ser favorable, perjudicial o
neutra. Dentro de las relaciones
favorables se encuentra la asociación con bacterias fijadoras de nitrógeno;
entre estas, especies de Azospirillum1, Enterobacter, Klebsiella,
Pseudomonas y Burkholderia (Estrada et al.,
2001). Las bacterias fijadoras de
nitrógeno pueden ser categorizadas dentro del grupo de las rizobacterias
promotoras del crecimiento (PGPR, por sus siglas en inglés), al ejercen un
efecto benéfico sobre el crecimiento de las plantas. La primera especie aislada fue Azospirillum
lipoferum (para entonces nombrada como Spirillum lipoferum) en
Holanda en 1925 (BeijerincK, 1925) y de la cual en la actualidad se reconocen 7
especies: A. brasilense, A. lipoferum, A. amazonense, A.
halopraeferans, A. irakense, A. largimobile y A.
doebereinerae (Tarrand et al.,1978;
Magelhaes et al., 1983; Reinhold et al., 1987; Khammas et al.,
1989; Sly y Stackebrandt,
1999; Eckert et al., 2001); desde entonces ha sido aislada de varias especies cultivadas y
silvestres y de varios tipos de suelo.
Por muchos años se
consideró que el efecto benéfico de las bacterias fijadoras de nitrógeno sólo
provenía de la utilización por las plantas del amonio excretado; así existen
numerosas publicaciones que prueban tal efecto (Mirza et al., 2001; Becker et al., 2002); sin
embargo, se ha encontrado que esta bacterias también producen fitohormonas (auxinas,
giberelinas y citocininas) que afectan favorablemente el desarrollo de las
plantas, particularmente de la raíz (Persello-Cartieaux
et al., 2003). Más recientemente se ha
reportado que las bacterias fijadoras de nitrógeno incrementan la capacidad
radical de absorción de nitrato, indirectamente como una consecuencia de la estimulación del desarrollo radical y
directamente por estimulación del sistema transportador del compuesto (Mantelin
y Touraine, 2004).
Asociaciones simbióticas
Rhizobia-Leguminosas
Rhizobium Frank 1889, el
género tipo de
El
enigma de las leguminosas fue aclarado cuando Hellriegel y Wilfarth en 1888
probaron la fijación de nitrógeno en plantas noduladas, esto fue seguido por el
aislamiento de la primera bacteria de los nódulos por Beijerinck ese mismo
año. En 1932, Fred y colaboradores
publicaron una monografía que ha recorrido el mundo, donde revisaron y
analizaron la información existente sobre la simbiosis; sus consideraciones
tuvieron una profunda influencia en la práctica y teoría subsiguientes. Para las décadas posteriores y hasta la
actualidad los avances tecnológicos han permitido estudios más detallados y por
lo tanto un mejor conocimiento y entendimiento de la simbiosis leguminosas-rizobia.
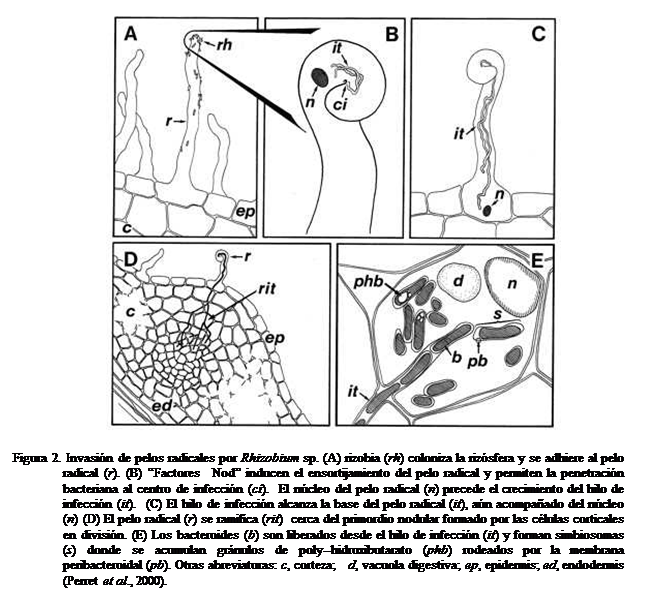
Para
que se establezca la relación simbiótica deben ocurrir las siguientes etapas:
1. multiplicación de las bacterias en la rizósfera, 2. colonización de la
rizósfera, 3. adsorción de las bacterias a la raíz, 4. ensortijamiento de los
pelos radicales, ocurre en las raíces cuando la infección es vía pelos
radicales y en algunas donde acontece vía unión raíces laterales-raíz
principal, 5. formación de los hilos o zonas intercelulares de infección, 6.
crecimiento del hilo de infección hacia las células corticales o invasión directa
de las mismas, y 7. diferenciación tisular y desarrollo del nódulo (Figura
2). Los cambios morfológicos y
fisiológicos que ocurren a nivel de los puntos de desarrollo nodular van
acompañados de señales moleculares inducidas por genes propios del proceso
(genes Nod) (Mayz, 1997; Perret et al.,
2000; González y Marketon, 2003; Gage,
2004).
El tipo y estructura nodular
es dependiente de la planta hospedera, así se tienen:
a. nódulos determinados, en
los cuales la actividad meristemática cesa temprano en su formación y su
aspecto final resulta del alargamiento de las células, este tipo de desarrollo
origina nódulos esféricos o globosos (Figura 3A), que pueden organizarse
alrededor de la raíz para formar los denominados nódulos en collar (Figura 3B)
(Hirsch, 1992; Mayz, 1997).
b. nódulos indeterminados, los cuales
presentan un meristema persistente, que puede producir nódulos ramificados o
coraloides, puesto que constantemente se añaden nuevas células a la parte
distal del nódulo; de tal manera que todos los estados de desarrollo están así
representados, debido a que ocurre un gradiente de formación desde la parte
distal, a la proximal en el punto de unión a la raíz. Este tipo de desarrollo da lugar a nódulos
elongados o cilíndricos (Figura

El
primer producto de la reacción de fijación es NH3 (amoníaco), pero
este es rápidamente protonado, formándose NH4+, lo cual es
favorecido por el pK (9,25) de la reacción, de tal manera que amonio es la
especie predominante a los pHs fisiológicos y la que toma parte en las
reacciones de asimilación (Sprent y Sprent, 1990).
El amonio
es un inhibidor de la síntesis de nitrogenasa, por lo que es imperativa su
rápida asimilación; en el citosol de las células infectadas, éste es asimilado
en ácido glutámico, en cuya reacción interviene la enzima octamérica ATP
dependiente glutamina sintetasa o GS, y donde se forma glutamina, la cual puede
ser exportada o usada para restaurar el ácido glutámico, a través de una
reacción con el ácido 2-oxoglutárico (proveniente del ciclo de los ácidos
tricarboxílicos) catalizada por la enzima monomérica NADH dependiente glutamato
sintasa, también denominada glutamina-2-oxoglutarato aminotransferasa o GOGAT
(Sprent y Sprent, 1990; Ortega et al.,
2004).
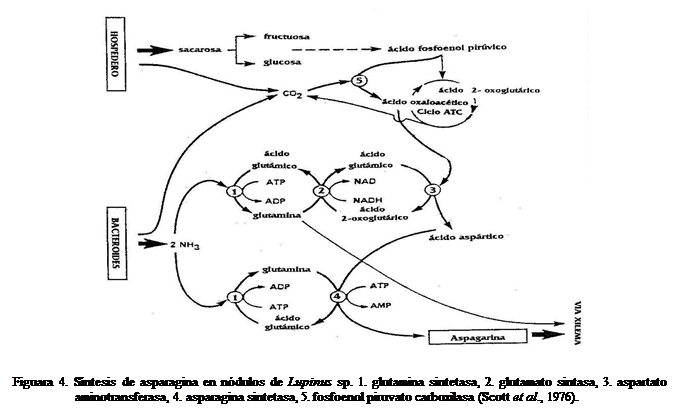
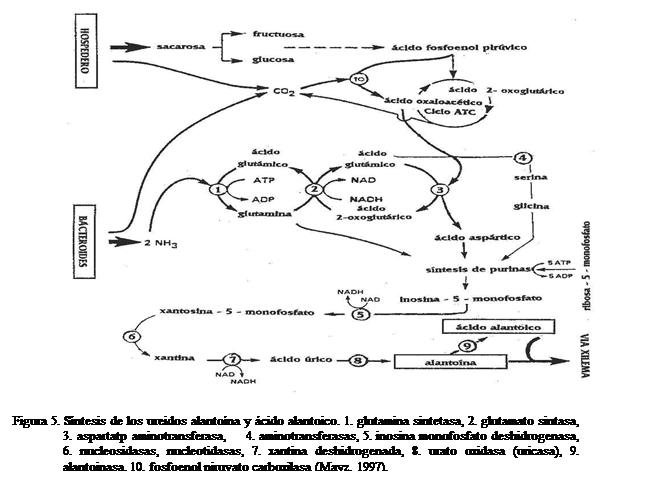
Las
leguminosas simbióticas pueden ser separadas en dos grupos de acuerdo a los
productos exportados desde los nódulos: las exportadoras de amidas (asparagina,
glutamina) (Figura 4) y las exportadoras de ureidos (alantoína y ácido alantoico) (Figura
5). El primer grupo incluye varias
especies de regiones templadas, entre estas Lupinus
subcarnosus, Pisum sativum y Medicago
sativa y el segundo varias especies tropicales, tales como Glycine max, Phaseolus vulgaris y Vigna
unguiculata (Scott et al., 1976; Miflin y Habash, 2002; Harrison et al., 2003).
Cianobacterias-Hongos (Líquenes), Briofitas, Helechos,
Angiospermas, Gimnospermas
Las cianobacterias se asocian
simbióticamente con representantes de las cuatro principales divisiones
filogenéticas de las plantas terrestres: briofitas (musgos, hepáticas y antocerotas), helechos,
gimnospermas y angiospermas; además, se asocian con hongos para formar los
líquenes y con organismos marinos (Meeks
y Elhai, 2002). Esta
revisión se centra en las asociaciones de cianobacterias con plantas
terrestres.
Líquenes
Los líquenes son asociaciones
simbióticas entre un hongo (micobionte) y una cianobacteria (fotobionte o
cianobionte). La cianobacteria más
frecuente en los líquenes es Nostoc (Meeks y Elhai, 2002; Oksanen et
al., 2004). Los líquenes viven en
varias superficies: suelos, árboles, rocas y paredes, a menudo son los primeros
en establecerse en el ambiente, constituyendo la única vegetación en ambientes
extremos. Su aspecto es variable: de hojas (folioso, Figura 6), de costra
(crustoso, Figura 7) o de arbusto (fruticoso, Figura 8) (Purvis, 2000).
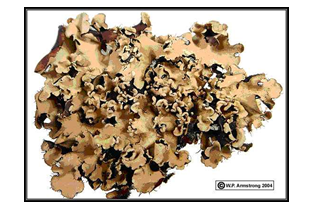
Figura 6. Parmotremma
stuppeum (Amstrong, 2004)2

Figura 7. Caloplaca saxicola (Silverside, 2002)3

Figura 8. Teloschistes chrysophthalmus
(Armstrong, 2001)4
La anatomía de los líquenes
varía desde muy simple hasta compleja (Per, 2001; Brodo et al., 2001):
a. El talo homómero presenta
una estructura uniforme donde están distribuidas las células del alga,
penetradas por las hifas del hongo (Figura 9).
b. El talo heterómero con una sola especie de
alga (liquen bipartito), exhibe capas delimitadas e identificables: la corteza
superior, la capa fotobióntica que contiene las células del alga, la médula,
donde se alojan las hifas del hongo y la corteza inferior (Figura 10).
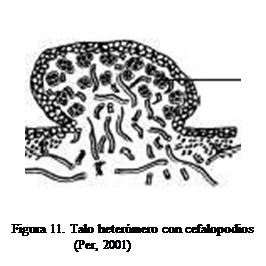
c. En el talo heterómero donde se presentan
dos especies de algas (liquen tripartito), la cianobacteria está confinada a
estructuras especiales o cefalopodios que pueden sobresalir en la superficie
superior o inferior del liquen, o permanecer internamente, y el alga verde está
localizada en la corteza superior (Figura 11).
En la asociación, la cianobacteria debe ser capaz de llenar los
requerimientos bioquímicos y de desarrollo del hongo. La función del fotobionte
en el talo es de proporcionar compuestos nitrogenados y carbohidratos (polioles
y glucosa), donde alrededor del 80% o más de los productos fotosintéticos son
liberados e inmediatamente absorbidos por el micobionte, mientras que el hongo
le suministra protección, agua y minerales (Hill, 2001; Schofield et al., 2003).


Cianobacterias-Briofitas (musgos,
hepáticas y antocerotas)
Los musgos (e.j., Sphagnum spp.)5, hepáticas
(e.j: Marchantia spp.)6 y
antocerotas (e.j Anthoceros spp.,
Notothylas spp. y Phaeoceros spp.) forman asociaciones simbióticas
con especies de cianobacterias, siendo las especies de Nostoc las más frecuentemente encontradas (e.j. N. ellipsosporum y N. punctiforme) (Adams, 2000;
Wong y Meeks, 2002).
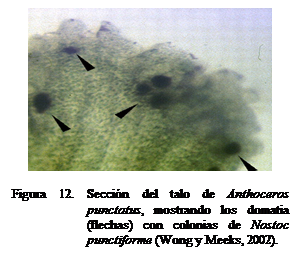
Las colonias de la cianobacteria se alojan en
cavidades especiales (domatias) localizadas en la parte ventral del gametofito
(Figura 12), donde ocurre el intercambio de compuestos nitrogenados y
carbohidratos (Vance et al., 1998; Costa et al., 2001). Los heterocistos proporcionan los productos
nitrogenados a las células vegetativas de la planta, y en turno reciben los
productos fotosintéticos. Se asume que
existen mecanismos reguladores (probablemente genes) que controlan la
diferenciación y el patrón de distribución de los heterocistos en las
cianobacterias simbióticas, a fin de optimizar la fijación de nitrógeno y por
ende la simbiosis (Yoon y Golden, 2001).
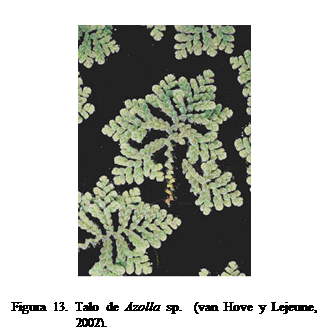
Cianobacterias-helechos (Azolla)
Azolla (Figura 13) es un helecho
acuático que forma una simbiosis permanente y hereditaria con la cianobacteria Anabaena
azollae, cuya relación mutualística es la única conocida en la naturaleza entre
una pteridofita y una procariotica diazotrófica Esta asociación fue descrita
por primera vez por el científico alemán Eduard Strasburger en 1873. En Venezuela se han identificado algunas
especies: e.j. A. filiculoides7 y A.
carolliniana8.
Azolla es usado como fertilizante verde
y como alimento para animales en China y Vietnam, y algunas regiones de África
desde hace mucho tiempo y más recientemente como un biofiltro de aguas servidas
(Carrapiço, 2002; van Hove y Lejeune, 2002).
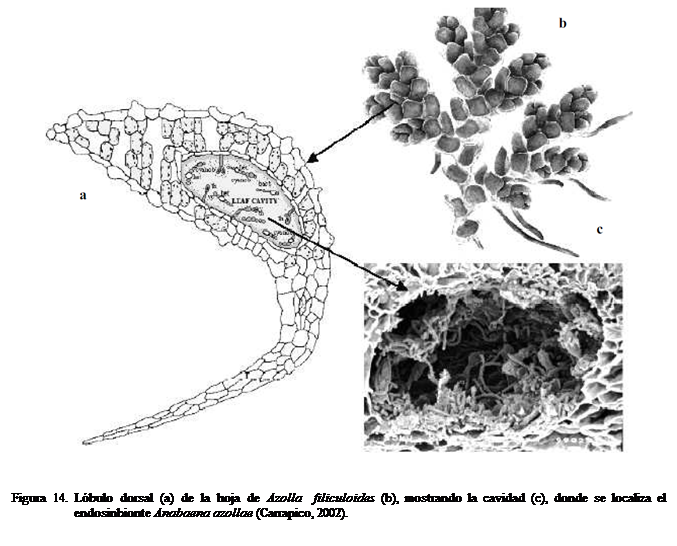
El endosimbionte se aloja en la cavidad del lóbulo dorsal clorofílico de la
hoja bilobada (Fig. 14), donde además se localizan tricomas que intervienen en
el transporte de substancias. En esta
asociación ocurre un intercambio de compuestos desde la cianobacteria hacia el
hospedero (compuestos nitrogenados) y en vía contraria (productos
fotosintéticos).
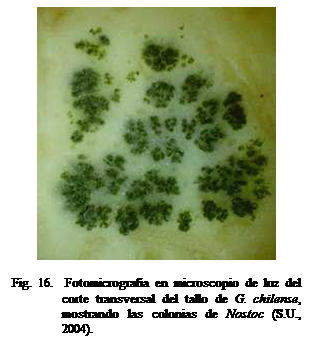
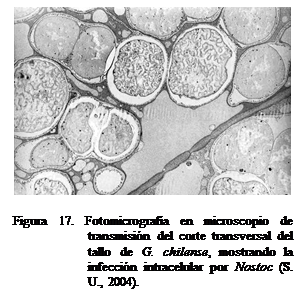
Todas las especies de Gunnera
(Figura 15) forman asociaciones simbióticas con Nostoc (particularmente con N. punctiforme)
(Figura 16), siendo la única angiosperma conocida por formar este tipo de
asociación. Las cianobacterias se localizan intracelularmente (Figura 17) en
las glándulas ubicadas en la base del pecíolo (Figura 18) donde ocurre el
intercambio de compuestos: nitrogenados desde el alga y fotosintéticos desde la planta (Benson y
Margulis, 2002). Las glándulas se abren al exterior a través de varios canales
y las células que las conforman se separan ligeramente en la base de los
canales, formando una cavidad (Bergman et al., 1992). Las especies de Gunnera (alrededor de 40) se distribuyen
principalmente en el Hemisferio Sur, y se consideran originarias de
Suramérica (Wanntorp y Wanntorp,
2003). G. pittierana es autóctona en
el Parque Nacional Henry Pittier (Venezuela).
El
grupo de las cícadas (e.j. Cycas, Zamia, Bowenia) forma asociaciones simbióticas con
cianobacterias (siendo las más comunes Nostoc spp, Spirulina
sp. Oscillatoria sp., Anabaena spp., Rivularia sp.
y Calothrix sp.) proporcionando un ambiente estable al alga a cambio del
nitrógeno fijado; en esta alianza las cianobacterias son endosimbiontes de
algunas raíces (raíces coraloides o parecidas a corales), las cuales se
caracterizan por tener un crecimiento apogeotrópico o hacia la superficie del
suelo (Figura 19) (Medeiros y Stevenson,
2004; Thoumire,
2004).
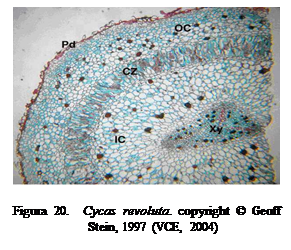
Cycas revoluta es común en parques y jardines del país (Figura
20).
El
proceso de colonización de las raíces precoraloides envuelve mecanismos de
acción y reacción de ambos organismos. El alga penetra a través de la epidermis
hacia la zona cianobacterial (Figura 21), produciéndose cambios permanentes que
conducen a la transformación de las raíces precoraloides en raíces coraloides
simbióticas (Figura 19) (Lindblad y Costa, 2002).


Después de la reducción del nitrógeno
hasta amonio, éste es incorporado en glutamina por glutamina sintetasa, luego
el grupo amida es transferido a la posición alfa del a-cetoglutarato, produciéndose glutamato, reacción
catalizada por la glutamato sintasa; sin embargo, el análisis de la savia
xilemática ha revelado que los compuestos nitrogenados transportados varían en
algunas especies; así en Macrozamia, Lepidozamia y Encephalartos
se ha encontrado glutamina y citrulina, mientras que en Bowenia y Cycas, glutamina y ácido glutámico (Lindblad
y Costa, 2002).
Fisiología del Intercambio de compuestos
en las asociaciones con cianobacterias
Durante la simbiosis de las cianobacterias con otros
organismos, ocurren cambios estructurales y fisiológicos que conducen al intercambio
apropiado de compuestos entre el cianobionte y el hospedero (Figura 22).
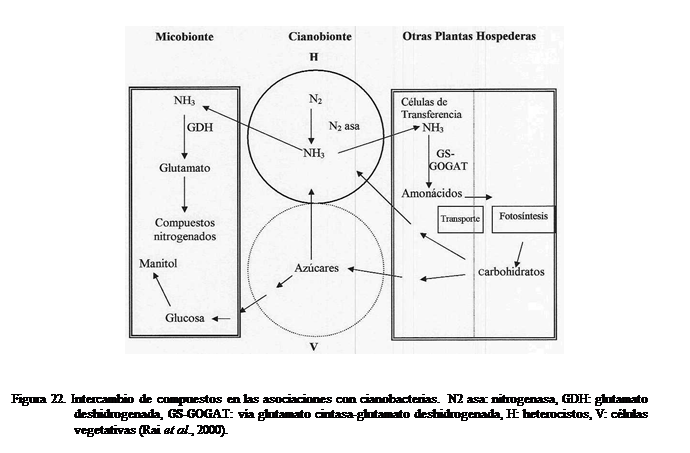
En el caso de localizaciones extracelulares del alga como
en los líquenes, el contacto íntimo de las hifas con los heterocistos permite el
tráfico de substancias, desconociéndose el mecanismo exacto de
intercambio. Se ha encontrado que en los
cianolíquenes bipartitos (hongo-alga) ocurre el
movimiento de productos fotosintéticos desde el cianobionte al micobionte,
siendo principalmente glucosa, la cual es convertida a manitol (no producido,
ni consumido por el alga) en el hongo, posiblemente una estrategia para el
secuestro de carbohidratos. Como causa
de esta liberación de glucosa se ha considerado la reducción de la síntesis de
polisacáridos para la formación de las paredes celulares. El alga permanece
independiente en cuanto a sus requerimientos y producción de carbohidratos. En
los líquenes con cefalopodios o tripartitos no se ha encontrado o existe poco
movimiento de carbohidratos desde el cianobionte al micobionte, considerándose
que la fuente de carbohidratos es el ficobionte (alga verde) asociado ya que la
cianobacteria no fotosintetiza. La glucosa liberada origina un pool de
glucano, el cual sirve como reservorio, siendo la fuente a utilizar por el
cianobionte. En el caso de localizaciones intracelulares como en briofitas
(musgos, hepáticas y antocerotas), helechos (Azolla), angiospermas (Gunnera)
y gimnospermas (cícadas), se señala la posibilidad de que el cianobionte pierda su capacidad
fotosintética y que el C provenga de las partes fotosintéticas del hospedero
hacia el tejido simbiótico como sacarosa o procedente de la degradación de los
polisacáridos que están normalmente presentes en el mucílago de las cavidades o
nódulos donde habita la cianobacteria. La fijación y transferencia de nitrógeno
desde el cianobionte al hospedero ocurre en todas las simbiosis, siendo los
heterocistos, los sitios de fijación y de las primeras reacciones de
asimilación. El N puede existir en las células en las formas NH4+ o NH3
que puede difundir a través de las membranas o ser reciclado por las células a
través de un sistema transportador de amonio, devolviéndolo desde el espacio
periplásmico conjuntamente con un protón.
En los líquenes el amonio liberado, es asimilado vía glutamato
deshidrogenasa, pero en las otras asociaciones se presenta la vía glutamato
sintasa-glutamato sintetasa. El
transporte de nitrógeno desde los tejidos simbióticos hacia las otras partes del hospedero se hace
en forma de aminoácidos. En los líquenes
tripartitos, se ha demostrado el transporte de alanina desde el cefalopodio
hacia el resto del talo; en Azolla, se transportan desde las cavidades
en las hojas hacia el ápice del tallo los compuestos glutamato, glutamina, amonio
y un derivado de glutamato; en Gunnera, asparagina es el compuesto
principal exportado a través del floema desde las glándulas al resto de la
planta y en las cícadas una mezcla de aminoácidos es liberada en el xilema
desde las raíces coraloides, principalmente citrulina en Zamiaceae y glutamina
en las otras familias (Rai et al., 2000).
Frankia-Angiospermas
La ocurrencia de Frankia en el interior de los nódulos de
algunas plantas fue reportada por Woronin en 1866, quien describió las hifas y vesículas
como pertenecientes a un hongo parásito, más tarde correctamente identificadas
como pertenecientes al actinomicete Frankia.
(Becking, 1974, Lechevalier y Lechevalier 1979), pero no fue sino hasta 1978 cuando pudo ser aislado. Este actinomicete forma nódulos
(actinorizas) o raíces laterales
modificadas con lóbulos hasta de

En el proceso simbiótico y de formación de los nódulos se presentan
variaciones determinadas por el hospedero, que incluyen la vía de infección (en
algunas especies la infección es vía pelos radicales, e.j. Casuarina, Morella (Myrica), y en otras procede
intercelularmente, e.j. Discaria, Dryas, Ceanothus,
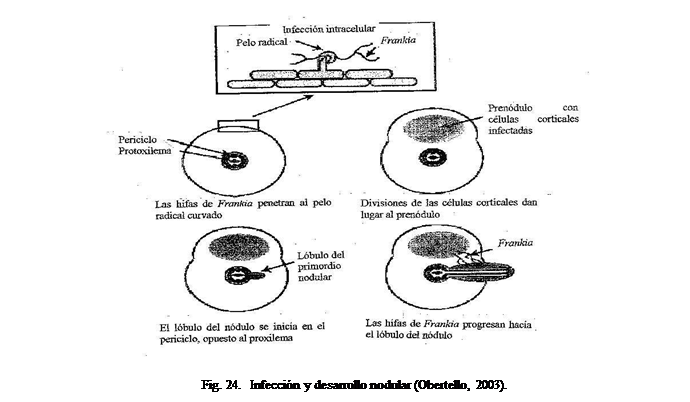
la morfología y anatomía de los nódulos y en la diferenciación de Frankia en el desarrollo nodular (Benson y Silvester, 1993; Huss, 1990, 1999). La formación del primordio nodular (Figura 24) se inicia
en el periciclo, donde se originan raíces laterales modificadas de forma
lobular con células infectadas en la corteza. Frankia penetra los pelos radicales curvados o
intercelularmente hacia la corteza,
donde ocurren divisiones celulares limitadas que dan lugar a la formación del
prenódulo; al mismo tiempo, en las células del periciclo opuestas al
protoxilema se suceden divisiones mitóticas que conducen a la formación de las raíces laterales modificadas o
nódulos; al prenódulo se le considera como un órgano simbiótico
paralelo, desde donde progresan
las hifas hacia el primordio del nódulo (Laplaze et al., 2000; Obertello, 2003). Los lóbulos presentan un meristema
apical y Frankia existe como un
micelio vegetativo con presencia de vesículas donde es protegida y funciona la
nitrogenasa; tal resguardo es dado por la elevada concentración de ácidos
grasos; sin embargo, en Casuarina
y Allocasuarina, no se forman
vesículas, dado el cambio de composición de las paredes celulares, las cuales
se hacen más hidrofóbicas y menos permeables
al oxígeno después de la infección (Verghese y Misra, 2002).
Durante
la simbiosis, el microsimbionte obtiene la energía de la planta hospedera a
través de compuestos carbonados; se considera que Frankia por carecer de enzimas glicolíticas, obtiene el carbono de lípidos
(Verghese y Misra, 2002); sin embargo, algunos investigadores han reportado el
transporte de sacarosa vía floema hacia los nódulos (Parsons y Sunley, 2001). Como en los otros sistemas simbióticos el
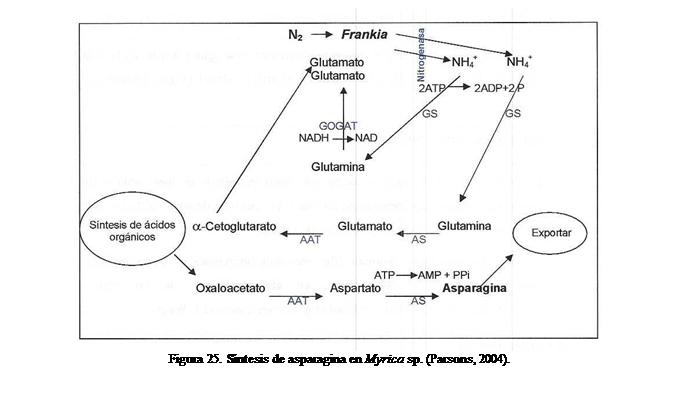
compuesto de nitrógeno metabolizado es NH4+
a través de la vía GS/GOGAT, ATP/NADPH
dependientes, que produce glutamina y luego glutamato en los nódulos; los
aminoácidos aspartato y asparagina son subsecuentemente metabolizados por
enzimas amido y amino transferasas (AAT) y sintetasas (AS) (Figura 25). El
compuesto nitrogenado transportado vía xilema desde los nódulos varía entre los
hospederos; así, se ha encontrado citrulina
en Alnus sp. (Wheeler y Bond, 1970) y Casuarina
equisetifolia (Walsh et al., 1984), arginina en Casuarina
cunninghamiana (Sellstedt y Atkins, 1991),
y glutamina y asparagina en Myrica (Fig. 25), Hippophae,
Ceanothus y Elaeagnus (Huss, 1990; Parsons, 2004).
1Identificado
en suelos de
2Parmotrema stuppeum (Taylor) Hale, colectada en el estado Mérida por López 353
(VEN).
3Caloplaca saxicola (Hoffm.) Nordin, colectada en el estado Mérida por López 464 (VEN) y Marcano et al. 197 (VEN).
4Teloschistes chrysophthalmus (L.) Norm. Colectado en el estado Mérida por Vareschi 233 (VEN) y López 441(VEN).
5Sphagnum meridense (Hampe) Müll. Hal. Bolívar: Steyermark y Wurdack 383
(MO); Trujillo: Griffin et al.
1129 (MO); Sphagnum sparsum Hampe Bolívar:
Steyermark et al. 109321 (MO),
Mérida: Griffin y López PV-922
(MO); Sphagnum tenerum Sull. & Lesq. ex Sull. Bolívar: Liesner 19159 (MO); Sphagnum recurvum
P. Beauv. Bolívar: Steyermark et al. 128356 (MO); Sphagnum sancto-josephense H.A. Crum
& Crosby Trujillo: Dorr et al. 5055
(MO, NY); Sphagnum magellanicum Brid.
Amazonas: Steyermark 129570 (MO); Sphagnum ornatum
H.A. Crum Amazonas: Buck 10628 (MO, NY), Bolívar: Boom
9333 (MO, NY); Sphagnum perichaetiale Hampe
Amazonas: Steyermark 107519 (MO), Bolívar: Liesner 19951 (MO).
6Marchantia
polymorfa L. Colectada en el estado Mérida: Pittier
12894(MO), Marchantia chenopoda
L.. colectada en el Distrito
Federal: Agostini et al. 81 (MO).
7Merida: Barclay 9628 (MO).
8Amazonas: Liesner y Carnevali 22784 (MO), Portuguesa: Liesner y González 12698; Zulia: Liesner y González 13188 (VEN).
9Alnus acuminata subs.acuminata Kunth ha sido colectada en el estado Mérida: Hahn y Grifo 3509(MO); Alnus
acuminata var. ferruginea (Kunth) Regel colectada en
10Morella pubescens (Humb. & Bonpl. ex Willd.)
Wilbur,
11Rhamnus acuminata Maguire & Steyerm 1989.
Colectada en el estado Amazonas: Maguire et al.
42496 (MO); Rhamnus sipapoenis Steyerm. Maguire y Politi
28656(MO).
12Prunus moritziana Koehne colectada en los estados
Mérida: Hahn y Grifo 3341 (MO) y Yaracuy:
Smith V10001.
CONCLUSIONES
Los
microorganismos fijadores de nitrógeno de vida libre, abarcan una gama morfológica
que va desde los organismos unicelulares como las bacterias y algunas
cianobacterias, hasta multicelulares como las cianobacterias filamentosas y los
actinomicetes, que habitan diferentes ambientes, incluyendo los extremos, todos
procarióticos; comprendiendo así microorganismos pertenecientes a los Dominios
Archaea y Bacteria, los cuales pueden formar asociaciones con organismos
pertenecientes al Dominio Eucaria. Estas
asociaciones pueden ser de tipo no simbiótico, ocurriendo principalmente en la
filósfera o la rizósfera de algunas plantas, o de tipo simbiótico, dándose en
briofitas (musgos, hepáticas y antocerotas), helechos (Azolla), gimnospermas (cícadas) y angiospermas (Gunnera, leguminosas y Parasponia) y en zonas de la planta que
incluyen la raíz, el tallo y las hojas.
Una
característica común de los microorganismos involucrados en
Bien
sea de vida libre o asociados los organismos se
benefician de
En Venezuela, están representados todos los organismos y asociaciones
fijadoras de nitrógeno, siendo un potencial casi inexplorado; está en nuestras
manos jugar
un papel en este contexto.
LITERATURA CITADA
Adams, D. G. 2000. Symbiotic Interactions. In The Ecology of Cyanobacteria. Whitton, B. A. and Potts, M. (ed.), Dordrecht, Netherlands:
The Kluwer Academic Publ. pp. 523-561
Allan, D. and Graham. P. 2002. Soil 5611: Soil Biology and
Fertility: Symbiotic Nitrogen Fixation, other N2-fixing symbiosis. Dep. of Soil, Water, and Climate. University
of Minnesota. Disponible
en
http://www.soils.agri.umn.edu/academics/classes/soil3612/SymbioticNitrogenFixation/Other.htm
(Última visita 15 de noviembre de 2004)
Andrade de, Z. and Cuenca, G.
1998. First report of Giomalean fungi in the highlands tepuis
of
Armstrong, W. J. 2004.
Parmotremma stuppeum. Disponible en:http://waynesword.palomar.edu/pljan98f.htm#parmotremma. (Última visita 22 de noviembre de 2004)
Armstrong, W. J. 2001. Teloschistes
chrysophthalmus.
Disponible en: http://waynesword.palomar.edu/pljan98f.htm#lobaria. (Última visita 18 de noviembre de 2004)
Becker, D., Stanke, R., Fendrik, I., Frommer, W.B., Vanderleyden, J., Kaiser, W.M., Hedrich, R. 2002. Expression of the NH+4-transporter
gene LEAMT1;2 is induced in tomato roots upon
association with N2-fixing bacteria. Planta 215:424–429.
Becking,
J.H. 1974. Family III. Frankiaceae Becking
Beijerinck,
M.W. 1888. Die bakterien der papilionaceen knolichen. Bot. Zeit. 46:725-735.
Beijerinck,
M.W. 1925. Über ein Spirillum, welches freien Stickstoff binden kannh. Zentralbl Bakteriol Parasitenkd Infektionskr Abt 63: 353.
Benson, D.R. and Silvester, W.B. 1993. Biology of Frankia
strains, actinomycete symbionts
of actinorhizal plants. Microbiol.
Rev. 57(2):297-319.
Benson, J. and Margulis.
L. 2002. The Gunnera manicata–Nostoc symbiosis: is the red stipulate tissue
symbiogenetic?. Biol. Environ. Proc. of the Royal
Irish Acad. 102 (1):45–48.
Bergman, B., Johansson, C. and Soderback, E. 1992.
The Nostoc–Gunnera
symbiosis. New Phytol.
122:379–400.
Brodo, I.M., Sharnoff,
S.D., Sharnoff, S. 2001. The Lichens of North
America. New Haven, MA, USA: Yale University Press.
Capone, D. G., Zehr, J. P., Paer, H. W. l, Bergman, B. and Carpenter, E. J. 1997. Trichodesmium,
a globally significant marine cyanobacterium. Science
276:1221-1229.
Carrapiço, F. 2002. The Azolla-Anabaena-bacteria
system as a natural microcosm. Proceedings of SPIE 4495: 261-265.
Casida, L. E. Jr. 1982. Ensifer adhaerens gen. nov.,
sp. nov. a bacterial predator of bacteria in soil.
Int. J. Syst. Bacteriol. 32, 339-345.
Ching-Hong, Y., Crowley, D.E., Borneman, J. and Keen, N. T. 2001. Microbial phyllosphere populations are more complex than previously realized. Proc. Nat. Acad. Sci. 98(7):3889-3894.
Costa, J. L. Paulsrud, P., Rikkinen, J. and Lindblad, P. 2001. Genetic diversity of Nostoc symbionts endophytically associated with two bryophyte species. Appl. Environ. Microbiol. 67(9):4393-4396.
Dreyfus, B., Garcia, J. L., and Gillis, M. 1988. Characterization of Azorhizobium caulinodans gen. nov., sp. nov., a stem-nodulating nitrogen-fixing bacterium isolated from Sesbania rostrata. Int. J. Syst. Bacteriol.
38:89-98.
Dugan,
M. 2004. Field Training Manual for Laboratory
Analysts. Disponible
en: www. home.alltel.net/mikeric/chap10up/Chapter
10 Nitrogen.htm. (Última visita 15 de noviembre de 2004)
Eckert, B.,
Weber, O.B., Kirchhof, G., Halbritter, A., Stoffels, M. and Hartmann, A. 2001. Azospirillum doebereinerae sp. nov.,
a nitrogen-fixing bacterium associated with the C4-grass Miscanthus.
.Int. J. Syst. Evol. Microbiol.
51: 17-26.
Espinoza, Y. y Gutiérrez, R. 2003. Variabilidad intraespecifica de Azolla filiculoides, colectadas en la zona centro-occidental de
Venezuela.
Rev. Fac. Agron. (LUZ). 2003, 20:
156-167.
Estrada, P., Bustillos, R. and
Caballero, J. 2001. Burkholderia,
a genus rich in plant-associated nitrogen fixers with wide environmental and
geographic distribution. Appl. Environ. Microbiol.
67(6):2790-2798.
Fred,
E. B., Baldwin, I. L. and McCoy, E.
1932. Root Nodule Bacteria and
Leguminous Plants. Madison, U.S.A.: The
University of Wisconsin Press.
Gage DJ. 2004. Infection and invasion of roots by symbiotic,
nitrogen-fixing rhizobia during nodulation of temperate legumes.Microbiol.
Mol. Biol. Rev. 68(2):280-300.
González,
J. E. and Marketon, M. M. 2003. Quorum sensing in nitrogen-fixing rhizobia. Microbiol.Mol.Biol.Rev. 67(4):574-592.
Halbleib, C. M. and Ludden, P. W. 2000. Regulation of Biological Nitrogen Fixation. J. Nutr. 130:1081-1084.
Harrison, J., Pou de Crescenzo, M. A., Sené, O. and Hirel, B. 2003. Does lowering glutamine synthetase activity in nodules modify nitrogen metabolism and growth of Lotus japonicus?. Plant Physiol. 133:253-262.
Hellriegel,
H. and Wilfarth, H.
1888. Untersuchungen
ubre die aticckstoff-nahrung
der Gramineen und Leguminosen.
Zeitschrift fur der verschiedige
Rubenzücker des Deutsches Reichs. Beilagehet.
Herrero, A., Muro-Pastor, A. M., and Flores, E. 2001. Nitrogen Control in Cyanobacteria. J. Bacteriol. 183(2):411-425.
Hill, D. 2001.
Lichens and co-ordination of the symbionts. MicrobioL. Today 28:124-137.
Hiltner, L. 1904. Über neuere Erfahrungen und Probleme auf dem Gebiet der Bodenbackteriologie und unter besonderer Berücksichtigung der Gründüngung und Brache. Arbeiten Deutscher Landwirtschafts Gesellschaft 98:59–78.
Hirano, S. S. and Upper, C. D. 2000. Bacteria in the leaf ecosystem with emphasis on Pseudomonas syringae-a pathogen, ice Nucleus, and epiphyte. Microbiol. Mol. Biol. Rev. 64(3):624-653.
Hirsch,
A. M. 1992. Developmental biology of legume
nodulation. New Phytol. 122:211-237.
Huss, K. 1990. The physiology of actinorhizal root
nodules. In The Biology of Frankia and Actinorhizal Plants. Schwintzer,
C. R. and Tjepkema, J. D. (eds.) London: Academic
Press. pp. 129–156.
Huss, K.
1999. Nitrogen fixation in Frankia symbioses. XVI International Botanical
Congress 1999. 1-7 August, Saint Louis, Missouri,U.S.A.
Jarvis, B. D. W., Van Berkum,
P., Chen, W. X., Nour, S. M., Fernandez, M. P., Cleyet-Marel J. C. and Gillis, M. 1997. Transfer of Rhizobium loti, Rhizobium huakuii, Rhizobium
ciceri, Rhizobium
mediterraneum, and Rhizobium tianshanense to Mesorhizobium
gen. nov. Int. J. Syst. Bacteriol.
47:895-898.
Jordan, D.C. 1982. Transfer of Rhizobium japonicum Buchanan 1980 to Bradyrhizobium
gen. nov., a genus of slow-growing, root nodule
bacteria from leguminous plants. Int. J. Syst. Bacteriol.
32:136-139.
Khammas,
K.M., Ageron, E., Grimont,
P.A.D. and Kaiser, P. 1989. Azospirillum irakense sp. nov., a nitrogen
fixing bacterium associated with rice roots and rhizosphere
soil. Res. Microbiol. 140: 679-693.
Laplaze, L., Duhoux,
E., Franche, C., Frutz, T.,
Svistoonoff, S., Bisseling,
T., Bogusz, D., Pawlowski,
K. 2000. Casuarina glauca
prenodule cells display the same differentiation
as the corresponding nodule cells. Mol. Plant Microbe Interact. 13: 107-112.
Lechevalier, M.P. and Lechevalier,
H.A. 1979. The taxonomic position of the actinomycete
endophytes. In
Symbiotic Nitrogen Fixation in the Management of Temperate Forests. Gordon,
J.C., Wheleer, C.T. and Perry, D.A. (eds.). Oregon
State University Forest Research Laboratory, Corvallis. pp
111-121.
Lee, S., Flores-Encarnación, M., Contreras-Zentella, M., Garcia-Flores, L.,
Escamilla, J.E. and Kennedy, C. 2004. Indole-3-acetic acid biosynthesis is deficient in Gluconacetobacter
diazotrophicus strains with mutations in
cytochrome c biogenesis genes. J. Bacteriol.
186(16):5384-5391.
Lindblad, P. and Costa, J.L. 2002. The cyanobacterial–cycad symbiosis. Biol.
Environ. Proc. Royal Irish Academy
102B (1):31–33.
Lindow, S.E. and Brandl, M.T. 2003. Microbiology of the Phyllosphere. Appl. Environ. Microbiol. 69(4):1875-1883.
Magelhaes,
F.M.M., Baldani, J.I., Souto,
S.M., Kuykendall, J.R. and Döbereiner, J.
Mantelin, S. and Touraine,
B. 2004. Plant growth-promoting bacteria
and nitrate availability: impacts on root
development and nitrate uptake. J. Exp. Bot. 55(394):27-34.
Martin,
J.K. and Kemp, J.R. 1980.
Carbon loss from roots of wheat cultivars. Soil Biol. Biochem.
12:551-554.
Mayz, J. 1997. Simbiosis
Leguminosas/Rizobia. Ediciones del Instituto de
Investigaciones Agropecuarias IIAPUDO .
Universidad de Oriente. Núcleo de Monagas. Maturín. Venezuela. 113 p.
Medeiros,
J and Stevenson D 2004. Coralloid roots
and nitrogen fixation. Disponible
en: http://plantnet.rbgsyd.gov.au/PlantNet/cycad/nitrogen/nfixd.html. (Última
visita 15 de noviembre de 2004)
Meeks, J. C. and Elhai, J. 2002. Regulation of Cellular Differentiation in Filamentous Cyanobacteria in Free-Living and Plant-Associated Symbiotic Growth States. Microbiol. Mol. Biol. Rev. 66(1):94-121.
Miflin, B. J. and Habash, D. Z.
2002. The role of glutamine synthetase and glutamate dehydrogenase in nitrogen
assimilation and possibilities for improvement in the nitrogen utilization of
crops. J. Exp. Bot. 53(370);979-987.
Mirza, M.S., Ahmad, W., Latif, F., Haurat, J., Bally, R., Normand, P., Malik, K.A. 2001. Isolation, partial characterization, and the effect of plant growth-promoting bacteria (PGPB) on micro-propagated sugarcane in vitro. Plant Soil 237:47–54.
Nalin, R.,
Putra, S. R., Domenach, A. M., Rohmer, M., Gourbiere,
F. and Berry, A. M. 2000. High hopanoid/total
lipids ratio in Frankia mycelia is not related
to the nitrogen status. Microbiol. 146:3013-3019.
Obertello, M., Oureye, M., Laplaze, L., Santi, C., Svistoonoff, S., Auguy, F., Bogusz, D. and Franche C. 2003. Actinorhizal nitrogen fixing nodules: infection process,
molecular biology and genomics.
Afr. J. Biotech. 2 (12):528-538.
Oksanen, I., Jokela,
J., Fewer, D.P., Wahlsten, M., Rikkinen,
J. and Sivonen, K. 2004. Discovery of rare and highly toxic microcystins from lichen-associated cyanobacterium
Nostoc sp. Strain IO-102-I. Appl. Environ. Microbiol..
70(10):5756-5763.
Omoregie, O. E., Crumbliss, L. L., Bebout, B. M. and Zehr, J. P. 2004. Determination of Nitrogen-Fixing Phylotypes in Lyngbya sp. and Microcoleus chthonoplastes Cyanobacterial Mats from Guerrero Negro, Baja California, Mexico. Appl. Environ. Microbiol. 70(4): 2119-2128
Ortega, J.L., Temple, S.J., Bagga, S., Ghoshroy, S., Sengupta-Gopalan,
C. 2004. Biochemical
and molecular characterization of transgenic Lotus japonicus plants constitutively
over-expressing a cytosolic glutamine synthetase
gene. Planta 219(5):807-18.
Parsons,
R. 2004. Plant - Microbe Metabolism. Disponible en: www.personal.dundee.ac.uk/~rparsons/andfrank.htm. (Última
visita 15 de noviembre de 2004)
Parsons,
R. and Sunley, R.J.
2001. Nitrogen nutrition and the role of root–shoot nitrogen signalling
particularly in symbiotic systems. J. Exp. Bot. 52:435-443.
Per, P. 2001. The Nostoc Symbiont of Lichens.
Diversity, Specificity and Cellular Modifications. Acta Universitatis Upsaliensis 662:1-56.
Perret, X., Staehelin,
C., Broughton, W.J. 2000. Molecular basis of symbiotic promiscuity. Microbiol. Mol. Biol. Rev. 64(1):180-201.
Persello-Cartieaux, F., Nussaume, L. and Robaglia,
C. 2003. Tales from the underground: molecular plant–rhizobia
interactions. Plant Cell Environ.
26:189–199.
Purvis, W. 2000. Lichens. Smithsonian InstitutionPress: Washington. 112 p.
Rai, A. N., Soderback,
E. and Bergman, B. 2000. Tansley Review No. 116: Cyanobacterium-plant symbioses. New Phytol. 147:449-481.
Reinhold,
B., Hurek, T., Fendrik, I.,
Pot, B., Gillis, M., Kersters, K., Thielemans, S. and De Ley, J. 1987. Azospirillum
halopraeferans sp. nov.,
a nitrogen-fixing organism associated with roots of Kallar
grass (Leptochloa fusca)
(L. Kunth.). Int. J. Syst. Bacteriol.
37: 43-51.
Robson, R. L., and Postgate, J. R. 1980. Oxygen and hydrogen in biological nitrogen fixation. Annu. Rev. Microbiol. 34:183-207.
Schofield, S.C., Campbell, D. A.,
Funk, C. and MacKenzie, T.D.B. 2003. Changes in
macromolecular allocation in nondividing algal symbionts allow for photosynthetic acclimation in the
lichen Lobaria pulmonaria. New Phytologist 159: 709–718.
Scott, D. B., Farnden, K. J. F. and Roberts,
J. G. 1976. Ammonia assimilation in lupin
nodules. 263:705-707.
Segura, D.
and Espín, G. 1998. Mutational Inactivation of a Gene Homologous to Escherichia
coli ptsP Affects Poly-b-Hydroxybutyrate Accumulation and Nitrogen
Fixation in Azotobacter vinelandii.
J. Bacteriol. 180(18):4790-4798.
Sellstedt, A. and
Atkins, C. A. 1991.
Composition of amino compounds transported in xylem of Casuarina
sp. J. Exp. Bot. 42:1493–1497.
Silverside, A. J.
2002. Caloplaca saxicola
(Hoffm.)Nodin. Biodiversity Reference Pages. University of Paisley, U.K. Disponible en:
http://www-biol.paisley.ac.uk/research/Asilverside/lichens/Caloplaca_saxicola.html.
(Última visita 12 de
noviembre de 2004).
Silvester,
W. B., Harris, S. L. and Tjepkema, J. D. 1990. Oxygen regulation and hemoglobin. In
The Biology of Frankia and Actinorhizal
Plants, pp. 157-173. Schwintzer, C. R. and Tjepkema, J. D. (Eds.). New York: Academic Press.
Sly,
L. I. and Stackebrandt, E. 1999. Description of Skermanella parooensis
gen. nov., sp. nov. to
accommodate Conglomerans largomobilis subsp. parooensis
following the transfer of Conglomeromonas largomobilis subsp. largomobilis
to the genus Azospirillum. Int. J. Syst. Bacteriol. 49: 541-544.
Smith,
W.H. 1976. Character
and significance of forest tree root exudates. Ecology 57:324-331.
Sprent,
J. I. and Sprent, P.
1990. Nitrogen Fixing Organisms. Pure and Applied Aspects. Londo, U.K.:Chapman-Hall. 256 p.
Stanier, R. Y. and Cohen-Bazire, G. 1977. Phototrophic prokaryotes: the cyanobacteria. Annu. Rev. Microbiol. 31:225-274.
Stockholm University (S.U.). 2004.
Establishment and communication in cyanobacterial
- plant symbiosis: Molecular cyanobacterial-plant
interactions.
Sundin, G. W. and Jacobs, J. L. 1999. Ultraviolet radiation (UVR) sensitivity analysis and UVR survival strategies of a bacterial community from the phyllosphere of field-grown peanut (Arachis hypogeae L.). Microb. Ecol. 38:27-38.
Tarrand,
J., Krieg, N.R. and Döbereiner, J.
Thoumire,
E. 2004. Corraloid Roots of
Cycads. In Chapter 3: Biology of Cycads. Disponible en:
http://www.plantapalm.com/vce/biology/biology.htm. (Última visita 15 de
noviembre de 2004)
Todar, K. 2004. Todar’s Online Texbook of Bacteriology.
Important Groups of Prokaryotes. Disponible en:
http://www.textbookofbacteriology.net. (Última visita 15 de noviembre de 2004)
Ureta, A. and Nordlund,
S. 2002.
Evidence for Conformational Protection of Nitrogenase
against Oxygen in Gluconacetobacter diazotrophicus by a Putative FeSII
Protein. J. Bacteriol. 184(20):5805-5809.
van Hove, C. and Lejeune, A. 2002.
The Azolla–Anabaena simbiosis. Biology and Environment: Proceedings of the Royal Irish Academy
102B(1):23–26.
Vance,
C. P., Miller, S. S., Driscoll, B. T., Robinson, D. L., Trepp,
G., Gantt, J. S. and Samas, D. A. 1998. Nodule carbon
metabolism: organic acids for N2 fixation. In Biological
Nitrogen Fixation for the 21st Century. Elmerich,
C.,. Kondorosi, A and Newton, W. E. (eds.) Dordrecht: Kluwer pp. 443-448.
Verghese, S. and Misra A. K. 2002. Frankia–actinorhizal
symbiosis with special reference to host–microsymbiont
relationship. Current Sci.
83(4):404-408.
Virtual Cycad Enciclopedia (VCE).
2004. Disponible en: http://www.plantapalm.com/vce/species/cycas_revoluta.htm.
(Última visita 15 de noviembre de 2004).
Walsh, K.B., Ng, B. H., Chandler, G. E. 1984. Effects of nitrogen nutrition on xylem sap composition of the Casuarinaceae. Plant Soil 81:291–293.
Wanntorp, L. and Wanntorp,
H.E. 2003. The biogeography of Gunnera
L.: vicariance and dispersal. J.
Biogeography 30:979-987.
Weir,
B. 2004.
Rhizobia taxonomy: The current taxonomy of rhizobia. Disponible en:
http://www.rhizobia.co.nz/Rhizobia_Taxonomy.html. (Última visita 15 de noviembre de 2004)
Wheeler, C. T. and Bond, G. 1970. The amino acids of non-legume root nodules. Phytochem. 9:705–708.
Wong,
F. C.Y. and. Meeks J. C. 2002.
Establishment of a functional symbiosis between the cyanobacterium
Nostoc punctiforme
and the bryophyte Anthoceros punctatus requires genes involved in nitrogen control
and initiation of heterocyst differentiation. Microbiol.
148: 315-323.
Yoon, H.S. and Golden, J. W. 2001. Pats and products of nitrogen fixation
control heterocyst pattern. J. Bacteriol. 183(8): 2605-2613.
Página diseñada por Prof. Jesús Rafael Méndez Natera
TABLA DE CONTENIDO DE LA REVISTA
CIENTÍFICA UDO AGRÍCOLA