Revista Científica UDO Agrícola Volumen
1. Número 1. Año 2001. Páginas: 29-33
Evaluación
citogenética de la generación M1V2
de tetraploides experimentales en sábila
(Aloe vera L.)
Cytogenetic evaluation of M1V2 generation from
experimental tetraploids in Aloe vera L.
Imery-Buiza,
José y Cequea-Ruíz, Hernán
Departamento de
Biología, Escuela de Ciencias, Universidad de Oriente
Cumaná. Venezuela. Apart. Post. 245; Email: jimery@cumana.sucre.udo.edu.ve
RESUMEN
Se
analizaron las características cromosómicas en los descendientes
vegetativos de plantas de A. vera con
tetraploidía completa y parcial inducida
mediante la inmersión de rizomas en solución de colchicina. Los mutantes cromosómicos M1V1
se cultivaron bajo condiciones de vivero hasta la obtención de propágulos M1V2
con
Palabras claves: Aloe vera,
tetraploides, cromosomas, colchicina.
ABSTRACT
Chromosomal
characteristics were analyzed in the vegetative descendants of A. vera plants
with complete and partial induced tetraploidy by
means of the immersion of rhizomes in colchicine solution. The chromosomal
mutants M1V1 were cultivated under greenhouse conditions
until the obtaining of suckers M1V2 with 4 to 6 leaves.
The descendants were identified according to its position in the maternal
rhizome periphery. The evaluation of the number, size and morphology of the
mitotic chromosomes was carried out in temporary slide with squashing of root
tips treaties with colchicine, fixer, HCl and FLP orceine. The karyological results allowed to recognize a complete chromosomic stability in the suckers from tetraploid plants, staying a constant karyotype 2n=4x=28 in
all the analyzed samples. The suckers of chimerical plants M1V1
corroborated the existence of mericlinal mutations
induced by low exhibition and concentration colchicine levels and the
identification of the mutant quadrants in its partially tetraploid
parents. Contrary to the chimerical plants M1V1, its
descendants M1V2 presented a individual diploid or tetraploid
level in its radical meristems. Aneuploid chromosomic variations neither structural changes were not
observed from the colchicine effects or postreatment
cellular accidents in both generations.
Key words: Aloe vera, tetraploids,
chromosomes, colchicine.
INTRODUCCIÓN
La
sábila (Aloe vera L. = A. barbadensis
Mill.), es una especie xerofítica nativa de la
costa Noroccidental de África, cultivada como planta ornamental y de uso
medicinal (Davis, 1997). La creciente demanda de los subproductos de esta
planta fomenta actualmente la búsqueda de alternativas de procesamiento
y comercialización que incluyen el mercadeo de gel fresco y liofilizado,
así como otros derivados fundamentales para la elaboración de
medicamentos, cosméticos, bebidas, etc. (Jiménez et al., 1995; Vázquez et al., 1996; Pullido,
1998; Boon, 1999). Esta intensa actividad económica
ha impulsado el inicio de programas de mejoramiento genético con la
finalidad de obtener cultivares con mayores volúmenes de
producción, resistentes a plagas y enfermedades, adaptación a
nuevas zonas de cultivo, etc. En este sentido, la inducción de poliploidía en A.
vera, mediante el uso de colchicina, representa
una opción relativamente rápida para lograr genotipos promisorios
que puedan ser explotados directamente o que ofrezcan suficiente variabilidad
genética necesaria para iniciar programas de selección (Imery, 2000).
Generalmente, los poliploides desarrollan tejidos
más vigorosos y productivos que pueden duplicar la acumulación de
biomasa de los individuos originales. La mayoría de estos genotipos
superiores corresponden a cultivares aprovechables por sus
características vegetativas, entre ellos, hortalizas, frutales,
raíces, tubérculos, ornamentales y forrajes, los cuales se han
obtenido por la incorporación de variaciones en su nivel de ploidía durante alguna fase de manipulación
genética (Shimotsuma, 1962; Verma y Raina, 1991). No
obstante, los avances alcanzados con la inducción de poliploidía
en una primera generación, pueden resultar poco estables debido al
restablecimiento del número normal de cromosomas en generaciones
sucesivas (Jackson, 1976).
El objetivo del presente trabajo fue evaluar las
características cromosómicas en los descendientes vegetativos de
plantas tetraploides de A. vera generadas a partir de yemas laterales sometidas a
diferentes concentraciones y tiempos de exposición en colchicina.
MATERIALES
Y MÉTODOS
La inducción inicial de poliploidía
se logró mediante inmersión completa de rizomas de Aloe vera en solución acuosa de colchicina a tres concentraciones (0,05; 0,10 y 0,15% p/v)
y cuatro tiempos de exposición (6, 12, 18 y 24 horas). Los esquejes
tratados fueron lavados con agua a chorro continuo durante un minuto y
sembrados en una mezcla desinfectada de arena, tierra y aserrín. A los
60 días después del tratamiento, se trasplantaron los hijuelos a
bolsas de polietileno, manteniéndose bajo condiciones de vivero hasta su
evaluación (Imery, 2000). De los 491 brotes emergentes postratamiento, se reconocieron 29 hijuelos completamente tetraploides y 26 quimeras con células diploides y tetraploides. Estos mutantes cromosómicos M1V1
se cultivaron en las mismas condiciones ambientales hasta la obtención
de propágulos M1V2
con cuatro a seis hojas.
La evaluación del número, tamaño y
morfología de los cromosomas mitóticos se realizó a partir
de láminas temporales preparadas por el método de aplastamiento
de meristemas radicales, sometidos previamente a colchicina (0,025% p/v) por dos horas, fijador (3:1 etanol:
ácido acético glacial) por 24 horas, HCl
durante 10 minutos y tinción con orceína
FLP 1,5% p/v por cuatro minutos (Mata, 1977; Cequea, 1985). Se analizaron cinco ápices radicales
por cada descendiente M1V2.
RESULTADOS
La evaluación cariológica en la
primera generación M1V1, representada por las
plantas emergentes después del tratamiento con colchicina,
reveló efectos diferenciales de este alcaloide sobre la actividad
mitótica de los meristemas laterales de A. vera, en función del tiempo de
exposición y la concentración empleada (cuadro 1). La mayor
eficiencia en la duplicación del número de cromosomas se alcanzó
con la inmersión de rizomas en 0,15% de colchicina
durante 24 horas. Las combinaciones de otros niveles de tratamiento resultaron
en eficiencias inferiores de duplicación cromosómica,
además de inducciones parciales de tetraploidía.
|
Cuadro 1. Porcentaje de plantas diploides (2x) y mutantes M1V1
tetraploides (4x) y parcialmente tetraploides (2x y 4x), generadas a partir de rizomas de sábila (Aloe vera L.) sometidos a tratamiento
con colchicina. |
||||
|
Tiempo de Exposición
(horas) |
Concentración
de colchicina (% p/v) |
|
||
|
0,05 |
0,10 |
0,15 |
Total |
|
|
6 |
71,4 28,6 0,0 |
90,5 9,5 0,0 |
98,0 2,0 0,0 |
87,4 12,6 0,0 |
|
12 |
85,2 11,1 3,7 |
91,6 2,8 5,6 |
97,9 0,0 2,1 |
91,3 4,6 4,1 |
|
18 |
95,4 2,3 2,3 |
89,7 0,0 10,3 |
81,8 0,0 18,2 |
90,4 1,1 8,5 |
|
24 |
84,6 0,0 15,4 |
90,9 0,0 9,1 |
76,7 0,0 23,3 |
84,3 0,0 15,7 |
|
Total |
84,3 11,5 4,2 |
90,9 3,4 5,7 |
91,4 0,7 7,9 |
88,8 5,3 5,9 |
|
Valores
porcentuales para cada combinación y totales por nivel de tratamiento.
Plantas diploides (superior), mutantes quiméricos (intermedio) y
mutantes tetraploides (inferior) (Imery, 2000). |
||||
El análisis cariotípico en los
descendientes vegetativos de plantas tetraploides y
parcialmente tetraploides, permitió evaluar la
estabilidad cromosómica en estos mutantes M1V1.
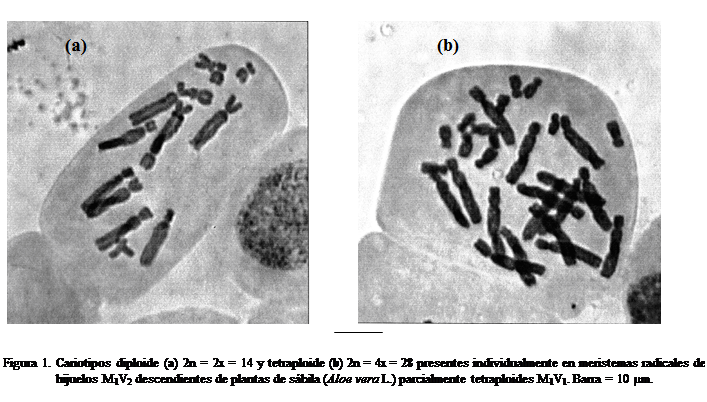
Todos los brotes M1V2 generados de plantas completamente tetraploides M1V1,
presentaron el mismo número de cromosomas (2n=4x=28) en sus meristemas radicales; sin embargo, los hijuelos M1V2
provenientes de plantas parcialmente tetraploides M1V1 (con líneas celulares
2n=2x=14 y 2n=4x=28), presentaron cariotipos individuales con uno u otro nivel de ploidía (figura 1). A partir de estos resultados, se
reconocieron los cuadrantes mutantes en las plantas quiméricas y se
establecieron las proporciones porcentuales de descendientes diploides y tetraploides, en relación a las combinaciones de
concentración y tiempo de exposición a la colchicina,
aplicadas al tejido materno (cuadro 2).
|
Cuadro
2. Porcentaje de hijuelos diploides (2x) y tetraploides
(4x)
descendientes de plantas de sábila (Aloe vera L.) con tetraploidía parcial
inducida por el tratamiento con colchicina. |
||||
|
Tiempo de Exposición
(horas) |
Concentración
de colchicina (% p/v) |
|
||
|
0,05 |
010 |
0,15 |
Total |
|
|
6 |
70,5 29,5 |
57,6 42,4 |
55,6 44,4 |
66,2 33,8 |
|
12 |
43,8 56,2 |
- |
- |
52,3 47,7 |
|
18 |
- |
- |
- |
25,0 70,5 |
|
24 |
- |
- |
- |
- |
|
Total |
62,8 37,2 |
53,1 46,9 |
55,6 44,4 |
60,1 39,9 |
|
Valores porcentuales para cada combinacion y totales por nivel de tratamiento de acuerdo
al número de descendientes diploides (superior) y tetraploides
(inferior) provenientes de plantas quiméricas M1V1.
Combinaciones sin valor porcentual indican ausencia de plantas
quiméricas M1V1. |
||||
Similar a los resultados preliminares en M1V1, los
descendientes M1V2 de plantas quiméricas,
evidenciaron que la eficiencia de la colchicina como
agente inductor de duplicación cromosómica, no depende
sólo de su efecto antimitostático sobre
el tejido meristemático, sino que está
en función de la concentración empleada y el tiempo de
penetración en el tejido. Por otra parte, no se observaron variaciones
cromosómicas de tipo aneuploide ni cambios
estructurales atribuibles a los efectos directos o residuales de este
alcaloide.
DISCUSIÓN
El
efecto bloqueador de la colchicina sobre la
polimerización de las proteínas tubulares, encargadas de la movilización de
los cromosomas durante la mitosis, determina la actividad de este alcaloide
como agente inductor de duplicaciones cromosómicas sobre los meristemas laterales de A.
vera. No obstante, la eficiencia de la colchicina
para inducir tetraploidía en esta especie,
dependió no sólo de su efecto antimitostático
sobre el tejido en división, sino que estuvo asociada a los niveles de
concentración y duración del tratamiento. Resultados similares
han sido observados en otras especies vegetales, concluyéndose
reiteradamente que los factores exógenos más influyentes en la
efectividad de la colchicina para provocar
variaciones cromosómicas, son definitivamente la concentración de
la solución, duración de la exposición y la temperatura de
tratamiento (Ronald y Paul, 1984; Sarada-Mani, 1987; Sun et al., 1994;
IAEA, 1995).
Al analizar la acción de la colchicina
sobre semillas, plántulas, meristemas y
células en suspensión, cabe destacar además, la gran
diversidad de resultados en función de las características
anatómicas y grado de diferenciación de los tejidos tratados (Mönckeberg et al.,
1988; Lindsey y Jones, 1989; Mendoza, 1994; Gao et al., 1996;
Hansen y Andersen, 1996; Zhao et al., 1996; Kim et al.,
1997; Ma et al.,
1997; Song et
al., 1997). En este sentido, la escasa acumulación de biomasa y
permeabilidad de los primordios foliares en las yemas
laterales de A. vera, favorecen la
penetración del alcaloide hasta las capas celulares en actividad
mitótica. Este efecto es más evidente al prolongar el periodo de
inmersión hasta 24 horas, aumentando así el número de
células meristemáticas en contacto con
la colchicina. De este modo, se alcanza un nivel
constante de tetraploidía transmisible
vegetativamente hacia los nuevos propágulos M1V2; mientras que a niveles
inferiores de exposición, el efecto directo sobre las células meristemáticas se reduce, debido a la acción
sobre las capas superficiales y al contacto con células interfásicas en las que la colchicina
no ejerce ninguna actividad antimitostática.
Esta situación evidencia la inducción de variaciones mericlinales a bajos niveles de tratamiento y explica la
mayor proporción de plantas quiméricas M1V1,
en las cuales se observaron simultáneamente células diploides y tetraploides, que posteriormente actuaron como precursores
individuales de descendientes vegetativos M1V2
diploides o tetraploides.
La regresión en el nivel de ploidía
de algunas especies vegetales planteada por Jackson (1976), posiblemente sea el
resultado de la baja frecuencia de duplicaciones cromosómicas que
experimentan las poblaciones naturales combinado con la ausencia de mecanismos
de aislamientos reproductivos que favorece la subsecuente hibridación
entre individuos mutantes y silvestres. Por otra parte, se esperaría
menor regresión en la duplicación del número de cromosomas
en especies como A. vera que se
propagan exclusiva de forma vegetativa, y en las cuales la ocurrencia de
cruzamientos con ancestros diploides no representa una oportunidad para afectar
el nivel de ploidía de la nueva
generación. No obstante, la evaluación cariológica
de futuras generaciones vegetativas permitirá establecer con mayor
seguridad la estabilidad genómica de los poliploides experimentales de A. vera y el reconocimiento de posibles
reordenamientos cromosómicos en estos genotipos promisorios.
LITERATURA CITADA
Boon, L. El
“milagro” envasado. De la sábila y sus derivados. Salud.
Rev. Estampas. El Universal, 21 de noviembre 1999. 19-21 pp.
Cequea, H. 1985. Estudio citogenético de los autotetraploides
de cinco especies de Machaeranthera (Compositae).
Acta
Cient. Venez., 36:375-380.
Davis, R.H. 1997. Aloe vera; A scientific approach. Vantage
press, Inc.
Gao, S.L., Zhu, D.N., Cai, Z.H. & Xu, D.R. 1996. Autotetraploid
plants from colchicine-treated bud culture of Saliva miltiorrhia Bge.
Plant Cell Tissue and Organ Culture, 47(1):73-77.
Hansen, J.P. & Andersen, B.
International Atomic Energy Agency (IAEA).
1995. Manual on mutation breeding. 2ed. Technical reports series N 119.
51 – 70 pp.
Imery, J.
2000. Inducción
de tetraploidía en Aloe vera (L.) Burm. f. (Aloaceae). Tesis de maestría. Postgrado en Biología
aplicada. Universidad de Oriente, Núcleo Sucre. Cumaná-Venezuela.
73 p.
Jiménez, L., Sumano,
H. & Mateo, G. 1995. The use of Aloe vera for the treatment of teat cracks and lacerations
in dairy cattle. Veterinaria México, 26(3):271-272.
Kim,
S., Won, Y., Song, H., Eun,
S. & Lee, W. 1997. Polyploidy induction of Cymbidium kanran by treatment of
colchicine in vitro. RDA J. Hort. Sci., 39(1):73-79.
Lindsey, K., & Jones, M. 1989. Plant biotechnology in agriculture.
Open University Press.
Ma, Y., Byrne, D. H. & Chen, J. 1997. Amphydiploid
induction from diploid rose interspecific hybrids. Hort Sci., 32(2):292-295.
Mata,
A. 1977. Estudio citogenético de las especies Aloe ciliaris Haw., A. tenuior Haw., A. variegata L.
y A. vera Linn.
(Liliaceae). Trabajo de ascenso. Departamento de
Biología. Universidad de Oriente. Cumaná, Venezuela. 45 pp.
Mendoza, E. 1994. Agrobiotecnología; La adaptación de las
plantas al ambiente, no del ambiente a las plantas. Edit. Iberoamérica,
S.A. México. 78 pp.
Mönckeberg, F., Agosin, E., Perretta, M., Rosemblatt, M., Spencer, E., Valenzuela, A. &
Valladares, L. 1988. La revolución de la bioingeniería. Pub. Téc. Meditarráneo.
Chile. 187 pp.
Pullido, V. 1998.
Sábila para exportar; Oro que se siembra. Rev. Sem. Primicia, 11:46-47.
Ronald, G. & Paul, M.
Sarada-Mani, N. 1987. Cytological studies of autotetraploid grain Sorghum. Cytologia,
52:587-591.
Shimotsuma, M. 1962. Studies on triploid seed production in
watermelons. Jap. J. Breeding, 12:56
Song, P., Kang, W. & Peffley, E. B. 1996. Chromosome doubling of Allium fistulosum x
A. cepa interspecific
F1 hybrids through colchicine treatment of
regenerating callus. Euphytica, 93(3):257-262.
Sun, Y., Cheng, S. & Liang, G. 1994.
Induction of autotetraploid plants of Sorghum versicolor.
Cytologia, 59:109-114.
Vázquez, B., Avila, G., Segura, D. & Escalante,
B. 1996. Antiinflammatory activity
of extracts from Aloe vera gel. J. Ethnopharmacol.
Elsevier Sci. Irland Ltd., 55(1):69-75.
Verma, R.C. & Raina, S.N. 1991. Characteristics of colchiploid Phlox drummondii. Indian J. Genet., 51:315-319.
Zhao, J., Simmonds, D. & Newcomb, W. 1996.
High frequency production of doubled haploid plant of Brassica napus cv. Topas
derived from colchicine-induced microspore embryogenesis without heat shock.
Plant Cell Reports, 15:668-671.
Página
diseñada por Prof. Jesús Rafael Méndez Natera
TABLA DE
CONTENIDO DE LA REVISTA CIENTÍFICA UDO
AGRÍCOLA



