 |
Revista Científica UDO Agrícola Volumen 12. Número 1. Año 2012. Páginas: 55-68
Sistema de regeneración in vitro por embriogénesis somática indirecta en variedades venezolanas de arroz (Oryza sativa L.)
in vitro regeneration system for indirect somatic embryogenesis in Venezuelan varieties of rice (Oryza sativa L.)
Rafael FERNÁNDEZ DA SILVA
Laboratorio de Biotecnología Aplicada, Departamento de Biología, Facultad Experimental de Ciencias y Tecnología, Universidad de Carabobo. Valencia, estado Carabobo, Venezuela E-mail: rfernandez2@uc.edu.ve
|
Recibido: 30/04/2011 |
Fin de primer arbitraje: 15/02/2012 |
Primera revisión recibida: 20/02/2012 |
|
Fin de segundo arbitraje: 26/04/2012 |
Segunda revisión recibida: 09/05/2012 |
Aceptado: 10/05/2012 |
RESUMEN
Se evaluaron las frecuencias de inducción de callos y regeneración in vitro a partir de semillas maduras, en cuatro variedades de arroz venezolanas: Araure-4, Centauro, Venezuela-21 (resistentes) y Cimarrón (susceptible) al hongo Pyricularia grisea. Se determinó variabilidad genotípica en las variedades, donde se observó que Cimarrón resultó recalcitrante a todos los medios de cultivo, a diferencia del resto de las variedades donde la frecuencia de inducción de callos embriogénicos osciló entre 3% y 81%, se evidenció que las mayores frecuencias de callos embriogénicos se encontraban en medios enriquecidos con bajas concentraciones de 2,4-D sola o combinada con una citoquinina. La variedad Venezuela-21, presentó un 81% de callos embriogénicos en concentraciones de 1 mg.L-1 de 2,4-D, Centauro un 67,5% en 2 mg.L-1 de 2,4-D y 2 mg.L-1 BA, y Araure-4 un 66% en 1 mg.L-1 de 2,4-D y 2 mg.L-1 K. En cuanto al sistema de regeneración, se determinó que los medios de cultivo enriquecidos con 0,5 mg.L-1 de AIA y 2 mg.L-1 BA, presentaron mayor frecuencia de regeneración para las dos variedades evaluadas, 44,4% Araure-4 y 44% Centauro. A través de estudios morfoanatómicos se corroboró que la regeneración de plantas fue a través del proceso de embriogénesis somática indirecta.
Palabras clave: Oryza sativa, 2,4-D, K, BA, embriogénesis somática
ABSTRACT
We evaluated the frequency of induction of calli and in vitro regeneration from mature seeds in four rice Venezuelan varieties, Araure-4, Centauro, Venezuela-21 (resistant), and Cimarron (susceptible) to the fungus Pyricularia grisea. Genotypic variability was identified in varieties, Cimarron was recalcitrant to all culture media, unlike the rest of the varieties where the frequency of induction of embryonic calli ranged between 3% and 81.2%, the higher frequencies were obtained in enriched media with low 2.4-D concentrations. The Venezuela-21 variety showed a 81% embryogenic calli at 1 mg.L-1 2,4-D, for Centauro variety a 67.5% was detected at 2 mg.L-1 2,4-D plus 2 mg.L-1 BA, finally Araure-4 showed 66% at 1 mg.L-1 2,4-D plus 2 mg.L-1 K. For the regeneration system, it was determined that culture media complemented with 0.5 mg L-1 IAA plus 2 mg L-1 BA, yielded a higher frequency of regeneration in both evaluated varieties, Araure-4 (44.4%) and Centauro (44%). Through morphoanatomical studies, it was confirmed that the regeneration plants occurred route indirect somatic embryogenesis.
Key words: Oryza sativa, 2.4-D, K, BA, somatic embryogenesis
INTRODUCCIÓN
El arroz (Oryza sativa L.) es un cultivo de gran importancia a nivel mundial, debido a que es el segundo cereal en consumo luego del trigo, aportando más del 50% de las calorías diarias a más de la mitad de la población mundial (Abreu et al., 1993; INIA, 2004). Su centro de origen es el sudeste de Asía, específicamente en regiones colindantes con el Río Amarillo de la antigua China aproximadamente hace 15.000 años (Uno et al., 2001). De ahí se extiende a toda China, Tailandia, Camboya, Vietnam y sur de la India, llegando posteriormente a Siria y al norte de áfrica alrededor del año 800 D.C. A Europa llega a través de los moros a España y posteriormente al resto del continente, mientras que a Norteamérica llega en 1604, y al subcontinente latino Américano en el siglo XVIII (Hill, 1965: INIA, 2004). En Venezuela en el siglo XX se industrializa masivamente la producción, procesamiento y comercio del arroz, concentrándose su cultivo en los Llanos Centrales (Estado Guárico) y los Occidentales (Estados Portuguesa, Cojedes y Barinas), (Abreu et al., 1993; INIA, 2004).
Este cultivo se presenta en casi todos los países tropicales y subtropicales de los cinco continentes, el asiático produce el 90% del cereal, con China como principal productor (32%), seguido de India (22.7%) e Indonesia (8,6%), mientras que en América, Brasil es el principal productor con un 1.9%, y Venezuela representa un 0.12%, siendo los estados Guárico y Portuguesa los de mayor producción (80%) del país (Danac, 2004).
El arroz pertenece a la Familia Poaceae, género Oryza, siendo Oryza sativa la especie más importante, con tres grupos: Japónica, Indica y Javánica, los dos últimos son los de mayor rendimiento y comercialización mundial (85%) (Hill, 1965; INIA, 2004). Este cereal como todo cultivo es susceptible a numerosas y diversas plagas y enfermedades, las cuales afectan significativamente la productividad del cultivo tanto en calidad como en cantidad. Pyricularia grisea es el patógeno fúngico más devastador del cultivo de arroz en el mundo y Venezuela, siendo causante del anublo del arroz, cuya más grave afectación es la dobladura o ruptura de la panícula, trayendo como consecuencia la no formación de los granos. La capacidad destructiva de este patógeno se fundamenta en el rápido desarrollo de variabilidad genética, haciéndolo adaptable a nuevos cultivares y fungicidas específicos (Kransz et al., 1978; INIA, 2004).
En arroz se han realizado múltiples estudios para lograr su mejoramiento; así, se han descrito eficientes protocolos de regeneración in vitro, marcadores moleculares, bancos genéticos y de germoplasma e ingeniería genética. Como sistemas de regeneración, se han establecido la organogénesis y la embriogénesis somática indirecta, siendo esta última la de mayor potencial regenerativo, tanto por la formación de embriones somáticos primarios como secundarios (Raemakers et al., 1995). Estos procesos se han iniciado a partir de diferentes explantes: embriones sexuales inmaduros (Heyser et al., 1983; Ozawa y Komamine, 1989; Huang et al., 2012), embriones sexuales maduros (Rueb et al., 1994; Afrasiab y Jafar, 2011), semillas maduras (Nakano y Maeda, 1979; Siriwardana y Nabors, 1983; Orad y Rutger, 1988; Pravin et al., 2011), secciones nodales (Dun-Yi y Krikorian, 1981), hojas (Bhattacharya y Sen, 1980; Wernicke et al., 1981; Afrasiab y Jafar, 2011), coleoptilos (Sahrawat y Chand, 2001; Akter y Al-Forkan, 2010), epicotilos (Khatun y Desamero, 2005), raíces (Kawata y Ishihara, 1968; John y Prathapasenan, 1999), ovarios (Rongbai et al., 1998), proembriones cigóticos (Zhao et al., 1999), polen (Bajaj, 1984; Chowdhury y Mandal, 2001; Lee et al., 2003) y anteras (Lee et al., 2000; Trejo-Tapia et al., 2002). Asimismo estos sistemas regenerativos, se han establecido a partir de protoplastos (Lee et al., 1989; Lee et al., 1999; Tang et al., 2001) y suspensiones celulares (Huang et al., 1995; González-Coronel y Jenes, 2001; Htwe et al., 2011a). Cabe resaltar que es frecuente que las plantas regeneradas a partir de estos sistemas, presenten variaciones somaclonales, referentes a la altura de la planta, el rendimiento de granos, días de floración y el número de tallos entre otros (Sun et al., 1983; Peng y Hodges, 1989; Cha-Um et al., 2010; Joshi et al., 2011)
De estos sistemas de regeneración se han obtenido cultivares tolerantes al estrés salino (Belyanskaya et al., 1994; Saleem et al., 2005; Raveendar et al., 2008; Htwe et al., 2011b) y conjuntamente con técnicas de ingeniería genética (electroporación, biobalística, Agrobacterium tumefaciens o Agrobacterium rhizogenes) se han logrado diversos tipos de plantas transgénicas. Así se han obtenido plantas resistentes a: herbicidas con el gen bar (Repellin et al., 2001; Kawahigashi et al., 2007), a hongos con el gen tlp (Repellin et al., 2001) o chi.1.1 (Maneewan et al., 2005), a insectos como Chilo suppressalis y Scirpophaga incertulas mediante el gen Cry del Bacillus thuringiensis y al estrés hídrico con la incorporación del gen hvA1 (Repellin et al., 2001). Asimismo, se han obtenido plantas transgénicas mediante la incorporación del gen gfp (proteína verde fluorescente) (Carnoso y Yoshida, 2008) y el hgf (factor de crecimiento humano) (Kim et al., 2008). El cultivar transgénico de arroz de mayor importancia actualmente es el arroz de oro, en el cual se transfirió el gen psy (fitoeno sintetasa) que permitió la síntesis de provitamina A (b-caroteno), con lo cual los granos de arroz están enriquecidos de vitamina A, teniendo un mayor nivel alimenticio (Repellin et al., 2001).
Finalmente, debido al incremento de la población a nivel mundial en el siglo XXI, es imperante satisfacer la demanda alimentaría mediante un sistema de agricultura sustentable, y para ello, es importante obtener cultivares resistentes a diversas enfermedades y plagas como en el caso de Pyricularia grisea, así como aumentar el rendimiento y calidad nutricional del grano, por lo cual la utilización de técnicas de cultivo de tejido y/o ingeniería genética, son una manera eficaz de seleccionar variantes a corto plazo y a bajo costo, omitiéndose así los métodos tradicionales de selección de linajes en el campo (Abah et al., 2010). Para el logro de dicho proceso, se hace necesario contar con un eficiente sistema de regeneración in vitro por embriogénesis somática, tal como lo señalan Kamle et al. (2011), aspecto que fue el objetivo de este trabajo, estableciendo el sistema optimo de regeneración in vitro por embriogénesis somática indirecta para 4 variedades venezolanas de arroz (Araure-4, Centauro, Venezuela-21 [resistentes], Cimarrón [susceptible] al hongo Pyricularia grisea), para en un futuro desarrollar un protocolo de selección in vitro de variedades resistentes al devastador hongo P. grisea.
MATERIALES Y MÉTODOS
Se utilizaron como explantes semillas maduras, descascaradas manualmente, de cuatro variedades venezolanas de arroz (Oryza sativa L.): Araure-4, Centauro y Venezuela-21 de alto rendimiento granífero y resistentes al hongo Pyricularia grisea y Cimarrón de menor rendimiento y alta susceptibilidad al hongo ya mencionado (Montoya et al., 2007), suministradas por el INIA-Portuguesa e INIA-Maracay. El protocolo de desinfección se realizó en una cámara de flujo laminar horizontal y consistió en lavar las semillas con agua destilada estéril y jabón líquido (Brisol) durante 15 min. en agitación continua, luego con alcohol isopropílico (70%) por 5 min., seguidamente con cloro comercial (Nevex: 5% hipoclorito de Sodio; sin diluir) mas Tween 20 (2 gotas/10mL) por 30 min., y por último se realizaron 6 cambios (3 min. c/u) con agua destilada estéril. Posteriormente se utilizaron 30 semillas por tratamiento (10 por placa de Petri), sembrándose in vitro, colocando la zona embrional en contacto con el medio, siguiendo un sistema de dos etapas (inducción y regeneración) típico en cereales (Nabors et al., 1983; Vasil, 1987). En la etapa I (4-8 semanas), se indujo la formación del callo, utilizando medios con ácido 2,4-diclorofenoxiacético (2,4-D) sólo o combinado con las citoquininas, 6-Furfuril-aminopurina (K) o 6-Benzil-aminopurina (BA), mientras que la segunda etapa consistió, en regenerar plantas a partir de callos con capacidad regenerativa (embriogénicos) inducidos en la primera fase, remplazándose el 2,4-D por ácido indolacético (AIA), combinado con K o BA.
Los medios de cultivo, presentaron las sales de Murashige y Skoog (1962), 2 mg.L-1 de glicina, 1 mg.L-1 de tiamina-HCl y 0.5 mg.L-1 de piridoxina-HCl (Zhuang y Jia, 1983) Mioinositol 10 mg.L-1 y sacarosa al 3% para los medios de inducción (I: 1-15) y 5% para los medios de regeneración (R: 1-3) (Zaidi et al., 2006). Las hormonas utilizadas para inducción fueron: 2,4-D a 1, 2, 3, 4 y 5 mg.L-1; K o BA a 2 mg.L-1, mientras que para regeneración fue AIA a 0.5 mg.L-1 y K ó BA a 2 mg.L-1. Se ajustó el pH a 5.8, se solidificó con Agar Powder (1,6 %), y se esterilizó a 15 lb y 121°C (15 min). Los cultivos se mantuvieron en oscuridad continua en la fase de inducción, mientras que estuvieron a luz continua y a 30°C. en la etapa de regeneración.
Luego de cada etapa de cultivo, se calcularon las frecuencias de inducción de callo total (T), callo embriogénico (E), callo no embriogénico (NE) y callo rizogénico (R) y la frecuencia de regeneración de plantas, empleando las formulas planteadas por Zaidi et al. (2006) tal como se indican a continuación:
![]()
![]()
![]()
![]()
![]()
![]()
Posteriormente, se realizaron los estudios anatómicos mediante cortes obtenidos con el micrótomo de rotación Leica RM2265 en el Laboratorio de Biotecnología Aplicada (LBA) del Departamento de Biología de la Universidad de Carabobo (Naguanagua-Edo. Carabobo). Muestras de callo fijadas en etanol al 70%, se cortaron mediante un micrótomo de rotación y finalmente los cortes se tiñeron con Orceína (Johansen, 1940). Los registros fotográficos fueron tomados con la lupa Leika DFC 280 y un microscopio de luz Leika DM 1000 en el LBA. Los análisis estadísticos de los procesos de inducción y regeneración, se basaron en la aplicación del modelo lineal aditivo, junto con el Análisis de Varianza (ANOVA) mediante el programa estadístico Statatistic v 17.0.
RESULTADOS Y DISCUSIÓN
Al igual que en otros cereales, en arroz, el sistema por embriogénesis somática indirecta es la vía regenerativa predominante, la cual depende entre otros factores del medio de cultivo y del genotipo, estando éste último relacionado con la potencial expresión de genes recesivos independientes (Lin y Hattori, 1998). Consta de dos fases, una de inducción del callo y otra de regeneración de plantas (Khanna y Raina, 1998), por lo cual, en general los medios de cultivo para la inducción están suplementados con solo 2,4-D, mientras que en los de regeneración se suprime dicha hormona y se utiliza otras auxinas combinados con citoquininas (Bannikova y Barabanova, 1990), o adicionalmente triptofano (Siriwardana y Nabors, 1983), prolina (Chowdhry et al., 1993) o ABA (Peterson y Smith, 1991), favoreciendo la formación de brotes al emplear altas concentraciones de BA en combinación con la auxina ya indicada (Yang et al., 1999).
En este trabajo se evaluó en la etapa de inducción, 15 medios suplementados con 2,4-D sólo o combinado con K o BA, encontrándose diferentes frecuencias de inducción de callos para las 4 variedades de arroz. Las de callo T y callo NE oscilaron de 3-97% y para el callo E se obtuvo de 3-81% (Cuadros 1 y 2). Es de resaltar que el desarrollo del callo E en una gran proporción se evidenció en todos las variedades a las menores concentraciones de la auxina 2,4-D (1-3 mg.L-1) solo o combinado con las citoquininas K o BA. Así para la variedad Araure-4 se halló un 28% de callo E en 3 mg.L-1 de 2,4-D, 66% en el medio con 2,4-D 1 mg.L-1+ K 2 mg.L-1 y 33% en 2,4-D 1 mg.L-1 + BA 2 mg.L-1 (Cuadro 1). Mientras que para Cimarron, se observó un 39% con 2,4-D 1 mg.L-1, 55% en 2,4-D 3 mg.L-1+ K 2 mg.L-1 y 37% en 2,4-D 3 mg.L-1 + BA 2 mg.L-1 (Cuadro 1). En la variedad Centauro, se halló un mayor porcentaje de callo E, en el medio con 2,4-D 2 mg.L-1 + K 2 mg.L-1 (67%) y en 2,4-D 1 mg.L-1 + BA 2 mg.L-1, (68%) (Cuadro 2). Por último en la variedad Venezuela-21 se determinó que los mayores porcentajes de callo E oscilaban entre 78-81%, con una concentración de 1 y 2 mg.L-1 de 2,4-D (Cuadro 2). Estas respuestas presentaron diferencias significativas en la inducción de callo total y de callo embriogénico.
|
Cuadro 1. Frecuencias de inducción de callos en las variedades de arroz (Oryza sativa L.) Araure-4 y Cimarrón.
|
||||||||||
|
M |
Hormonas (mg-L-1) |
Frecuencias |
||||||||
|
2,4-D |
Citoquinina |
Total |
Embriogénico |
No embriogénico |
Rizogénico |
|||||
|
Araure-4 |
Cimarron |
Araure-4 |
Cimarron |
Araure-4 |
Cimarron |
Araure-4 |
Cimarron |
|||
|
I1 |
1 |
- |
50 |
55 |
26 |
39 |
38 |
70 |
28 |
90 |
|
I2 |
2 |
17 |
50 |
10 |
30 |
17 |
80 |
20 |
88 |
|
|
I3 |
3 |
40 |
40 |
28 |
31 |
37 |
30 |
35 |
40 |
|
|
I4 |
4 |
15 |
45 |
19 |
32 |
23 |
26 |
21 |
39 |
|
|
I5 |
5 |
10 |
48 |
5 |
30 |
10 |
37 |
19 |
23 |
|
|
I6 |
1 |
2 K |
80 |
70 |
66 |
35 |
74 |
60 |
34 |
73 |
|
I7 |
2 |
74 |
65 |
54 |
22 |
66 |
52 |
22 |
30 |
|
|
I8 |
3 |
28 |
73 |
34 |
55 |
32 |
65 |
20 |
50 |
|
|
I9 |
4 |
45 |
64 |
33 |
33 |
30 |
70 |
24 |
55 |
|
|
I10 |
5 |
3 |
58 |
3 |
25 |
3 |
56 |
2 |
42 |
|
|
I11 |
1 |
2 BA |
41 |
69 |
33 |
29 |
40 |
68 |
9 |
73 |
|
I12 |
2 |
40 |
80 |
17 |
27 |
38 |
83 |
3 |
53 |
|
|
I13 |
3 |
32 |
70 |
23 |
37 |
35 |
93 |
3 |
87 |
|
|
I14 |
4 |
35 |
50 |
18 |
10 |
10 |
97 |
10 |
60 |
|
|
I15 |
5 |
10 |
56 |
5 |
3 |
5 |
95 |
10 |
60 |
|
|
M: medio de cultivo |
||||||||||
|
Cuadro 2. Frecuencias de inducción de callos en las variedades de arroz (Oryza sativa L.) Venezuela-21 y Centauro.
|
||||||||||
|
M |
Hormonas (mg-L-1) |
Frecuencias |
||||||||
|
2,4-D |
Citoquinina |
Total |
Embriogénico |
No embriogénico |
Rizogénico |
|||||
|
Venez-21 |
Centauro |
Venez-21 |
Centauro |
Venez-21 |
Centauro |
Venez-21 |
Centauro |
|||
|
I1 |
1 |
- |
80 |
85 |
81 |
43 |
80 |
60 |
88 |
42 |
|
I2 |
2 |
90 |
70 |
78 |
51 |
90 |
56 |
89 |
38 |
|
|
I3 |
3 |
60 |
90 |
50 |
56 |
60 |
45 |
68 |
30 |
|
|
I4 |
4 |
70 |
92 |
45 |
30 |
70 |
53 |
65 |
23 |
|
|
I5 |
5 |
70 |
86 |
40 |
22 |
70 |
60 |
64 |
18 |
|
|
I6 |
1 |
2 K |
71 |
70 |
58 |
58 |
65 |
65 |
68 |
68 |
|
I7 |
2 |
80 |
83 |
62 |
67 |
75 |
79 |
37 |
38 |
|
|
I8 |
3 |
62 |
69 |
48 |
47 |
61 |
67 |
62 |
62 |
|
|
I9 |
4 |
63 |
63 |
43 |
46 |
72 |
70 |
52 |
50 |
|
|
I10 |
5 |
71 |
71 |
32 |
30 |
44 |
40 |
33 |
33 |
|
|
I11 |
1 |
2 BA |
82 |
80 |
68 |
68 |
71 |
70 |
68 |
70 |
|
I12 |
2 |
80 |
83 |
43 |
45 |
58 |
60 |
37 |
40 |
|
|
I13 |
3 |
87 |
89 |
15 |
13 |
75 |
74 |
82 |
80 |
|
|
I14 |
4 |
61 |
60 |
22 |
26 |
50 |
54 |
16 |
16 |
|
|
I15 |
5 |
52 |
52 |
20 |
24 |
43 |
42 |
15 |
19 |
|
|
M: medio de cultivo; Venez-21: Venezuela 21 |
||||||||||
Se observa que las combinaciones de 2,4-D con K, son las que inducen el mayor crecimiento de callos. En cuanto a la interacción de la combinación de hormonas con respecto a la concentración de esta auxina, se observó una diferencia significativa en los tratamientos que contienen bajas concentraciones de 2,4-D, combinado con K. Estos resultados coinciden con los reportados por otros investigadores en arroz Indica, que señalan el favorecimiento de la embriogénesis somática a bajas dosis de auxinas (Maeda, 1965; Yamada, 1977), que oscilan entre 1-3 mg. L-1 (Al-khayri et al., 2000; Islam et al., 2005; Niroula et al., 2005; Naqvi et al., 2006; Summart et al., 2008; Hussain et al., 2010; Afrasiab y Jafar, 2011). Igualmente, Endress (1994), señala que el 2,4-D hipermetila el ADN, y es por ello que las células se mantienen en alta actividad mitótica, induciendo la formación de embriones; es así como el proceso embriogénesis, está relacionado con el establecimiento de un balance específico en las hormonas endógenas del explante, tal como lo indican Huang et al.(2012) al encontrar altos niveles endógenos de ABA y AIA solo en callos embriogénicos de arroz, favoreciendo así la elevada frecuencia regenerativa en los mismos.
En este sentido, se observa que la vía regenerativa imperante fue la embriogénesis somática indirecta, dada la formación de múltiples embriones somáticos en el callo embriogénico, ya que las condiciones hormonales establecidas en los medios de cultivo, en particular el balance de auxina-citoquinina, favorece dicho proceso, estando esto en concordancia con el planteamiento de Yoshida et al. (1994) y Joyia y Khan (2012), quienes indican que el control morfogénico de la regeneración está ligado al nivel y combinación de reguladores de crecimiento, así cuando el nivel de citoquinina es 10-50 veces mayor al de la auxina predomina la organogénesis, mientras que si el nivel de auxina es hasta 10 veces mayor que el de citoquinina prospera la embriogénesis somática. Asimismo, estos resultados reafirmaron que el proceso de embriogénesis somática está relacionado no solo con la presencia de 2,4-D, sino con la combinación de esta auxina con las citoquininas K o BA, tal como lo señalan numerosos investigadores en cultivo in vitro de arroz (Wenzhong et al., 1994; Khatun et al., 2003; Abayawickrama y Anai, 2006; Beena 2006; Ullah et al., 2007; Hussain et al., 2010; Sahsavari, 2010; Rafique et al., 2011). A su vez esta respuesta fue diferencial en cuanto a la formación del callo, ya que depende de la combinación y la concentración de hormonas en función del cultivar, tal como lo han descrito Carnoso y Yoshida (2006), Ge et al. (2006) y Htwe et al. (2011b).
Con respecto a la formación de callos, estos se desarrollaron de la zona embrional de la semilla, específicamente del escutelo, diferenciándose múltiples masas pro embriogénicas que dan origen posteriormente a los embriones, tal como lo indica Mariani et al. (2002). Los tipos de callo encontrados en este estudio fueron No Embriogénicos (NE) y Embriogénicos (E), distinguiéndose también callos organogénicos: Rizogénicos (R) y caulogénicos o con brotes (Br), así como las combinaciones de los mismos (Figura 1a-m). Estos callos ya han sido descritos ampliamente en cereales (Nabors et al., 1983; Vasil, 1987). Estas diferentes combinaciones de callos, representan una amplia heterogeneidad morfológica, que puede estar relacionada con la capacidad regenerativa, tal como señalo Kucherenko (1993) al caracterizar 33 tipos distintos de callos de Oryza sativa.

Los callos NE, eran friables y de color amarillo, la mayoría de estos callos estaban acompañados por callos E, observándose callos mixtos (Figura 1a), anatómicamente su superficie estaba constituida por células pequeñas de forma alargada, irregular y de citoplasma pobre (Figura 2a). Los callos E, encontrados fueron compactos, de apariencia globular, con una coloración blanco-crema, estos presentaron una superficie brillante y lisa (Figura 1b y 1c). Los estudios histológicos, permitieron distinguir células pequeñas de forma isodiamétrica, densas en citoplasma, núcleo prominente y gran cantidad de gránulos de almidón, a partir de las cuales se diferenciaron embriones en diferentes etapas de desarrollo, ya sea de una masa proembriogénica (Figura 2d) de origen multicelular, donde se observó una epidermis uniestratificada (Figura 2e) o de centros meristemáticos (Figura 2f) de donde se diferenciaban embriones somáticos aislados de tipo globular (Figura 2g y 2h) o de mayor desarrollo con suspensor (Figura 2i y 2j), revelando así su origen unicelular. De igual manera, se pudo observar la formación de embriones fusionados conformando un cuerpo multiembriogénico, lo cual nos indica la posibilidad de un origen multicelular de los embriones (Figura 2k). En cereales, incluyendo el arroz se plantea que el origen de los embriones es unicelular, no obstante, no se descarta que se presente simultáneamente el origen multicelular de los mismos, tal como lo describimos en este trabajo. En este orden de ideas, este aspecto es ampliamente descrito por Willians y Maheswaran (1986) y Quiroz-Figueroa et al. (2006), donde plantean que en general se distinguen los embriones de origen unicelular, por verse unidos al tejido parental por un pie, mientras en los de origen multicelular, los embriones no están unidos por un pie a la masa de callo, sino a través de cuerpos de múltiples embriones fusionados.
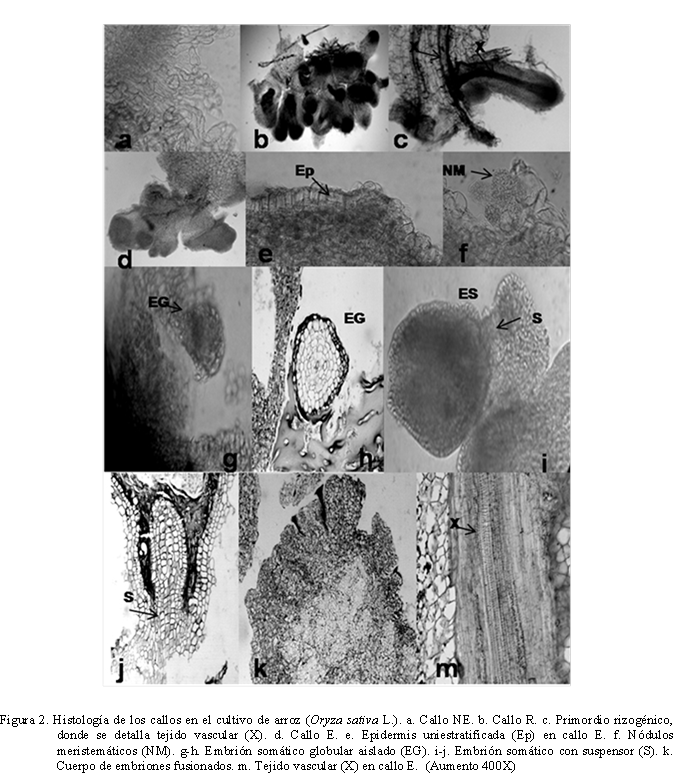
Los callos R, exhibieron una apariencia compacta y sus colores variaban desde blancos, amarillos hasta marrones claros, cuya superficie estaba conformada por alargadas raíces cubiertas totalmente con pelos radiculares (Figura 1d), observándose un agrupamiento de primordios radiculares (Figura 2b), formados por células irregulares, distinguiéndose además la conexión vascular con el tejido parental (Figura 2c), a través de vasos xilemáticos de engrosamientos reticulares en sus paredes, así como también la formación de traqueídas (Figura 2m).
Dependiendo del genotipo de arroz, variará el potencial y grado de desarrollo del callo en sus distintos tipos, lo cual es importante a la hora de considerarlo para su selección tanto en los programas de mejoramiento genético convencional como por cultivo de tejidos e ingeniería genética, particularmente el callo embriogénico que es el que tiene el potencial regenerativo, fundamentalmente por presentar zonas meristematicas, cuyas células se caracterizan por ser pequeñas, densas en citoplasma, de núcleo prominente y de gran cantidad de gránulos de almidón. Así tenemos que Narciso y Hattori (2010) caracterizan la morfología y la ultraestructura de callos derivados de las tres subespecies de arroz (Indica, Javánica, Japónica,). El callo del arroz Indica es amarillo, compacto y de superficie lisa o amarillento de estructuras parecidas a pelos radiculares en su superficie y pocas estructuras de forma de domo de color verde, cuyas células meristemáticas se encuentran en la parte interior de la masa del callo, mientras que el callo de Javánica es amarillento, compacto de superficie lisa, con células meristemáticas tanto el parte externa como interna del callo y por último el callo Japónica es parecido al Javánica. .pero con apariencia granular, ubicándose en la periferia del callo las células meristemáticas. No obstante, en nuestros estudios histológicos se determinó que en las variedades Indica de arroz venezolanas estudiadas, las zonas meristemáticas se encontraron en la parte periférica del callo embriogénico tal como lo señalan Vega et al. (2009).
Con respecto a la etapa regenerativa, al evaluar los resultados de tres medios de regeneración, también se encontró una respuesta diferencial en función de la variedad, evidenciándose la diferenciación de plantas entre 13-38%. También se observó que la mayor frecuencia regenerativa fue en R3 (AIA 0.5 mg.L-1+ BA 2 mg.L-1) para todas las variedades: 30% en Araure-4, 31% para Cimarron, 35% para Venezuela-21 y 38% para Centauro (Cuadro 3). Estos resultados concuerdan con los obtenidos por diversos investigadores, que evidencian altas frecuencias de regeneración en variedades de arroz Indica, al emplear medios suplementados con citoquininas como la cinetina (K) o la bencil-aminopurina (BA), en particular con la última ya que con ésta se observo una mayor diferenciación de plantas, corroborando lo descrito por otros investigadores (Jan et al., 2001; Belal et al., 2006; Kabir et al., 2008; Tariq et al., 2008).
|
Cuadro 3. Frecuencias de regeneración de plantas en las variedades de arroz (Oryza sativa L.) Araure-4, Cimarron, Venezuela-21 y Centauro.
|
||||||
|
M |
Hormonas (mg.L-1) |
Frecuencias |
||||
|
AIA |
Citoquinina |
Araure-4 |
Cimarrón |
Venezuela-21 |
Centauro |
|
|
R1 |
- |
- |
2 |
3 |
2 |
4 |
|
R2 |
0,5 |
2 K |
27 |
29 |
13 |
31 |
|
R3 |
0,5 |
2 BA |
30 |
31 |
35 |
38 |
|
M: medio de cultivo |
||||||
A partir de las dos semanas de subcultivo en el medio regenerativo respectivo, se evidenciaron cambios morfológicos en los callos, observándose la germinación de los embriones somáticos al visualizar los vástagos o ápices de los mismos, los cuales de blanco crema (Figura 3a) se tornaron a verde (Figura 3b); luego de 3 semanas se observaron estructuras completas con múltiples hojas y raíces con abundantes pelos radiculares (Figura 3c y 3d), aisladas (Figura 3e) o en grupos (Figura 3f), teniendo finalmente a las 4 semanas 100% de plántulas ya sea de manera individual (Figura 3g) o formando macollas (Figura 3h). Por lo tanto, el sistema de regeneración establecido en este trabajo fue eficaz para variedades Indica venezolanas, tal como lo describieron para variedades de otros países, Saharan et al. (2004), Hussain et al., (2010) y Afrasiab y Jafar (2011) entre números investigadores.

CONCLUSIONES
La respuesta encontrada tanto en la etapa de inducción como de regeneración dependió del genotipo, ya que las variedades estudiadas presentaron de manera significativa diferentes frecuencias de inducción de callo y de diferenciación de plantas en función de los medios de cultivo ensayados.
De las cuatro variedades evaluadas, solo Centauro y Venezuela-21, presentaron los mayores porcentajes en el desarrollo de callo embriogénico, empleando medios de inducción con 2 mg.L-1 de 2,4-D más 2 mg.L-1 de BA o K.
El mejor medio de regeneración fue el R3 (0.5 mg.L-1 de AIA y 2 mg.L-1 BA), ya que favoreció la mayor frecuencia regenerativa, en todas las variedades venezolanas arroz que se ensayaron in vitro.
Se corroboró que bajo las condiciones establecidas en este trabajo, la regeneración de plantas fue por embriogénesis somática indirecta.
AGRADECIMIENTOS
AL INIA-Portuguesa e INIA-Maracay por el suministro de las semillas de arroz de las variedades empleadas en este trabajo. Asimismo al personal asistente del Laboratorio de Biotecnología Aplicada (LBA) del Departamento de Biología de la Universidad de Carabobo (Naguanagua, estado Carabobo) por el apoyo en el estudio morfológico y anatómico en esta investigación.
LITERATURA CITADA
Abah, J.; M. N. Ishaq and A. C. Wada. 2010. The role of biotechnology in ensuring food security and sustainable agriculture. African J. Biotec. 9 (52): 8896-8900
Abayawickrama, A. S. and T. Anai. 2006. Comparison of regeneration efficiency of different genotypes of indica rice cultivars. Bull. Fac. Agr. Saga. Univ. 92: 17-23
Abreu, E.; A. Gutiérrez, H. Fontana, R. Cartay, L. E. Molina, A Kesteren y M. Guillory. 1993. La Agricultura. Componente básico del sistema alimentario venezolano. Fundación Polar. Caracas-Venezuela. p. 500.
Afrasiab, H. and R. Jafar. 2011. Efect of different media and solidifying agents on callogenesis and plant regeneration from different explants of rice (Oryza sativa L.) varieties Super basmati and Irri-6. Pak. J. Bot. 43 (1): 487-501.
Al-Khayri, J. and A. Al-Bahrany. 2000. in vitro plant regeneration of Hassawi rice (Oryza sativa L.) from mature embryo-derived callus. Pak. J. Biol Sci. 3 (4): 602-605.
Akter, P. and M. Al-Forkan. 2010. Assessment of somatic embryogenesis and plant regeneration potentiality from coleoptiles and root tissues of jhum rice (Oryza sativa L.). Indian J. Agric. Res. 44 (2): 88-95.
Bajaj, Y. P. 1984. The regeneration of plants from frozen pollen embryos and zygotic embryos of wheat and rice. Theor. Appl. Genet. 67: 525-528.
Bannikova, V. P. and E. A. Barabanova. 1990. Induction and histological characteristics of somatic embryogenesis in cereal tissue cultures. Tsitologiya i Genetika 24 (2): 61-68.
Beena, C. 2006. Genetic effect on the regeneration of the calli of rice. Indian J. Crop Sci. 1 (1-2): 207-208.
Belal, M.; H. Sikder, P. K. Sen, M. A. Manun, M. R. Ali and S. M. Rahman. 2006. in vitro regeneration of aromatic rice (Oryza sativa L.). Int. J. Agric. Biol. 8 (6): 759-762.
Belyanskaya, S. L.; Z. B. Shamina and L. A. Kucherenko. 1994. Morphological in stress-resistant rice clones. Russian J. of Plant Physiol. 41 (4): 503-506.
Bhattacharya, P. and S. K. Sen. 1980. Potentiality of leaf sheath cells for regeneration of rice. Theor. Appl. Genet. 58: 87-90.
Carnoso, N. and T. Yoshida. 2006. Identification of callus induction potencial of 15 indonesian rice genotypes. Plant. Prod. Sci. 9 (1): 65-70 .
Carnoso, N. and T. Yoshida. 2008. Transient expression or green fluorescent protein in rice calluses: optimization of parameters for helios gene gun device. Plant Prod. Sci. 11 (1): 88-95.
Cha-Um, S.; N. T. Nhung and C. Kirdmanee. 2010. Effect of manitol and salt-induced iso-osmotic stress on proline accumulation, photosynthetic abilities and growth characters of rice cultivars (Oryza sativa L.spp. indica). Pak. J. Bot. 42 (2): 927-941.
Chowdrury, B. and A. B. Mandal. 2001. Microspore embryogenesis and fertile plantlet regeneration in a salt susceptible x salt tolerant rice hybrid. Plan Cell Tiss. and Org. Cult. 65: 141-147.
Cosgrovel, D. J. 1997. Relaxation in a high-stress environment: The molecular basis of extensible cell walls and cell enlargement. The Plant Cell. (9) 1031-1041.
Desarollos Agrícolas Naranjal Asociación Civil (DANAC). 2004. Fundación para la Investigación Agrícola. Disponible en: http://www.danac.org.ve. Consulta: 31 de Octubre de 2004.
Dun-Yi, Y. and A. D. Krikorian. 1981. Multiplication of rice (Oryza sativa L.) from aseptically cultured nodes. Ann. Bot. 48:255-259.
Endress, R. 1994. Plant Cell Biotechnology. Springer- Verlag. Berlin, Alemania. 353 p.
Ge, X. ; Z. Chu and Y. Lin. 2006. A tissue culture system for different germplasm of indica rice. Plant Cell Rep. 25: 392-402.
González Coronel, A. S. and B. Jenes. 2001. Evaluation of a plant regeneration test of embryogenic cell suspension cultures of rice (Oryza sativa L. cv. Taipei 309). Plant Sci. 60: 658-666.
Grewal, D.; R. Gill. and S. S. Gosal. 2005. Factors enhancing induction of high frequency plant regeneration from somatic embryos of indica rice (Oryza sativa L.). J. Biol. Sci. 5 (6): 697-702.
Heyser, J. W.; T. A. Dykes, K. J. DeMott and M. W. Nabors. 1983. High frequency long term regeneration of rice from callus culture. Plant Sci. Lett. 29: 175-182.
Hill, A. 1965. Botánica económica. Plantas útiles y productos vegetales. Ediciones Omega, Barcelona-España. p. 616.
Htwe, N. N.; M. Maziah, H. C. Ling, F. Q. Zaman and A. M. Zain. 2011a. Regeneration capacity of cell suspension culture in Malaysian rice genotypes under salinity stress. Asian J. Biotec. 3 (4): 357-367.
Htwe, N. N.; M. Maziah, H. C, Ling, F. Q. Zaman and A. M. Zain. 2011b. Responses of some selected Malaysian rice genotypes to callus induction under in vitro salt stress. African J. Biotec. 10 (3): 350-362.
Huang, W. L.; C. H. Lee and Y. R. Chen. 2012. Levels of endogenous abscisic acid and indole-3-acetic acid influence shoot organogenesis in callus cultures of rice subjected to osmotic stress. Plant Cell Tiss. and Organ Cult. 108 (2): 257-263.
Huang, W. L. and L. F. Liu. 2002. Carbohydrate metabolism in rice during callus induction and shoot regeneration induced by osmotic stress. Bot. Bull. Acad. Sin. 43: 107-113.
Huang, C. N.; J. H. Wang, Q. S. Yan, X. Q. Zhang and Q. F. Yan. 1995. Plant regeneration from rice (Oryza sativa L.) embryogenic suspensión cells cryopreserved by vitrification. Plan Cell Rep. 14:730-734.
Hussain, Z.; M. Khan, R. Bano, H. Rashid and Z. Chaudhry. 2010. Protocol optimization for efficient callus induction and regeneration in three Pakistani rice cultivars. Pak. J. Bot. 42 (2): 879-887.
Instituto Nacional de Investigaciones Agrícola (INIA). 2004. El cultivo del arroz en Venezuela. Serie manuales de cultivo Inia Nº1. Ministerio de Ciencia y Tecnología, Instituto Nacional de Investigaciones Agrícolas, Maracay-Venezuela. p 202.
Islam, M. M.; M. Ahmed and D. Mahaldar. 2005. in vitro callus induction and plant regeneration in seed explants of rice (Oryza sativa L.). Res. J. Agric. and Biol. Sci. 1 (1): 72-75.
Jan, A.; Q. M. Hassan, T. Fatima and T. Hasnai. 2001. Tissue culture response of local varieties of rice (Oryza sativa L.) of NWFP. Journal Biological Sciencies 1: 387-390.
Johansen, D. A. 1940. Plant microtechnique. McGraw-Will Publish. Bombay-New Delhi-India. pp 523.
John, A. and G. Prathapasenan. 1999. High frequency plantlet regeneration from root explants of rice (Oryza sativa L.) var. CSR-10. Phytomorphology 49 (2): 165-169.
Joshi, R.; A. Shukla and R. Sairam. 2011. in vitro screening of rice genotypes for drought tolerance using polyethylene glycol. Acta Physiol Plant 33 (6): 2209-2217.
Joyia, F. A. and M. S. Khan. 2012. Reproducible and expedient rice regeneration system using in vitro grown plants. African J. Biotec. 11 (1): 138-144.
Kabir, A. H.; I. Mahfuz, M. A. Razvy, M. B. Ahmed and M. F. Alam. 2008. Indirect organogenesis and somaclonal in four rice cultivars of Bangladesh. J. App. Sci. Res. 4 (4): 451-458.
Kamle, M.; A. Bajpain, R. Chandra and S. Kalim. 2011. Somatic embryogenesis for crop improvement. GERF Bulletin of Biosciences 2 (1): 54-59.
Kawahigashi, H.; S. Hirose, H. Ohkawa and Y. Ohkawa. 2007. Herbicide resistance of transgenic rice plants expressing human CYP1A1. Biotecnology Adv. 25: 75-84.
Kawata, S. and A. Ishihara. 1968. The regeneration of rice plant, Oryza sativa L., in the callus derived from the seminal root. Proc. Japan Acad. 44 (6): 549-553.
Khanna, H. K. and S. K. Raina. 1998. Genotype x culture media interaction affects on regeneration response of three indica rice cultivars. Plan Cell Tiss. and Org. Cult. 52: 145-153.
Khatun, M. M.; M. H. Ali and N. V. Desamero. 2003. Effect of genotype and culture media on callus formation and plant regeneration from mature seed scutella culture in rice. Plant Tissue Cult. 13 (2): 99-107.
Khatun, M. M. and N. V. Desamero. 2005. Callus induction and plant regeneration from rice epicotyl. Plant Tissue Cult. 15 (1): 51-56.
Kim, T. G.; M. Y. Baek, E. K. Lee, T. H. Kwon and M. S. Yang. 2008. Expression of human growth hormone in transgenic rice cell suspension culture. Plan Cell Rep. 27: 885-89.
Kranz, J.; H. Schmutterer and W. Koch. 1978. Diseases pests and weeds in tropical crops. John Wiley and Sons, Chichester Great Britain. p. 670.
Kucherenko, L. A. 1993. Morphological heterogenety in rice callus tissues and their regenerative capacity. Russian J. Plant Physiol. 40 (5): 797-801.
Lai, K. and L. Liu. 1988. Increased plant regeneration frequency in water-stressed rice tissue cultures. Japan J. Crop Sci. 57 (3): 553-557.
Lee, S. Y.; J. H. Lee and T. O. Kwon. 2003. Selection of Salt-tolerant doubled in rice anther culture. Plan Cell Tiss. and Org. Cult. 74: 143-149.
Lee, H. J.; J. R. Seebauer and F. E. Below. 2000. An improved technique for culture of rice panicles. Plan Cell Tiss. and Org. Cult. 60: 55-60.
Lee, L.; R. E Schroll, H. D. Grimes and T. K. Hodges. 1989. Plant regeneration from indica rice (Oryza sativa L.) protoplasts. Planta 178: 325-333.
Lee, S.; Y. Shon, C. Kim, H. Chun, Y. Cheong, Z. Kim, Z. Choe, Y. Choi and M. Cho. 1999. Variations in the morphology of rice plants regenerated from protoplasts using different culture procedures. Plan Cell Tiss. and Org. Cult. 57: 179-187.
Lin, Z. and K. Hattori. 1998. Inheritance of high shoot regeneration ability from seed callus in a rice cultivar joshu. Breeding Sci. 48: 41-44.
Maeda, E. 1965. Callus Formation and Isolation of Single Cells from Rice Seedlings. Japanese Journal of Crop Science 34 (2): 139-147.
Maneewan, K.; S. Bunnag, P. Theerakulpisut, M. Kosittrakun and A. Suwanagul. 2005. Transformation of rice (Oryza sativa L.) cv. Chainat 1 using chitinase gene. Songklanakarin J. Sci. Technol. 27 (6): 1151-1162.
Mariani, T. S.; H. Miyake and Y. Takeoka. 2002. Direct somatic embryogenesis in rice (Oryza sativa L.): structural and developmental patterns. J. Matematika dan Sains 7 (2): 53-56.
Montoya, M.; N. Rodríguez, I. Pérez Almeida, J. Cova y L. Alemán. 2007. Caracterización morfológica de 13 variedades de arroz venezolanas. Agronomía Trop. 57 (4): 299-311.
Murashige, T. and F. Skoog. 1962. A revised medium for rapid growth and bioassays with tobaco tissue culture. Plant Physiol. 15: 473-497.
Nabors, M. W.; J. W. Heyser, T. A. Dykes and K. J. Demott. 1983. Long-duration, high-frecuency plant regeneration from cereal tissue cultures. Planta 157: 385-391.
Narciso, J. O. and K. Hattori. 2010. Genotypic differences in morphology and ultrastructures of callus derived from selected rice varieties. Philippine Sci. Lett. 3 (1): 59-65.
Nakano, H. and E. Maeda. 1979. Shoot differentiation in callus of Oryza sativa L. Z. Pflanzenphysiol. B.D. 93: 449-458.
Naqvi, S. S.; T. Sultana, T. Yasmin, T. Mahmood and S. Akhtar. 2006. Efficient embryogenic system from tissue culture of mature embryos for some coarse varieties of rice (Oryza sativa L.). Pak. J. Bot. 38 (4): 969-975.
Niroula, R. K.; B. P. Sah, H. P. Bimb and S. Nayak. 2005. Effect of genotype and culture media on callus induction and plant regeneration from matured rice grain culture. J. Inst. Agric. Anim. Sci. 26: 21-26.
Oard, J. H. and J. N. Rutger. 1988. Callus induction and plant regeneration in elite U.S. rice lines. Crop Sci. 25: 565-567.
Ozawa, K. and A. Komamine. 1989. Establishment of a system of high-frequency embryogenesis from long-term cell suspension cultures of rice (Oryza sativa L.). Theor. Appl. Genet. 77: 205-211.
Peng, J. and T. Hodges. 1989. Genetic analysis of plant regeneration in rice (Oryza sativa L.). In Vitro Cell. and Dev. Biol. 25 (1): 91-94.
Peterson, G. and R. Smith. 1991. Effect of abscisic and callus size on regeneration of American and international rice varieties. Plant Cell Report 10: 35-38.
Pravin, J.; M. Dudhare, T. Saluja, A. Sarawgi, R, Saxena and C. Girish. 2011. Assessment of critical factors influencing callus induction, in vitro regeneration and selection of bombarded indica rice genotypes. J. Agric. Biotech. and Sustainable Dev. 3 (3): 44-59.
Quiroz Figueroa, F. R.; R. Rojas Herrera, R. M. Galaz Avalos and V. M. Loyola Vargas. 2006. Embryo production through somatic embryogenesis can be used to study cell differentiation in plants. Plant Cell Tiss. Organ Cult. 86: 285-301.
Raemakers, C. J.; E. Jacobsen and R. G. Visser. 1995. Secondary somatic embryogenesis and applications in plant breeding. Euphytica 81: 93-107.
Rafique, M.; H. Rashhid, M. Chaudhary, Z. Chaudhry and N. Cheema. 2011. Study on callogenesis and organogenesis in local cultivars of rice (Oryza sativa L.). Pak. J. Bot. 43 (1): 191-203.
Raveendar, S.; A. Premkumar, S. Ignacimuthu and P. Agastian. 2008. Effect of sea water on callus induction and regeneration of rice genotypes. Int. J. Integrative Biol. 3 (2): 92-95.
Repellin, A.; M. Baga, P. P. Jauhar and R. N. Chibbar. 2001. Genetic enrichement of cereal crops via alien gene transfer: New challenges. Plan Cell Tiss. and Org. Cult. 64: 159-183.
Rongbai, L.; M. P. Pandey, G. K. Garg, S. K. Pandey, D. K. Dwivedi and A. Ashima. 1998. Development of a technique for in vitro unpollinated ovary culture in rice, Oryza sativa L. Euphytica 104: 159-166.
Rubi, J.; P. Carbonero and I. Díaz. 1999. Parameters influencing the regeneration capacity of calluses derived from mature indica and japonica seeds after microprojectile bombardment. Euphytica 107: 115-122.
Rueb, S.; M. Leneman, R A. Schilperoort and L A. Hensgens. 1994. Efficient plant regeneration through somatic embryogenesis from callus induced on mature rice embryos (Oryza sativa L.). Plan Cell Tiss. and Org. Cult. 36: 259-264.
Saharan, V.; R. C. Yadav, N. R. Yadav and B. P. Chapagain. 2004. High frequency plant regeneration from desiccated calli of indica rice (Oryza Sativa L.) African Journal of Biotechnology 3 (5): 256-259.
Sahrawat, A. K. and S. Chand. 2001. High-frequency plant regeneration from coleoptile tissue of indica rice (Oryza sativa L.). In Vitro Cell and Dev. Biol. Plant 37: 55-61.
Saleem, M. Y.; Z. Mukhtar, A. A. Cheema and B. M. Atta. 2005. Induced mutation and in vitro tecniques as a method to induce salt tolerance in Basmati rice (Oryza sativa L.). Int. J. Environ. Sci. Tech. 2 (2): 141-145.
Shahsavari, E. 2010. Evaluation and optimization of media on the tissue culture system of Upland Rice. Int. J. Agric. Biol. 12: 537-540.
Siriwardana, S. and M. W. Nabors. 1983. Tryptophan enhancement of somatic embryogenesis in rice. Plant Physiol. 73: 142-146.
Summart, J.; S. Panichajakul, P. Prathepha and P. Thanonkeo. 2008. Callus induction and influence of culture condition and culture medium on growth of Thai aromatic rice, khao dawk mali 105, cell culture. World App. Sci. J. 5 (2): 246-251.
Tang, K.; X. Sun, D. An, J. B. Powe, E. C. Cocking and M. R. Davey. 2001. A simple and rapid procedure to establish embryogenic cell suspensions as a source of protoplasts for efficient plant regeneration from two Chinese commercial rice cultivars. Plan Cell Tiss. and Org. Cult. 66: 149-153.
Tariq, M.; G. Ali, F. Hadi, S. Ahmad, N. Ali. and A. Shah. 2008. Callus induction and in vitro plant regeneration of rice (Oryza sativa L.) under various conditions. Pak. J. Biol. Sci. 11 (2): 255-259.
Trejo Tapia, G.; U. M. Amaya, G. S. Morales, A. Sánchez, B. M. Bonfil, M. Rodríguez Monro and A. Jiménez Aparicio. 2002. The effects of a cold-pretreatment, auxins and carbon source an anther culture of rice. Plan Cell Tiss. and Org. Cult. 71: 41-46.
Ullah, H.; I. Ullah, S. Jadoon and H. Rashid. 2007. Tissue culture techniques for callus induction in rice. Sarhad. J. Agric. 23 (1): 81-86.
Uno, G.; R. Storey and A. Moore. 2001. Principles of Botany. Mc Graw Hill. USA. p 552.
Vasil, I. K. 1987. Developing cell and tissue culture systems for the improvement of cereal and grass crops. J. Plant Physiol. 128: 193-218.
Vega, R.; N. Vásquez, A. M. Espinoza, A. Gatica and M. Valdez Melara. 2009. Histology of somatic embryogenesis in rice (Oryza sativa cv. 5272). Rev. Biol. Trop. (Int. J. Trop. Biol) 57 (1): 141-150.
Wernicke, W.; R. Brettel, T. Warizuka and I. Potrykus. 1981. Adventitius embryoid and root formation from rice leaves. Z. Pflanzenphysiol. B.D. 103: 361-365.
Wenzhong, T.; I. Rance and E. Sivamani. 1994. Improvement of plant regeneration frequency in vitro in indica rice. Chinese J. Genetics 21 (3): 1-9.
Williams, E. G. and G. Maheswaran. 1986. Somatic embryogenesis: Factors influencing coordinated behaviour of cells as an embryogenic group. Ann. Bot. 57: 443-462.
Yamada, Y. 1977. Tissue culture studies on cereals. Applied and Fundamental Aspects of Plant Cell, Tissue, and Organ Culture. Springer-Verlag, New York. p: 146-159.
Yang, Y. S.; Y. D. Zheng, Y. L. Chen and Y. Y. Jian. 1999. Improvement of plant regeneration from long-term cultured calluses of Taipei 309, a model rice variety in in vitro studies. Plan Cell Tiss. and Org. Cult. 57: 199-206.
Yoshida, K. T.; S. Fujii, M. Sakata, and G. Takeda. 1994. Control of organogénesis and embryogenesis in rice calli. Breeding Sci. 44: 355-360.
Yoshida, S.; K. Watanabe and M. Fujino. 1998. Non-random gametoclonal variation in rice regenerants from callus subcultured for a prolonged period under high osmotic stress. Euphytica 104: 87-94.
Zaidi, M. A.; M. Narayanan, R. Sardana, I Taga, S. Postel, R. Johns, M. McNulty, J. Mao, E. Loit and I. Altosar. 2006. Optimizing tissue culture media for efficient transformation of different indica rice genotypes. Agronomy Research 4 (2): 563-575.
Zhao, J.; C. Zhou and H. Y. Yang. 1999. in vitro developmental of early proembryos and plant regeneration via microculture in Oryza sativa. Plan Cell Tiss. and Organ Cult. 55: 167-174.
Sun, Z.; C. Zhao, K. Zheng, Z. Qi and Y. Fu. 1983. Somaclonal genetics of rice, Oryza sativa L. Theor. Appl. Genet. 67:67-73
Zhuang, J. J. and X. Jia. 1983. Increesing differentiation frequencies in Wheat pollen callus. In: Cell And Tissue culture techniques for cereal crop improvement. Proceedings of a workshop. Responsores by Institute of Genetic Academic Sinica. Science Press. p. 453-459.
Página diseñada por Prof. Jesús Rafael Méndez Natera
TABLA DE CONTENIDO DE LA REVISTA CIENTÍFICA UDO AGRÍCOLA
 |
|||||
 |
|||||
 |
|||||
