Revista Científica UDO Agrícola Volumen 12. Número 1. Año
2012. Páginas: 69-73
Meiosis en Cydista aequinoctialis (L.) Miers. (Bignoniaceae)
Meiosis in Cydista aequinoctialis
(L.) Miers. (Bignoniaceae)
Nilda ALCORCÉS
Laboratorio
de Citogenética. Universidad de Oriente. Núcleo de Monagas. Postgrado en Agricultura
Tropical. Campus Juanico, Maturín, Monagas, Venezuela. E-mails:
nildafel@gmail.com y nildafel@cantv.net
|
Recibido: 22/06/2010 |
Fin de primer arbitraje:
31/01/2012 |
Primera revisión recibida: 10/02/2012 |
|
Fin de segundo arbitraje: 23/03/2012 |
Segunda revisión recibida: 17/04/2012 |
Aceptado: 24/04/2012 |
RESUMEN
El género Cydista Miers.,
pertenece a la familia Bignoniaceae e incluye 14
especies y (3) variedades correspondientes a C. aequinoctialis var.
aequinoctialis,
var. hirtella y var.
sarmentosa. En la familia Bignoniaceae
hay una alta diversidad en las
características del polen, encontrándose que el más frecuente que se presenta
es del tipo tricolpado, monocolpado,
inaperturado y cuatro a cinco colpado.
El número cromosómico básico de casi todas las tribus es x=20 y las especies
estudiadas Tabebuia chrysantha, T. capitata,
T. ochracea subespecies neochrysantha
y ochracea y
T. aquatilis son diploides (2n=40). De C. aequinoctialis
solo se conoce su número cromosómico. La presente investigación pretendió
corroborar el número cromosómico y aportar más información acerca de su
citogenética. En
meiosis I, profase y metafase, se observaron células normales y anomalías meióticas como cromosomas rezagados y no alineados en
anafase y telofase. En la meiosis II se observó tétradas tetragonales y
anomalías en telofase II, polen tricolpado con
escultura reticulada, de forma circular a elíptica, tamaño 3,64 ± 0,19 µm para
los circulares y de 3,71 ± 0,22 µm a 3,55 ± 0,21 µm para los elípticos, éstos
últimos en mayor porcentaje. El alto porcentaje de células con anomalías
cromosómicas detectadas, podría ser una de las causas de la escasa producción
de semillas en los frutos. Se concluye que el número cromosómico haploide de la
especie es n=20.
Palabras
clave:
Cydista,
meiosis, anomalías
ABSTRACT
The genus Cydista Miers., belongs to the Bignoniaceae
family and includes 14 species and three varieties corresponding to C. aequinoctialis
var. aequinoctialis,
var. hirtella
and var. sarmentosa.
In the Bignoniaceae family there is a high diversity
in the pollen characteristics, the most frequent type is the tricolpate, monocolpates, inaperturate and four to five colpate.
Basic chromosome number of most tribes is x=20 and the species studied Tabebuia chrysantha, T. capitata, T. ochracea subespecies neochrysantha and
ochracea and
T. aquatilis are diploid (2n=40). Chromosome number of C. aequinoctialis
is known. This research was carried out to confirm the chromosome number and to
provide more information about their cytogenetic. In meiosis I, prophase and
metaphase, normal cells were observed and anaphase and telophase,
meiotic abnormalities as lagged and non-aligned chromosomes were observed. In
meiosis II, tetragonal tetrads and anomalies were observed in telophase II, tricolpate pollen
with reticulate sculpture, circular to elliptical form, size 3.64 ± 0.19 μm for circular ones and 3.71 ± 0.22 to 3.55 ± 0.21 μm for the elliptical ones, the latter at a higher percentage. The high rate
of cells with chromosome anomalies could be one of causes of the low seed
production in the fruits. It was concluded that the haploid chromosome number
is n=20.
Key words: Cydista, meiosis, anomalies
INTRODUCCIÓN
El género Cydista Miers.,
ubicado en la familia Bignoniaceae, comprende 14
especies y 3 variedades, éstas se ubican dentro de Cydista aequinoctialis, y corresponden a las
variedades aequinoctialis, hirtella y sarmentosa. (MBG 2009).
Dentro de
la familia Bignoniaceae,
hay una alta diversidad en las
características del polen (Buurman, 1978; Gentry y Tomb., 1979; Gentry, 1980). El rango de apertura más frecuente que se presentan son del tipo tricolpado,
monocolpado, inaperturado y
de cuatro a cinco colpado (Fisher et
al., 2004). Aunque la morfología del polen puede ser importante para la
delimitación genérica, no debe ser usado como carácter diagnóstico entre las
tribus (Gentry 1980).
Goldblatt y Gentry
(1979) y Piazzano (1998) plantean que el número cromosómico
básico de casi todas las tribus es x=20 y que muchas especies estudiadas son
diploides (2n=40). Sin embargo, hay excepciones que incluyen Incarvillea con 2n=22; Millingtonia 2n=30; Jacaranda, Tecoma,
Mansoa 2n=36; Spathodea 2n=38 y Macfadiena 2n=80 (Fisher et al., 2004). Gentry
(1980) sugiere aneuploidia inicial por pérdida de un cromosoma a partir de
una población ancestral hexaploide de x=7.
La importancia de la
meiosis en las plantas ayuda a visualizar los posibles problemas en cuanto a la
baja fructificación y al bajo porcentaje de germinación de las semillas. Los individuos de esta especie que
fueron analizados, presentaron muy baja producción de semillas, esto fue uno de
los aspectos que determinaron la realización de este trabajo.
Con la presente
investigación, se pretende corroborar el número cromosómico y aportar más
información acerca de su citogenética.
MATERIALES
Y MÉTODOS
Se usaron botones
florales de C. aequinoctialys, colectadas
entre los meses de diciembre a enero en Caño Buja, municipio Maturín, estado
Monagas, Venezuela. La evaluación del comportamiento meiótico
se realizó en el Laboratorio de Citogenética de la Universidad de Oriente,
Núcleo de Monagas. Los botones de
Luego se analizaron 548 granos de polen para determinar la morfología, escultura
y el tamaño de los mismos.
RESULTADOS
Y DISCUSIÓN
Los resultados mostraron en meiosis
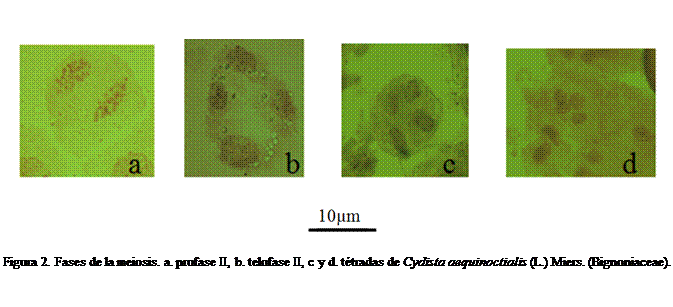
I células normales (Figuras 1-3) en las cuales se puede visualizar en la (Figura
1b) diacinesis la presencia de 20 bivalentes, n=20,
lo que corrobora el número cromosómico
básico reportado para la familia por Goldblatt y Gentry, (1979), Raven (1975) y Firetti-Leggieri et al., (2011) para especies del
género Anemopaegma. También se muestran
anomalías cromosómicas (Figura 4) en
las cuales se observaron cromosomas rezagados y no alineados; la meiosis II,
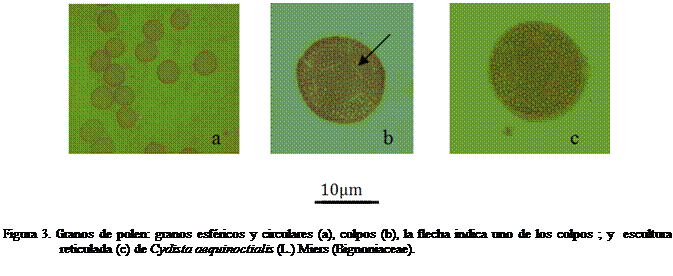
mostró tétradas tetragonales (Figuras 2c y d), polen tricolpado con escultura reticulada, (Figura 3) de forma
circular a elíptica, tamaño 3,64 ± 0,19 µm para los circulares y de 3,71 ± 0,22
µm y 3,55 ± 0,21 µm, para los elípticos,
éstos últimos en mayor porcentaje.


Los análisis mostraron un 47% de células con anomalías cromosómicas,
a citar cromosomas retardados, asincronía cromosómica
en la meiosis I y fallas de citocinesis, pudo haber sido la causa de la
formación de triadas en vez de tétradas de microsporas,
este alto porcentaje de células con anomalías cromosómicas, podría ser una de
las causas de la escasa producción de semillas en los frutos.
Se ha observado que en algunas especies de dicotiledóneas
los dos núcleos resultantes de la primera división meiótica
entran asincrónicamente en la segunda (González et al., 2001), lo cual podría resultar en esterilidad masculina,
anomalía que también la han relacionado con la orientación del huso, cromosomas
rezagados y puentes anafásicos que afectan la
conformación de las tétradas (Mendes-Bonato et al., 2002). Imery
y Cequea (2002),
estudiando la microsporogénesis de Aloe vera, encontraron baja viabilidad
del polen (39,3±10,54%), relacionándola con hallazgos tales como quiasmas
persistentes entre homólogos grandes y desplazamiento precoz de cromosomas
pequeños, presencia de puentes dicéntricos solitarios
o acompañados de puentes acéntricos en la meiosis I, así como también la
presencia ocasional de puentes y fragmentos, además de microsporas
adicionales en la meiosis II. La presencia de cromosomas rezagados en la
anafase I puede deberse a la falta de tensión que las enzimas sensitivas del cinetocoro ejercen sobre la fuerzas del huso, evitando así
su arrastre hacia los polos, o a que al menos uno de ellos esté desalineado,
generando señales negativas que la célula identifica (Taylor et al., 2004). Estas características también han sido detectadas
durante las divisiones meióticas de las especies Boronia heterophylla
(Shan et al.,
2003), Lippia
fissicalix, (Andrada et al., 1998); Passiflora edmundoi, (De Sousa et al., 2003), Brachiaria decumbens, (Mendes-Bonato
et al., 2002), del híbrido Rhizophora
x selala Salvoza
(Prakash 2002), Agave
tequilana
(Ruvalcaba-Ruiz y Rodríguez-Garay, 2002) y en Tithonia diversifolia (Alcorcés
et al., 2007).
CONCLUSIONES
El número cromosómico haploide de la especie es n=20. Se
encontró un 47% de células con anomalías cromosómicas tales como cromosomas
retardados, asincronía cromosómica en la meiosis I y
fallas de citocinesis.
AGRADECIMIENTO
Al Consejo de Investigación de
LITERATURA
CITADA
Alcorcés, N.; A. Lárez y J. Mayz. 2007. Adiciones al conocimiento citogenético
de Tithonia diversifolia (Hemsl.) A.Gray. Acta Bot. Venez. 30 (2): 267-275.
Andrada, A.; A. Pastoriza,
y V. Martínez. 1998. Citogenética en tres especies de Verbenaceae. Rev. Fac. Agron. (LUZ) 15:
312-318.
Buurman, J. 1978. Contibution to the pollen
morphology of the Bignoniaceae, with special
reference to the tricolpate type. Pollen Spores 19: 447-519.
De Souza, M. M.; T. N. S. Pereira, A. P. Viana, M. G Pereira, L. C. Bernacci, C. P Sudré and L. C.
Silva. 2003. Meiotic irregularities and pollen viability
in Passiflora edmundoi Sacco
(Passifloraceae). Caryologia
56 (2): 161-169.
Firetti Leggieri, F.; I. Ribeiro da
Costa, L. G. Lohmann, J. Semir
and E. R. Forni Martins. 2011
Chromosome studies in Bignonieae (Bignoniaceae):
The first record of polyploidy in Anemopaegma. Cytologia 76 (2): 185-191.
Fisher, E.; I. Theisen and
L. G. Lohmann. 2004. Bignoniaceae.
In K. Kubitzki
and J.W. Kadereit (eds). The Families and Genera of Vascular Plants. VII. Dycotiledons Lamiales
(Except Acanthaceae including Avicenniaceae).
Springer-Verlag, Heidelberg.
P. 9-38.
Gentry, A .H. and A. S. Tomb. 1979.
Taxonomic implications of Bignoniaceae palynology. Ann. Missouri Bot. Gard. 66:
756-777.
Gentry, A. H. 1980. Bignoniaceae. Part I -
Tribes Crescentieae and Tourrettieae.
Flora Neotrop. 25 (1): 1-131.
Goldblatt, P. and A.
H. Gentry. 1979. Cytology of. Bignoniaceae. Bot. Not. 132:475-482.
González,
F.; P. Rudall and C. Furness. 2001. Microsporogenesis
and systematics of Aristolochiaceae. Bot. J. Linnean
Soc. 137: 221-242.
Imery, J. and H. Cequea. 2002. Anormalidades
cromosómicas en la microsporogénesis de Aloe vera (L.) Burm.
f. (Aloaceae). Acta Bot. Venez. 25 (2): 143-152.
Mendes Bonato, A. B.; R. Junqueira, M. S. Pagliarini, C.
B. Valle and M. I. Oliveira. 2002. Unusual cytological patterns of microsporogenesis
in Brachiaria decumbens
abnormalities in spindle and defective cytokinesis causing precocious cellularization.
Cell Biol. Int. 26 (7): 641-646.
Missouri
Botanical Garden (MBG). W3 Tropicos Specimen data base 2006.Disponible en:
http://mobot.mobot.org/W3T/Search/vast.html. Consultado 21/02/2009.
Piazzano, M. 1998. Números cromosómicos en
Bignoniaceae de Argentina. Kurtziana 26:
179-189.
Prakash, A. 2002. Cytogenetics
and reproductive biology of mangroves in Rhizophoraceae.
Aus. J. Bot.
50 (5): 601-605.
Raven, P. H. 1975. The bases of
angiosperm phylogeny: cytology. Ann. Mo. Bot. Gard. 62: 724-764.
Ruvalcaba
Ruíz, D. and B. Rodríguez Garay. 2002. Aberrant meiotic behavior
in Agave tequilana
Weber var. Azul. BMC Plant Biol. 2: 10-14.
Shan, F.; G. Yan and A.
Plummer. 2003. Meiotic chromosome behaviour and Boronia (Rutaceae) genome reorganisation. Aust. J. Bot. 51 (5): 559-607.
Taylor, S.; M. Scott and A. Holland. 2004. The
Spindle Checkpoint: a quality control mechanism which ensures accurate
chromosome segregation. Chromosome Res. 12: 599-616.
Página diseñada por Prof. Jesús
Rafael Méndez Natera
TABLA DE CONTENIDO DE LA REVISTA CIENTÍFICA
UDO AGRÍCOLA



