Revista Científica UDO Agrícola Volumen 11. Número 1. Año 2011. Páginas:
104-108
Nota Técnica
Metodología para muestrear las fases inmaduras del defoliador Opsiphanes cassina Felder (1862) (Lepidoptera:
Nymphalidae) en palma aceitera
Metodology for sampling inmature stages of the defoliator Opsiphanes cassina Felder (1862) (Lepidoptera: Nymphalidae) in oil palm
Gladys RODRÍGUEZ GONZÁLEZ 1 ![]() , Ramón SILVA ACUÑA 1, Rafael
CÁSARES MOIZANT 2, Asdrúbal DÍAZ QUINTANA 1 y Renny BARRIOS MAESTRE 1
, Ramón SILVA ACUÑA 1, Rafael
CÁSARES MOIZANT 2, Asdrúbal DÍAZ QUINTANA 1 y Renny BARRIOS MAESTRE 1
1Instituto Nacional
de Investigaciones Agrícolas, Centro de Investigaciones Agrícolas del estado Monagas.
Apartado Postal 184. C. P. 6201. Maturín, estado Monagas, Venezuela y 2Instituto
de Zoología Agrícola, Facultad de Agronomía, Universidad Central de Venezuela,
Apartado Postal 4579. C. P.2101-A. Maracay, estado Aragua, Venezuela. E-mail:
gladrodriguezg@gmail.com ![]() Autor
para correspondencia
Autor
para correspondencia
|
Recibido: 26/09/2009 |
Fin de primer arbitraje:
07/11/2010 |
Primera revisión recibida: 28/11/2010 |
Aceptado: 05/01/2011 |
RESUMEN
La especie Opsiphanes cassina es un
insecto defoliador que produce pérdidas de
importancia económica en plantaciones de palma aceitera (Elaeis guineensis Jacq.).
Para implementar medidas de control oportunas, con un daño mínimo al ambiente,
es esencial estimar el tamaño poblacional, el cual normalmente se realiza
mediante contajes semanales en la hoja 17 o 25 de dos palmas ha-1,
En la finca “Agropecuaria El Águila” del estado Monagas, Venezuela, entre
agosto de 2001 y agosto de 2002, se realizaron evaluaciones con el objetivo de
desarrollar un método de muestreo para cuantificar las fases inmaduras (larvas
y pupa) y su lugar de preferencia en las diferentes secciones de la hoja y
sitio de la planta, se evaluó un lote de 10 ha de palma aceitera. Semanalmente
se seccionó la hoja N° 25 de dos árboles/ha. Se determinó que las fases
inmaduras del insecto mostraron una clara tendencia a ubicarse en la sección subapical de la hoja (pares de foliolos 41 al
80). En general, la oviposición ocurrió en el par de foliolos 71, mientras que
las larvas de los instares I y II se mantuvieron entre los pares de foliolos 71
y 73, las larvas III y IV se localizaron en el par 68, mientras que las del V
instar se ubicaron en el par 61. El
proceso de pupación ocurrió preferentemente en el
estipe de la planta. Cuando se produjo en la hoja hubo predilección por el par de foliolos 43. La nueva estrategia para el muestreo de las fases inmaduras de O. cassina
consiste en concentrar los esfuerzos en la región subapical de la hoja.
Palabras clave: comportamiento, gusano de las palmeras, muestreo, Elaeis guineensis
ABSTRACT
Opsiphanes cassina is a defoliator insect that causes economically important losses in oil palm
plantations (Elaeis guineensis Jacq.). In order to implement timely control measures, with
minimal environmental damage, it is essential to estimate the population size,
which normally is realized throughout weekly counts on leaf 17 or 25 of two
palms ha-1. At the farm "Agropecuaria
El Aguila", Monagas state, Venezuela,
evaluations were realized aimed to developing a sampling method to quantify the
immature stages, discriminating its preference on the different sections of the
leaf. Between August 2001 and August
Key words: behavior, sampling, split-banded
owlet, Elaeis guineensis
INTRODUCCIÓN
La especie Opsiphanes cassina Felder
(1862) es un insecto defoliador de importancia
económica en palma aceitera que puede originar pérdidas de hasta 50% en la
producción, y el impacto de sus daños sobre la recuperación de las plantas
puede requerir hasta dos años (Wood et
al. citado por Zenner y Posada, 1992). El
muestreo oportuno para la estimación del tamaño de la población larval
(Chinchilla, 2003; Syed, 1994; Le Verdier
y Genty, 1988) es esencial para determinar la
necesidad de aplicar medidas de control dentro de un programa de manejo
integrado de plagas (MIP), de manera que se realicen a tiempo y con el mínimo
daño al medio ambiente (Chinchilla,
2003; Mexzon y Chinchilla, 1991).
Para O. cassina,
estas determinaciones se efectúan normalmente mediante monitoreos semanales en la hoja 17 ó
25 en una o dos palmas ha-1 (Genty et al., 1978). En un estudio sobre la abundancia relativa de las larvas en los
diferentes estratos de la palma y su distribución a lo largo de las hojas
individuales, Rhainds et al. (1993) establecieron que un muestreo confiable se obtiene
contando únicamente las larvas en los 80 folíolos terminales de una hoja en
posición intermedia como la 17 o la 25.
Al realizar un muestreo, el estado
predominante del insecto determina la fase del ciclo en la cual se encuentra y
estas cuantificaciones repetidas en el tiempo permiten ubicar el momento más favorable
para la toma de decisión de la alternativa de control a emplear para los
adultos y particularmente antes de que inicien la actividad de oviposición (Le Verdier y Genty, 1988).
Los objetivos del presente
trabajo consistieron en desarrollar un método de muestreo para O. cassina en
palma aceitera (Elaeis guineensis Jacq.) que permita cuantificar sus fases inmaduras y
determinar el lugar de preferencia del insecto para pupar; información fundamental a los fines de contar
con datos confiables al momento de realizar el monitoreo de las pupas.
MATERIALES Y METODOS
Área experimental
El experimento se realizó
en la agropecuaria “El Águila” de la
Empresa Palmeras de Monagas C.A. (Palmonagas) entre
agosto 2001 y agosto 2002. La Finca está ubicada en la jurisdicción del
municipio Maturín, a 28 Km al este de la alcabala de Veladero,
localizada a 9° 33' 59'' N y 62° 55' 22'' O, a una altitud de 36 m. Posee un
total de 1927 ha, de las cuales 1550 ha se sembraron con palma aceitera,
durante los años 1990, 1991 y 1992, a
una distancia de 9 m x 9 m, de los materiales genéticos: Deli x Avros, provenientes de Costa Rica y Colombia y Deli x La Mé de África.
El área muestreada
correspondió a un lote de 10 ha de
palmas del material genético Avros x La Mé, sembradas en 1990, codificado con las siglas A2 sur - Vía 3.
Metodología
de muestreo
Los muestreos se
realizaron a intervalos semanales
para cuantificar las fases de huevo,
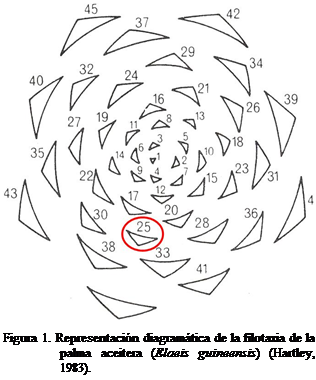
larva y pupa de O. cassina, seccionando la hoja N° 25 de dos árboles/ha (Figura 1). Para
evitar concentrar defoliaciones excesivas en ciertas áreas de la plantación y
realizar de forma sistemática el muestreo en el lote experimental delimitado
que contenía 60 hileras de plantas, se enumeraron de cinco en cinco, de esta
manera se identificaron 11 hasta alcanzar la hilera 55. En cada una de ellas,
se contaron y se marcaron las plantas con una cinta plástica de tráfico color
amarillo desde la planta número dos hasta la número cinco y desde la planta
número 14 hasta la planta número 17, creándose de esta manera 22 estaciones de
muestreo.
Se seleccionaron dos plantas
en cada una de las 11 hileras delimitadas (5, 10, 15, 20, 25, 30, 35, 40, 45,
50 y 55). Para el primer muestreo, se tomaron como estaciones dos árboles
identificados con los números 2 y 14, en el segundo las 3 y 15 y así
sucesivamente hasta los árboles 5 y 17. Al agotarse estas combinaciones se
continuó muestreando en los
árboles de las hileras siguientes (6, 11, 16, 21, 26, 31, 36, 41, 46, 51 y 56)
y en las mismas combinaciones de estaciones descritas anteriormente. El
muestreo continúa hasta las hileras 7, 12, 17, 22, 27, 32, 37, 42, 47, 52 y 57,
y así sucesivamente. Una vez utilizadas todas las hileras elegidas, se retornó
nuevamente a las iniciales pero en esta oportunidad se muestrearon las plantas
identificadas con los números 6 al 9 y 18 al 21, repitiéndose el procedimiento
descrito anteriormente, hasta agotarse totalmente el tiempo establecido para
los muestreos.
Por otro lado, la hoja N° 25 se dividió
en cuatro secciones, comenzando del ápice hacia la base, de acuerdo a la
metodología descrita por Rhainds et al. (1996): apical (pares de foliolos del 1 al 40), subapical (pares de foliolos del 41 al 80), intermedia
(pares de foliolos del 81 al 120) y basal (pares de foliolos mayores de 120).
Durante el muestreo se determinó para cada sección de la hoja, la distribución relativa
de los estados inmaduros activos: huevo, instares larvales y pupa identificando
el número correspondiente al foliolo donde se detectó.
Debido a que el insecto posee
hábitos para pupar tanto en las hojas como en el estipe de la palma, también se realizaron observaciones para definir el
lugar de preferencia del insecto por el sitio de pupación, contabilizándose su
número en la hoja N° 25 y en el estipe de la planta previamente seleccionada.
Análisis estadístico
Para analizar la distribución de los estados inmaduros
en la hoja No 25, se unieron los datos de huevos, larvas (en sus
diferentes instares (I, II, III, IV y V) y pupas obtenidos en 22 hojas,
evaluadas semanalmente durante un año (agosto 2001 - agosto 2002) en secciones
de 20 pares de foliolos: 1-20; 21-40; 41-60: 61-80; 81-100; 101-120; 121-140;
141-160; 161-180, 181-200. La información se procesó mediante estadística
descriptiva (Steel y Torrie 1985). El lugar de preferencia para pupar, se
determinó analizando los datos con la
prueba binomial (p ≤ 0,05) no parámetrica (Siegel y Castellan, 1995).
RESULTADOS
Y DISCUSIÓN
Propuesta para el muestreo de
estados inmaduros
Los registros de frecuencia determinados
por la cuantificación de las fases inmaduras (huevo, larvas del I, II, III, IV
y V instar y pupa) de O. cassina, para cada una de las clases de pares de
foliolos de la hoja N° 25 en la palma aceitera, se muestran en el Cuadro 1. Los
mayores valores de frecuencia, se presentan para las larvas de los instares II,
III, y IV, correspondiéndoles también las mayores desviaciones típicas y las
mayores amplitudes de intervalos de confianza (p ≤ 0,05) (Cuadro 2). Este
tipo de comportamiento, se debe probablemente a que estos instares exhiben
mayor movilidad en la hoja y adicionalmente, a que sus poblaciones no fueron
afectadas por la acción del parasitismo natural, debido a que solo fue
detectado en huevos, larvas del V instar y en pupas. Así mismo, las menores
desviaciones típicas y de frecuencia de localización se determinaron en huevo,
en las larvas del I y V instar; y en pupa.
|
Cuadro 1. Distribución de las fases
inmaduras de Opsiphanes cassina a
lo largo de la hoja número 25 en la palma aceitera (Elaeis guineensis) entre agosto 2001 y agosto 2002 en el
estado Monagas, Venezuela. |
|||||||
|
Clases (pares de foliolos)1 |
Frecuencias de
las fases inmaduras |
||||||
|
Huevo |
Larva I |
Larva II |
Larva III |
Larva IV |
Larva V |
Pupa |
|
|
01 – 20 |
1 |
2 |
5 |
3 |
4 |
4 |
1 |
|
21 – 40 |
11 |
6 |
13 |
15 |
9 |
16 |
5 |
|
41 – 60 |
11 |
9 |
25 |
18 |
23 |
15 |
6 |
|
61 – 80 |
18 |
14 |
14 |
19 |
14 |
16 |
2 |
|
81 – 100 |
13 |
12 |
27 |
18 |
15 |
11 |
0 |
|
101 – 120 |
4 |
5 |
6 |
8 |
7 |
5 |
0 |
|
121 – 140 |
1 |
4 |
5 |
4 |
2 |
2 |
0 |
|
141 – 160 |
1 |
0 |
3 |
1 |
1 |
0 |
0 |
|
161 – 180 |
1 |
0 |
0 |
0 |
1 |
0 |
0 |
|
181 – 200 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Total |
62 |
52 |
98 |
86 |
76 |
69 |
14 |
|
1= foliolos muestreados
desde el ápice hacia la base de la hoja. |
|||||||
|
Cuadro
2. Valores de Frecuencia, promedio
ponderado, desviación típica e intervalos de confianza según las fases de Opsiphanes cassina a
lo largo de la hoja número 25 en la palma aceitera (Elaeis guineensis) entre agosto 2001 y agosto
2002 en el estado Monagas, Venezuela. |
||||||||
|
Fases |
F |
X |
S2 |
IC |
||||
|
Huevo |
62 |
71,45 |
441,36 |
31,30 |
≤ |
µ |
≤ |
111,55 |
|
Larva
I |
52 |
73,19 |
441,39 |
32,39 |
≤ |
µ |
≤ |
113,99 |
|
Larva
II |
98 |
70,50 |
744,94 |
16,64 |
≤ |
µ |
≤ |
124,36 |
|
Larva
III |
86 |
68,34 |
594,49 |
22,84 |
≤ |
µ |
≤ |
114,20 |
|
Larva
IV |
76 |
68,13 |
503,33 |
26,81 |
≤ |
µ |
≤ |
109,45 |
|
Larva
V |
69 |
61,22 |
430,22 |
24,16 |
≤ |
µ |
≤ |
98,28 |
|
Pupa |
14 |
43,35 |
104,46 |
23,40 |
≤ |
µ |
≤ |
63,30 |
|
F= Frecuencia en 200 pares de foliolos; X= Valor
proveniente de la sumatoria de frecuencia multiplicado por el valor del punto
medio del intervalo de los foliolos dividido por el valor de la frecuencia
total; S2 = Desviación típica; IC= Intervalo de confianza a una
probabilidad de P ≤ 0,05. |
||||||||
De acuerdo a los promedios ponderados de
los foliolos (X) a lo largo de la hoja N° 25 (Cuadro 2), la ubicación de las
diferentes fases de O. cassina es bastante disímil, con las excepciones de las
fases de larvas III y IV. Todas las fases del insecto se desarrollan con
preferencia en los pares de foliolos de la sección subapical
(pares de foliolos 41 al 80), particularmente, entre los pares de foliolos 70
al 73, donde se localizan los mayores promedios ponderados para huevos, larva I
y larva II. De manera similar, entre los pares de foliolos 61 al 68 se
localizan las larvas de los instares III, IV y V. Finalmente, en el par de
foliolos 43 se detecta la mayor presencia de pupas
Según Rhainds et al. (1993), el patrón de distribución
de larvas de O. cassina en la hoja es similar
en los primeros 80 foliolos contados a partir del ápice de la hoja. En esta
investigación se determinó que para cada fase, incluyendo los diferentes
instares larvales, el comportamiento es variable y que por lo menos en los
primeros 17 pares de foliolos el insecto no se detecta, esos pares corresponden
a la parte apical de la hoja (pares de foliolo del 01 al 40).
De manera general, para las fases del
insecto se pudo observar un amplio rango de preferencia (intervalos de
confianza, Cuadro 2) por ciertos foliolos de la hoja. En el nivel inferior, el
menor valor (16,64) correspondió al de larva II (par de foliolo Nº 17) y el
valor más alto (32,39) al de larva I. En el nivel superior, de todos los
intervalos de confianza, el valor más bajo (63,30) correspondió a las pupas y
el más alto (124,36) al de larva II. Sin embargo, con base en el promedio
ponderado, se observa una clara tendencia del insecto a ubicarse en la sección subapical.
El par de foliolo 71, fue el preferido
por el insecto para la oviposición, las larvas entre
el I y II instar, se mantuvieron entre los pares de foliolos 71 y 73, de ellas,
la larva II instar presentó el más amplio rango (16,64 ≤ µ ≤ 124,36), lo que permite
presumir que este instar exhibe la mayor movilidad en la hoja. A medida que el
insecto avanzó en su desarrollo, se ubicó en los foliolos que preceden al par
71, pero siempre dentro de la región subapical, así
vemos, que larvas III y IV instar, se localizaron en el par 68, y la del V en
el 61, el insecto prefirió pupar en el par 43.
La baja preferencia del insecto por los
pares de foliolos que conforman la sección apical (pares de foliolos 01 al 40),
podría explicarse por el daño acumulado que exhiben estos foliolos debido a las
defoliaciones sucesivas de generaciones anteriores citadas por Rhainds et al., (1993).
Los diferentes instares larvales de O.
cassina,
así como las otras fases de huevo y pupa, fueron más abundantes en la
sección subapical (pares de foliolo del 41 al 80), lo
cual coincide con lo registrado por Wahid (1993) en
un estudio sobre larvas de Metisa plana
(Walker) y por Rhainds et al. (1996) en un trabajo sobre el desarrollo de un método de
muestreo para Oiketicus kirbyi
(Guilding); mencionando que la preferencia de las
larvas por las secciones subapical e intermedia de la
hoja puede estar relacionada con los bajos niveles de taninos y/o altos de nitrógeno.
Los resultados indican que el monitoreo
del insecto debe concentrarse en la sección subapical
de la hoja, lo cual constituye una nueva estrategia de muestreo, dirigida hacia
una mayor eficiencia en la actividad de cuantificación de los estados inmaduros
del insecto, revirtiéndose en una mejor relación costo: beneficio.
Preferencia del insecto por el sitio
de pupación:
En la Agropecuaria El Águila, durante el
ciclo de muestreo (agosto 2001- agosto 2002) se colectaron 29 pupas en el
estipe de la planta y 14 pupas en la hoja número 25. Al aplicarle a estos datos
la Prueba Binomial para muestras grandes (N ≥ 35, P ≤ 0,05) se
obtuvo un valor de Z = -2,14 y una probabilidad de p ≤ 0,0089; ello nos
permite concluir que las larvas del V instar, próximas a entrar al estado de prepupa, tienden a trasladarse desde la hoja hacia al
estipe para completar la fase de pupa.
Con base en estos resultados se propone
estimar el momento de la emergencia de los adultos, recolectando las pupas en
el estipe de la palma aceitera. Las razones de esta preferencia, posiblemente
se debe a que en las hojas las pupas quedan expuestas al efecto de factores
abióticos como altas temperaturas y fuertes lluvias y bióticos como
parasitoides, depredadores (pájaros y otros), en cambio, en el estipe hay mayor
protección; allí se desarrollan varias especies de plantas epifitas, que
proporcionan al insecto refugio en contra de los factores adversos ya
indicados.
CONCLUSIONES
El
insecto prefirió para la oviposición el par de foliolo
71, las larvas de los instares I y II, se mantuvieron entre los pares de
foliolos 71 y 73; mientras que las larvas de los instares III y IV, se
localizaron en el par 68, y la del V en el 61. El proceso de pupación ocurrió preferentemente en el estipe de la planta,
cuando se produjo en la hoja, hubo predilección por el par de foliolos 43. La metodología de
muestreo apropiada para cuantificar las fases inmaduras de O. cassina Felder
debe concentrarse en la subapical (pares de foliolos
del 41 al 80) de la hoja N° 25 de la palma aceitera.
AGRADECIMIENTO
Los autores queremos agradecer la gentileza
de la Empresa Palmeras de Monagas C.A. (Palmonagas)
por ceder parte de las áreas de siembra de palma aceitera para la realización
de esta investigación; así como también a Ursulino
Manrique por sus acertadas observaciones al manuscrito.
LITERATURA
CITADA
Chinchilla, C. 2003.
Manejo integrado de problemas fitosanitarios en palma aceitera Elaeis guineensis en
América Central. Manejo Integrado de Plagas y Agroecología 67: 69 -82.
Genty, P. H.; D, Desmier De Chenon y J. R, Morin. 1978. Las
plagas de la palma aceitera en América Latina. Oléagineux
33 (7): 326-420.
Hartley, C. W. S. 1983. La palma de
aceite. Traducido por E. Maldonado. Editorial Continental. México. 958 p.
Le Verdier
A. y P. Genty. 1988. Daños y control de Hispoleptis subfasciata Pic.; Hispinae filófago de la
palma aceitera en América latina. Oléagineux 43 (11): 404-407.
Mexzon R,
and C. Chinchilla. 1991. An inventory of the oil palm pests and their natural
enemies in Central America. Palm Oil Research Institute of Malaysia (PORIM),
Palm Oil Conference. Agriculture. p 443-450.
Rhainds,
M.; C. Chinchilla y G. Gries. 1993. Desarrollo de un método de muestreo para larvas
de Opsiphanes cassina Felder en palma aceitera. Manejo Integrado de Plagas 30: 15-18.
Rhainds,
M.; G. Gries and C. Chinchilla. 1996. Developmet of a samplig method for first instar Oiketicus Kirbyi (Lepidoptera: Psichidae)
in oil palm plantations. Bol. Entomol. Soc. Am. 89 (2): 396-401.
Siegel S. y J. Castellan. 1995.
Estadística no paramétrica aplicada a la ciencia de la conducta. 4ta
edición. Editorial Trillas. México: 437 p.
Steel R. y J. Torrie. 1985. Bioestadística: Principios y procedimientos.
2da edición. Traducido por R. Martínez. Editorial McGraw-Hill.
Colombia. 622 p.
Syed, D. 1994. Estudio del manejo de plagas en palma de
aceite en Colombia. Palmas 15 (2): 55-68.
Wahid, M. B. 1993. Life history, ecology and economic impact of the
Bagworm, Metisa plana Walker
(Lepidoptera: Psychidae) on the oil palm, Elaeis guineensis Jaquin. (Palmae),
in Malaysia. Ph. D. Dissertation. University of
Guelph. 231 p.
Zenner De Polania, I. y F. Posada.
1992. Manejo de insectos, plagas y benéficos de la palma africana. Bogota. Instituto Colombiano Agropecuario (ICA), Manual de
Asistencia Técnica 54. 124 p.
Página
diseñada por Prof. Jesús Rafael Méndez Natera
ÍNDICE
DE LA REVISTA CIENTÍFICA UDO AGRÍCOLA (REGRESO)



