Revista
Científica UDO Agrícola Volumen 10. Número 1. Año 2010. Páginas: 141-149
Imposex en la laguna
de Términos, Campeche, México
Imposex in the
laguna de Terminos, Campeche, Mexico
Faustino
RODRÍGUEZ ROMERO
Instituto de Ciencias del
Mar y Limnología, Universidad Nacional Autónoma de México, Apartado postal
70-305, México 04510, D. F. México. E-mail: faustrod@mar.icmyl.unam.mx y
faustrod@yahoo.com.mx
|
Recibido: 29/10/2009 |
Fin de arbitraje: 24/09/2010 |
Revisión recibida: 27/11/2010 |
Aceptado: 17/12/2010 |
RESUMEN
Se realizó un estudio sobre la
presencia del Tributilestaño (TBT) a través del análisis del fenómeno de
imposex en tres especies de gasterópodos en el medio acuático de la laguna de
Términos a fin de evaluar la masculinización de hembras de estos moluscos como
consecuencia directa de la acción del TBT. Se recolectaron en total 124
organismos de los cuales 65 fueron sometidos al análisis anatómico en busca de
la presencia de indicadores de masculinización, por la aparición de primordios
de pene y del vas deferens en las
hembras. Se encontraron resultados positivos en un 15,263% para el total de las hembras analizadas en
dos especies: Echinolittorina ziczac
de la Isla del Carmen (IRLP = 2,439) y Nassarius
(N.) vibex del estero de
Sabancuy (IRLP = 1,0741). Estos resultados demuestran una sorprendente salud
con respecto al TBT en las aguas de la laguna de Términos a pesar de la
actividad industrial y desarrollo social de esta región.
Palabras clave: TBT, imposex, gasterópodos
ABSTRACT
A study on the presence of tributyltin (TBT) was conducted through the
analysis of the phenomenon of imposex on three gastropod species into the
aquatic environment of the laguna de Terminos, Campeche for assessing the
females masculinization as a direct result of the quantitative presence of the
TBT. A total of 124 snails were collected of which 65 were subjected to the
anatomical analysis in search of the presence of masculine indicators by the
appearance of penis and the vas deferens
in females. Positive results were found in a 15.263% for the two species: Echinolittorina ziczac from the Isla Del
Carmen (IRLP = 2.439) and Nassarius vibex
from Sabancuy estuary (IRLP = 1.0741). These results demonstrate a surprising
good environmental health situation with regard to the TBT in the waters of the
laguna de Terminos in spite of the industrial activity and social development
in this region.
Key words: TBT, imposex, gastropods
INTRODUCCIÓN
El Tributyltin (TBT), es un biocida diseñado
para actuar directamente en la superficie de los cascos de las embarcaciones
con el fin de evitar la adhesión de organismos. Este compuesto no se queda
confinado a las embarcaciones porque una vez que se produce la lixiviación en
el agua de mar, tiene una tendencia fuerte a adherirse a las partículas del
sedimento y de la biota que se encuentra en el cuerpo de agua y en el lecho
marino. Compuestos organoestañosos como el tributilestaño, trifenilestaño y el
difenilestaño, resultan muy peligros para las comunidades bióticas porque
pueden ser ingeridos por los organismos y penetrar a través de las membranas
biológicas (Bryan et al., 1993; Yamada et al., 1997).
Se ha demostrado que la toxicidad del TBT en el ambiente marino es mayor
que en el agua dulce (Fent, 1996; Gray et al.,
1987; Tas et
al., 1996) aún a concentraciones de
nanogramos por litro y su presencia por periodos prolongados permite que se
distribuya en forma extensiva en el medio (Laughlin y Linden, 1987; Cleary, 1991; Cortez
et al., 1993) en forma persistente,
en particular en sedimentos donde puede permanecer por décadas con niveles de
alta toxicidad (Chau et al., 1997;
Maguire et al., 1997; Stewart, 1996). A
principios de la década de los 1970s, se descubrió, una anormalidad de
masculinización en el desarrollo de las características sexuales de hembras de
moluscos gasterópodos, que identificada con el nombre de imposex fue
relacionada con la presencia del TBT y causaba una alta mortalidad de las
hembras y disminución de las poblaciones locales con peligro de extinción
(Gibbs y Bryan, 1986; Bryan et al., 1986). Estos efectos, asociados
a la presencia de TBT, fueron encontrados en varias especies de gasterópodos
intermareales en otras áreas costeras (Ward, 1988; Ellis
y Pattisna, 1990). Se ha demostrado que el impacto de TBT no queda restringido
a los moluscos ya que se han encontrado consecuencias de éste en una amplia
variedad de organismos incluyendo aves y mamíferos (Iwata
et al., 1995;
Kannan y Falandysz, 1997).
En América Latina, la ocurrencia de
imposex ha sido observada por investigadores como Gooding et al., (1999) y Huaquín et al., (2004) en Chile; por Braga de
Castro et al., (2000, 2008), (Cardoso
et al., (2009), Bezerra et al., (2010) en Brasil; Penchaszadeh et al., (2001), Bigatti y Penchazadeh
(2005) en Argentina; por Miloslavich et
al., (2007) en Venezuela; y por Gravel et
al., (2006), en Costa Rica; así como por estudios realizados en las costas
del sur del Atlántico y el Pacífico realizados por Caetano y Absalão (2002),
Fernández et al., (2002) y Goldberg et al., (2004). Todos ellos han
confirmado la relación entre la ocurrencia de imposex y la concentración del
TBT en el agua, los sedimentos y cápsulas de huevos. En México, no se conocen
estudios que indiquen el estado de salud de las aguas costeras con respecto a
compuestos organo-estánicos, particularmente el TBT, a pesar del gran interés
que reviste su evaluación, que permite medir el impacto sobre los recursos
bióticos costeros en las regiones de fuerte movimiento de embarcaciones.
En vista que, el impacto de estas
actividades se puede medir indirectamente a través del estudio del imposex y de
que este fenómeno aún es objeto de investigación en moluscos y otros
organismos, es objeto del presente trabajo realizar un relevamiento de la
presencia del TBT en aguas costeras de la laguna de Términos en una zona de
gran actividad en la extracción del petróleo crudo, mediante el monitoreo en 3
especies de moluscos gasterópodos comunes de esa región: Nassarius vibex (Say,
1822), porque se has probado recientemente su utilidad como bioindicador de TBT
en aguas estuarinas (Bezerra et al.,
2010; Marshall and Rajkumar, 2003) incluida la modalidad de bifalia en las
hembras con imposex (Cardoso et al.,
2009); Echinolittorina ziczac (Gmelin,
1791), porque aunque aun cuando no se
tiene registro sobre el impacto del TBT en esta especie, se ha documentado que
en otros géneros de la familia Littorinidae, existen taxa como Littorina littorea y L. sitkana que han sido reconocidas como especies centinelas de
contaminación para varias substancias tóxicas incluido el TBT, por su
manifestación de intersexo cuya utilidad ha sido recomendada para estudios de
imposex (Barroso et al., 2000;
Nohara, 1999) y Cerithium lutosum (Menke,
1828), porque se trata de una especie abundante, común en la región de estudio
y porque, aunque no se conocen informes de imposex, se sabe que a pesar de ser
una especie afálica, presenta la
característica de copulación interna con sexos diferenciados y gonoductos
paliales abiertos en ambos sexos (Cannon, 1975; Houbrick, 1980) y no se han
agotado las posibilidades de alguna manifestación anatómica en esta especie
ante el impacto del TBT.
El objetivo fue evaluar la
masculinización de hembras de tres especies de gasterópodos en el medio
acuático de la laguna de Términos, México, como consecuencia directa de la
acción del TBT.
MATERIALES
Y MÉTODOS
Área
de estudio
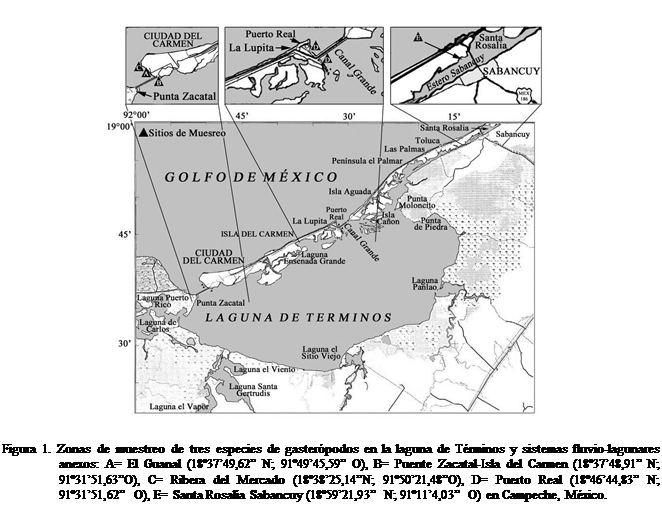
La laguna de Términos es un
cuerpo de agua somero en el estado de Campeche, México. Cubre un área
aproximada de 2,500 km². La barrera natural que la separa de las aguas del
Golfo de México, es la Isla del Carmen, con aproximadamente 40 km de largo y 3
km de ancho, con dos bocas: al oriente la boca de Puerto Real y al occidente la
boca del Carmen; en la primera se observa un flujo de entrada de agua
permanente y por la segunda el agua fluye hacia el mar (Figura l). Los rasgos
hidrográficos más característicos del área, son los sistemas fluvio-lagunares
que descargan sus aguas en la costa suroeste de la laguna de Términos,
provenientes del sistema fluvial más notable del país, formado por los ríos
Grijalva, Usumacinta y sus afluentes que se comunican a la laguna de Términos a
través de la boca de Atasta (Figura l). En el extremo oriental de la laguna de
Términos desembocan una serie de pequeños arroyos, de los cuales los más
notables son: Chivojá Grande, Chivojá Chico, Colax y Lagartero así como el
Estero Sabancuy.
El clima es cálido
húmedo con lluvias durante el verano, con valores de precipitación que van de
1,200 a 2,000 mm de promedio anual. La temperatura ambiente media anual es de
27°C, con valores máximos de 36°C en el verano y mínimos de 17°C en el
invierno. Yáñez-Arancibia y Day (1982)
definen tres épocas o "estaciones" bien caracterizadas a lo largo del
año: a) Época de lluvias de
junio a septiembre; b) Época de nortes
en los meses de noviembre, diciembre y enero. c) Época estival. El régimen de mareas es del tipo mixto con un
rango de 0,5 m aproximadamente. El agua penetra a la laguna en ciclos
periódicos con duración aproximada de 15 horas. El factor determinante de la
circulación del agua en la laguna son los vientos dominantes del
noreste-sureste, por lo que el flujo neto de la masa de agua es de dirección
este a oeste (Mancilla y Vargas, 1980). La corriente litoral se efectúa en dos
sentidos, hacia el este y oeste, siendo esta última más acentuada. La corriente
de agua marina que penetra por la boca Puerto Real, es paralela a la costa
lagunar de la Isla del Carmen estando caracterizada por aguas claras y vegetación
sumergida, saliendo a través de la boca del Carmen. Sin embargo, por la boca
del Carmen, también se observa entrada de agua marina afectando a más de un
tercio de la laguna, en donde las aguas son turbias por el aporte de sedimentos
en suspensión en las aguas drenadas de los sistemas fluvio-lagunares. La mezcla
de los dos tipos de aguas: marina y lagunar, produce un efecto buffer
impidiendo que el agua marina fluya directamente a la costa sureste de la
laguna. Phleger y Ayala-Castañares (1971) reconocen la presencia de dos grandes
deltas, uno en el interior de la laguna, frente a la boca Puerto Real, con
abundantes sedimentos calcáreos transportados por las fuertes corrientes de
agua marina, y otro fuera de la boca del Carmen con sedimentos terrígenos finos
llevados por las aguas continentales. La salinidad del agua en el interior de
la laguna varía en relación a las estaciones, correspondiendo los valores
máximos a la región oriental durante la época de sequía o estival. Estos mismos
autores encontraron valores que oscilaron entre 25,0%o y 36,5%o
de salinidad en la parte noreste de la laguna próxima a la boca de Puerto Real
y en la porción sur y occidental de 28%o a 0%o. Carvajal
(1973) señala valores promedio de 33%o para la época de secas y
26,0%o para la temporada de lluvias. La temperatura muestra
variaciones estacionales a lo largo del año, especialmente durante la estación
de Nortes y los meses más cálidos; sin embargo se puede considerar que se
mantiene en un rango promedio de 29,9 ºC (Toral, 1971).
Procesos
sociales
El área de protección de
Flora y Fauna de la laguna de Términos, comprende una superficie de 705.016 has. Según el conteo de
población, en este municipio la población ha aumentado de 1950, con 23.999 a 2005 con 199.988 habitantes (INEGI, 2006). En el país, esta región natural protegida
es la única que incluye dentro de sus límites a una ciudad como Ciudad del
Carmen y constituye una de las áreas naturales protegidas más pobladas de
México. Esta ciudad está asociada a la producción del 71% de la producción
nacional del petróleo de México. Ha generado una migración de las empresas de
servicios y de consultoría de la Ciudad de México, Tamaulipas y Veracruz hacia
Ciudad del Carmen, Campeche. (Boisier, 1986). Paralelo a estas actividades, también se encuentran la ganadería, la
agricultura, la industria cocotera y la artesanal.
Especies
en estudio
Nassarius vibex (Say, 1822), Echinolittorina ziczac (Gmelin, 1791) y Cerithium lutosum (Menke, 1828).
En total se
recolectaron 124 caracoles en las 3 especies, de los cuales 57 correspondieron
a C.
lutosum,
17 a N. vibex y 50 a E. ziczac (Figura 2). De esta muestra, se
seleccionaron para el estudio de imposex un total de 65 individuos, 23 de C. lutosum, 17 de N. vibex y 25 de E. ziczac.
Los organismos fueron recolectados entre abril y mayo de 2007 y 2008,
identificados taxonómicamente y separados en acuarios independientes con agua
filtrada obtenida en los sitios de colecta. C.
lutosum y N. vivex, proceden del estero de Sabancuy (18º59’21,93”N;
91º11’4,03”O) en la región conocida como Santa Rosalía, a profundidades entre
1,0 y 1,5 m, mientras que las muestras de E.
ziczac fueron obtenidas en la zona intermareal de las siguientes
localidades: El Guanal, (18º37’49,62”N; 91º49’45,59”O) en los 2 lados del puente Isla del
Carmen-Zacatal, (18º37’48,91”N; 91º31’51,63”O) en la playa del Mercado
(18º38’25,14”N; 91º50’21,48”O) y en Puerto Real, Isla del Carmen
(18º46’44,83”N; 91º31’51,62”).

Procesamiento
de los organismos
Se realizaron disecciones en cada uno de los
especímenes de las tres especies con el fin de ubicar el aparato reproductor.
La longitud del pene en Nassarius
(Nassarius) vivex y Echinolittorina ziczac fue determinada mediante el uso de un Calibre
vernier a una precisión de 0,1 mm, midiendo desde su base a la punta del mismo.
Se cuantificó el porcentaje de hembras con imposex de acuerdo con el
procedimiento de Gibbs y Bryan (1994), para cada organismo que lo presentó.
Para la determinación del sexo se tomaron en cuenta los rasgos anatómicos
característicos del sexo tales como próstata, conducto deferente, pene y vagina
y se tomaron muestras del tejido gonádico para precisar mediante el uso de un
microscopio de observación Zeiss a 40 y 100X, la presencia de óvulos o
espermatozoides como un criterio adicional. En algunos de los organismos
sacrificados, se tomaron muestras de tejido para estudios posteriores de
citogenética de alta definición y caracterización cromosómica del sexo.
Observaciones al microscopio estereoscópico
de disección (American Optical)
permitieron determinar la presencia de vas
deferens en hembras y las mediciones de penes femeninos. En los casos en
que se esbozó alguna alteración con presencia de masculinización y primordios
de pene en hembras, se tomaron medidas relativas para definir el grado de
imposex mediante el cálculo del Índice Relativo del largo del Pene (IRLP) de
acuerdo con el procedimiento de Gibbs y Bryan (1994), mediante la fórmula:
IRLP = (LPh/LPm) x 100
Donde:
LPh es el largo medio del pene en las
hembras
LPm es el largo medio del pene en los
machos
RESULTADOS Y
DISCUSIÓN
Los resultados
del análisis de cada uno de los organismos seleccionados en cada especie
referentes al sexo y presencia o ausencia de rasgos anatómicos atípicos en los
órganos sexuales externos, (Fretter 1941; Castillo y Brown 2008) fueron
conjuntados en el Cuadro 1.
|
Cuadro 1. Concentración de datos y mediciones de
los organismos analizados en tres especies de gasterópodos de la laguna de
Términos, Campeche, México. |
|||||||
|
|
Sitio de |
|
|
|
Largo
medio |
|
|
|
Especie |
colecta |
N(M:H) |
IDI (%) |
IRLP |
M |
H |
DS |
|
Nassarius vibex |
E |
17(7:10) |
10,00 |
1,07 |
14,7 |
15,6 |
2,77 |
|
Echinolittorina ziczac |
A.B.C.D |
25(6:19) |
5,26 |
2,44 |
6,3 |
6,3 |
0,85 |
|
Cerithium
lutosum |
E |
23(3:20) |
0,00 |
0.00 |
22,2 |
23,3 |
2,36 |
|
Total |
|
65(11:54) |
15,26 |
|
|
|
|
|
A = El Guanal, B = Puente
Zacatal-Isla del Carmen, C = Ribera del Mercado, D = Puerto Real y E = Santa
Rosalía Sabancuy. N = Número de
organismos, M = Machos, H = Hembras. IDI = Incidencia de imposex, IRLP =
Índice relativo de la longitud del pene. y DS = Desviación estándar |
|||||||
Las tres
especies estudiadas mostraron diferentes proporciones entre hembras y machos.
En N. vivex el 35,29% fueron machos y
el 64,70% hembras, en E.ziczac, los
machos fueron el 24% y las hembras el 76 % y para C. lutosum, la proporción fue de 13.04%
machos por 86.95% hembras. Esta
asimetría en la proporción de sexos resulta interesante aunque por el momento,
no se tiene una explicación objetiva que la justifique. Las evidencias de imposex incipiente en su
forma clásica, se presentaron en N. vivex
y E. ziczac por ser especies fálicas.
En el caso de C. lutosum, por ser una
especie afálica, no se encontró ningún remedo de pene en las hembras, ni
alteraciones a los rasgos sexuales externos de hembras y machos de
acuerdo con la caracterización anatómica realizada por Cannon (1975) y Houbrick
(1980), no obstante, en esta especie fue factible la determinación del sexo por
la presencia al microscopio de óvulos en las hembras y espermatozoides en los
machos, además de los rasgos anatómicos característicos. En el caso de las dos
especies restantes, además de la presencia de óvulos y espermatozoides, fue
relevante la presencia del vas deferens
en la observación al microscopio de disección de los machos. La
evidencia sobre primordios de pene en dos hembras de la totalidad de organismos
estudiados, se complementó con la presencia de muy discretos abultamientos que
se interpretaron como el inicio incipiente de vas deferens en comienzo temprano del proceso de imposex
probablemente dentro de la clasificación del Estado 1 propuesta por Huang et al., (2008).
Las tres especies estudiadas están
presentes en el área de estudio. Cerithium lutosum (Menke) y Nassarius (Nassarius) vibex (Say) son comunes en el estero de
Sabancuy. N.vivex, fue elegida por su abundancia y porque se encuentra
ampliamente avalada en la literatura como una especie indicadora sensible a la
presencia de TBT. (Marshall y Rajkumar, 2003). Para la región urbana
y suburbana de la isla del Carmen y la boca de Puerto Real, la especie
seleccionada por ser la mas abundante y bien caracterizada sexualmente como
indicadora de TBT, fue Echinolittorina sp.
(Reid, 2009; Van den Broeck et al.,
2009; Bauer et al., 1997). La
cuidadosa identificación taxonómica de las especies estudiadas condujo a
reconocer a Echinolittorina sp, como Echinolittorina ziczac Gmelin, lo que ha
constituido un hallazgo de nueva localidad geográfica para esta especie y para
lo cual se encuentra en preparación un informe aparte. En el caso de la especie
Cerithium lutosum, aunque no se
encontraron evidencias de la presencia de un pene en machos en concordancia con
el carácter afálico de esta especie no obstante que presenta una copulación
interna con sexos diferenciados con presencia de gonoductos paliales abiertos
en ambos sexos (Cannon, 1975; Houbrick,
1980) por ello, se optó por tomar muestras de tejido gonádico para definir
citológicamente el sexo. A esta especie
se decidió estudiarla en busca de indicadores atípicos en el sistema
reproductor de las hembras atribuibles a la posible presencia del TBT. El
análisis practicado no permitió detectar alteraciones a la anatomía normal del
aparato reproductivo de estos organismos.
En N. vibex y E.
ziczac, no se observaron alteraciones en los organismos del sexo masculino
que fueron estudiados; en E.ziczac
por tratarse de una especie que por primera vez ha sido analizada para estudios de imposex, no se
tienen registros en la literatura que permitan realizar comparaciones con otras
poblaciones. Del análisis anatómico practicado a las hembras, solo dos
organismos, uno en E. ziczac de 19
hembras y uno en N.
vibex en 10 hembras, presentaron algún grado de imposex aunque
incipiente en los dos casos, esto es que apenas el 15.263% de los organismos en
estas dos especies en conjunto, presentarían alguna alteración con tendencias a
la masculinización de hembras como sucede cuando está presente el TBT. Las
alteraciones encontradas atribuibles a la posible presencia de TBT en los dos
organismos de distintas especies, quedan dentro de el nivel de incipiente en la
fase dos de acuerdo con la escala propuesta por Gibbs et al., (1987) o como fase uno en la escala de Huang et al., (2008). Quedaría pendiente un
análisis exhaustivo para estudiar la posibilidad de la presencia del raro
Síndrome de Dumpton caracterizado por la existencia de hembras
con imposex pero sin pene y su posible uso como biomarcador de TBT en las especies
aquí estudiadas como en el caso de Nucella lapillus en
Galicia, España (Barreiro et al.,
2004).
La
evidencia sobre primordios de pene en dos hembras de la totalidad de organismos
estudiados, se complementó con la presencia de muy discretos abultamientos que
se interpretaron como el inicio incipiente de vas deferens en el inicio incipiente del proceso de imposex. Esto
se justificaría en la medida en que en el medio solo se pudieran encontrar
cantidades de TBT por debajo de los umbrales de nanogramos por litro (Ruiz et al., 1998; Van den Broeck et al., 2009; Bauer et al., 1997) en concordancia con el criterio de buena salud
del medio acuático referido a este tóxico o que la presencia de este
contaminante fuera tan reciente que apenas se iniciara la respuesta biológica
de las especies en estudio sin embargo, esto último no parece ser el caso en
vista de que el estudio consistió en el análisis de organismos adultos
obtenidos durante los años de 2007 y 2008, aun cuando persiste la incertidumbre
si en el pasado ha existido contaminación por TBT sin que nadie la hubiera
registrado. Otra posibilidad podría estar relacionada con la dinámica de
corrientes tanto de aguas limnéticas como de origen marino en cuyo caso el
flujo de aguas permitiera la dilución y el lavado eficiente de este
contaminante antes de su impacto en las poblaciones de moluscos. La
cuantificación por procedimientos de determinación química del TBT sería una
forma de coadyuvar al esclarecimiento de este punto, aunque la abrumadora
literatura sobre los estudios de imposex en gasterópodos, avalan ampliamente la
confiabilidad de este indicador sobre la presencia peligrosa y el impacto del
TBT en el medio acuático.
Una medida
adicional indirecta para complementar el criterio sobre la salud del medio es
el estudio de las posibles alteraciones al cariotipo normal de las especies que
presentaron rastros de imposex, particularmente, en las hembras con estos
indicios. Por ello, se tomaron muestras de tejido gonádico en hembras y machos
de apariencia anatómica normal y en hembras con alguna anormalidad, con el fin
estudiar comparativamente los parámetros cariotípicos y bandas cromosómicas que
pudieran indicar alteraciones tales como rompimientos cromosómicos y alguna
correlación con el TBT en las hembras. Estos estudios se encuentran en proceso
y serán divulgados posteriormente.
Este hallazgo sobre
el sorprendente buen estado de salud de las aguas de los sistemas lagunares en
la región de la laguna de Términos con respecto a la presencia del TBT, es
contradictorio de lo que comúnmente se podría suponer en vista de la actividad
industrial, el desplazamiento de embarcaciones de pescadores que se mueven
dentro de las aguas de la laguna de Términos, el paso de embarcaciones mayores
por las bocas de El Carmen y de Puerto Real y del crecimiento exponencial de la
población de Ciudad del Carmen debido a la explotación del petróleo, que
conlleva la producción de aguas residuales en las inmediaciones de la isla del
Carmen, pero se puede explicar debido a la dinámica de recambio de aguas en la
zona estudiada, tanto por el intenso movimiento de las aguas limnéticas
procedentes de ríos que desembocan en el
interior de la laguna, como al efecto de corrientes de aguas de origen marino
que barren el margen de la Isla del Carmen con un comportamiento definido, y a la falta de uso de pinturas que contienen
este contaminante en las embarcaciones de los pescadores de la región así como
a la muy escasa actividad de embarcaciones de recreo que circulan por estas
aguas. Es recomendable la vigilancia de la presencia de imposex mediante el
análisis de especies de Neogasterópodos que puedan encontrarse en esta región y
de especies de bivalvos como ostiones del género Crassostrea.
AGRADECIMIENTOS
A Arturo Toledano Granados de la Estación
Puerto Morelos ICMYL-UNAM por su valiosa ayuda en el trabajo de campo y por la
identificación taxonómica de los ejemplares en estudio y a Carlos Illescas del
ICMYL-CU, por las facilidades otorgadas para la fotografía de los organismos.
LITERATURA CITADA
Barreiro, R.; M. Quintela y J. M. Ruiz. 2004. TBT e imposex
en Galicia: los efectos de un disruptor endócrino en poblaciones de
gasterópodos marinos. Ecosistemas
13: 14-32.
Barroso, C. M.; M. H. Moreira and P.
E. Gibbs. 2000. Comparison of imposex and intersex development in four
prosobranch species for TBT monitoring of a southern European estuarine system
(Ria de Aveiro, NW Portugal). Mar. Ecol. Prog. Ser. 201: 221-232.
Bauer, B.; P. Fioroni, U. Schulte
Oehlmann, J. Oehlmann and W. Kalbfus. 1997. The use of Echinolittorina littorea for tributyltin (TBT) effect
monitoring-Results from the german TBT survey 1994/1995 and laboratory
experiments. Environmental Pollution 96: 299-309.
Bezerra, L. F.; I. Braga de Castro and C. A. Rocha Barreira.
2010. Imposex occurrence in Nassarius vibex from South America: a
potencial bioindicator in estuarine environments. Marine Biodiversity Records 3
(e30): 1-4.
Bigatti, G. and P. E. Penchaszadeh. 2005.
Imposex in Odontocymbola magellanica
(Caenogastropoda: Volutidae) in Patagonia. Comunicaciones de la Sociedad
Malacológica de Uruguay 9(88): 371-375.
Boisier, S. 1986. La articulación Estado-Región: Clave del
desarrollo regional. In: H. Ávila
Sánchez (COMP.). Lecturas de Análisis Regional en América Latina y el Caribe.
Universidad Autónoma Chapingo (Ed.). México, D.F. p.309-335.
Braga de Castro, I.; C. A. Oliveira de Meirelles, H.
Matthews Cascon, C. de Almeida Rocha Barreira, P. Penchaszadeh and G. Bigatti. 2008. Imposex in endemic volutid from Northeast Brazil
(Mollusca: Gastropoda). Braz. Arch. Biol. Technol. 51(5):
1065-1069.
Braga de Castro, I.; H. Matthews Cascon e M. A. Fernández.
2000. Imposex em Thais
haemastoma (Linnaeus, 1767) (Mollusca: Gastropoda), uma indicação da contaminação por
organoestânicos na costa do município de
Fortaleza – Ceará – Brasil. Arquivo de Ciências do Mar 33: 51-56.
Bryan, G. W.; D. A. Bright, L. G.
Hummerstone and G. R. Burt. 1993. Uptake, tissue distribution and metabolism of
14C-labelled tributyltin (TBT) in the dog-whelk, Nucella lapillus.Journal of
the Marine Biological Association of the United Kingdom 73: 889-912.
Bryan, G. W.; P. E. Gibbs; L. G.
Hummerstone and G. R. Burt. 1986. The decline of the gastropod Nucella lapillus around England:
evidence for the effect of tributyltin from anti-fouling paints. Journal of the
Marine Biological Association of the United Kingdom 66: 611-640.
Caetano, C. H. S. e R. S. Absalão. 2002. Imposex in Olivancillaria vesica vesica (Gmelin) (Gastropoda, Olividae) from a
southeastern Brazilian sandy beach. Revista Brasileira de Zoologia 19: 215-218.
Cannon, L. R. G. 1975. On the
reproductive biology of Cerithium
moniliferum Kiener (Gastropoda, Cerithiidae) at Heron Island, Great Barrier
Reef. Pacific Science 29: 353-359.
Cardoso, R. S.; C. H. S. Caetano and
T. M. B. Cabrini. 2009. Biphallia in imposexed females of marine gastropods:
new record for Nassarius vivex from
Brazil. Braz. J. Biol. 69(1): 223-224.
Carvajal, R. 1973. Condiciones ambientales y productividad
en la laguna de Términos, Campeche, México. Lagena 31: 35-38.
Castillo, V. M. and D. I. Brown.
2008. Microscopic anatomy of the male reproductive system in Echinolittorina peruviana (Mollusca:
Caenogastropoda). International Journal of Morphology 26: 423-432.
Cleary, J. J. 1991. Organotin in the
marine surface microlayer and subsurface waters of south-west England: Relation
to toxicity thresholds and the U.K. Environmental Quality Standard. Marine
Environmental Research 32: 213-222.
Cortez, L.; P. Quevauviller, F.
Martin and O. F. Donard. 1993. Survey of butyltin contamination in Portuguese coastal
environments. Environmental Pollution 82 (1): 57-62.
Chau, Y. K.; R. J. Maguire, M.
Brown, F. Fang and S. P. Batchelor. 1997. Occurrence of organotin compounds in
the Canadian aquatic environment five years after the regulation of antifouling
uses of organotin. Water Quality Research Journal of Canada 32 (1): 453-521.
Ellis, D. V. and L. A. Pattisna. 1990. Wide spread
neogastropod imposex. A biological indicator of global TBT contamination.
Marine Pollution Bulletin 21: 248-253.
Fent, K. 1996. Ecotoxicology of
organotin compounds. Critical Reviews in Toxicology 26: 1-117.
Fernández, M. A.; A. M. Limaverde, I. Braga de Castro, A. C.
Martins Almeida and A. de Luca Rebelio Wagener. 2002. Ocurrence
of imposex in Thais haemastoma:
possible evidence of environmental contamination derived from organotin
compounds in Rio de Janeiro and Fortaleza, Brazil. Cadernos de Saúde Pública
18: 463-476.
Fretter, V. 1941. The genital ducts
of some British stenoglossan prosobranchs. Journal of the Marine Biological
Association of the United Kingdom 25: 173-211.
Gray, B. H.; M. Porvaznik, C.
Fleming and L. H. Lee. 1987. Tri(n)butyltin: A membrane toxicant. Toxicology
47: 35-54.
Gibbs, P. E. and G. W. Bryan. 1994.
Biomonitoring of Tributyltin (TBT) Pollution using the Imposex response of
Neogastropod Molluscs. In: J. Kees and M. Kramer (EDS). Biomonitoring of
Coastal Waters and Estuaries. CRC Press Boca Raton USA. p. 205-226.
Gibbs, P. E. and G. W. Bryan. 1986.
Reproductive failure in populations of the dog-whelk, Nucella lapillus, caused by imposex induced by tributyltin from
antifouling paints. Journal of the Marine Biological Association of the United
Kingdom 66: 767-777.
Gibbs, P.; G.W. Bryan, P. L. Pascoe
and G. R. Burt. 1987. The use of the dog-whelk, Nucella lapillus, as an indicator of tributyltin (TBT)
contamination. Journal of the Marine Biological Association of the United
Kingdom 67: 507-523.
Goldberg, R. N.; A. Averbuj, M.
Cledón, D. Luzzatto and N. Sbarbati. 2004. Search for triorganotins along the
Mar de Plata (Argentina) marine coast: finding of tributyltin in egg capsules
of snail Adelomelon brasiliana
(Lamarck, 1822) (sic) population showing imposex effects. Applied
Organometallic Chemistry 18: 117-123.
Gooding, M.; C. Gallardo and G. Leblanc.
1999. Imposex in three marine gastropod species in Chile and potential impact
on muriciculture. Marine Pollution
Bulletin 38: 1227-1231.
Gravel, P.; K. Johanning, J.
McLachlan, J. Vargas and E. Oberdörster. 2006. Imposex in the intertidal snail Thais brevidentata (Gastropoda:
Muricidae) from the Pacific coast of Costa Rica. Rev. Biol. Trop. 54 (Suppl.
1): 21-26.
Houbrick, R. S. 1980. Observations
on the anatomy and life history of Modulu
modulus (Prosobrancha: Modulidae). Malacologia 20 (1): 117-142.
Huang, C.; S. Zhu, J. Lin and Q.
Dong. 2008. Imposex of Mauritia arabica
on the south-eastern coast of China. Journal of the Marine Biological
Association of the United Kingdom 88: 1451-1457.
Huaquín, L. G.; C. Osorio, R. Verdugo and G. Collado. 2004. Morphological changes in the reproductive system
of females Acanthina monodon (Pallas,
1774) (Gastropoda: Muricidae) affected by imposex from the coast of central
Chile. Invertebrate Reproduction and Development 46: 111-117.
Instituto Nacional de Estadística y Geografía (INEGI).
2006. Segundo Conteo de Población y
Vivienda 2005. Disponible en: http://www.inegi.gob.mx. Consultado 17 de junio
de 2009).
Iwata, H.; S. Tanabe, T. Mizuno and
R. Tatsukawa. 1995. High accumulation of toxic butyltins inmarine mammals from
Japanese coastal waters. Environmental Science and Technology 29: 2959-2962.
Kannan, K. and J. Falandysz. 1997.
Butyltin residues in sediment, fish, fish-eating birds, harbour porpoise and
human tissues from the Polish coast of the Baltic Sea. Marine Pollution
Bulletin 34: 203-207.
Laughlin, R. B. and O. Linden. 1987. Tribultin - contemporary environmental
issues. Ambio 16 (5): 252–256.
Maguire, R. J.; Y. K. Chau and J. A.
J. Thompson, 1997. Proceedings of the workshop on organotin compounds in the
Canadian aquatic environment. Sidney, B.C., 19-20 February, 1996. NWRI
Contribution No. 96-153. Document to MEPC 40/11, submitted by Canada.
Mancilla, M. y M. Vargas. 1980. Los primeros estudios sobre
el flujo neto de agua a través de la Laguna de Términos, Campeche. Anales del
Centro de Ciencias del Mar y Limnología (Universidad Nacional Autónoma de
México) 7 (2): 1-12.
Marshall, D. J. and A. Rajkumar.
2003. Imposex in the indigenous Nassarius
kraussianus (Mollusca: Neogastropoda) from South African harbours. Marine
Pollution Bulletin 46: 1150-1155.
Miloslavich, P.; P. E. Penchazadeh
and G. Bugatti. 2007. Imposex en Gasterópodos de Venezuela. Ciencias Marinas 33(3): 319-324.
Nohara, M. 1999. Variation and
abnormality of genital system in Littorina
sitkana Philippi (Mollusca, Gastropoda) in Northern Japan. Zoological
Science 16: 827-838.
Penchaszadeh, P. E.; A. Averbuj and
M. Cledón. 2001. Imposex in gastropods from Argentina (South Western Atlantic).
Marine Pollution Bulletin 42: 790-791.
Phleger, F. B. and A. Ayala
Castañares. 1971. Processes and history of Terminos Lagoon, Mexico. American
Association of Petroleum Geologists 55: 2130-2140.
Reid, D. 2009. The genus Echinolittorina Habe, 1956 (Gastropoda: Littorinidae)
in the western Atlantic Ocean. Zootaxa 2184: 1-103.
Ruiz, J. M.; M. Quintela and R. Barreiro.1998. Ubiquitous imposex and organotin bioaccumulation in
gastropods Nucella lapillus from
Galicia (NW Spain): a possible effect on nearshore shipping. Marine Ecology
Progress Series 164: 237-244.
Stewart, C. 1996. The efficacy of
legislation in controlling tributyltin in the marine environment. In: S. J. De
Mora (Ed.). Tributyltin. Case study of an environmental contaminant. Cambridge
University Press, Cambridge. p. 264-296.
Tas, J. W.; A. Keizer and A.
Opperhuizen. 1996. Bioaccumulation and lethal body burden of four triorganotin
compounds. Bulletin of Environmental Contamination and Toxicology 57:
146-154.
Toral, S. 1971. Estudios de los Cichlidae (Pisces,
Perciformes) de la Laguna de Términos y sus afluentes. Tesis Profesional
Facultad de Ciencias Universidad Nacional Autónoma de México. 32 p.
Van den Broeck, H.; H. De Wolf, T.
Backeljau and R. Blust. 2009. Comparative assessment of reproductive impairment
in the gastropod mollusk Echinolittorina
littorea along the Belgian North Sea coast. Science of the Total
Environment 407: 3063-3069.
Ward, J. 1988. Antifouling paints
threaten fisheries resources. Naga: The ICLARM Quarterly, p. 15.
Yamada, H.; K. Takayanaga, M. Tateishi, H. Tagata and K.
Ikeda. 1997. Organotin compounds and
polychlorinated biphenyls of livers in squid collected from coastal waters and
open oceans. Environmental Pollution 96: 217-226.
Yáñez Arancibia, A. and J. W. Day
Jr. 1982. Ecological characterization of Terminos Lagoon, a tropical lagoon
estuarine system in the Southern Gulf of Mexico. Oceanologica Acta 5: 431-440.
Página
diseñada por Prof. Jesús Rafael Méndez Natera
TABLA DE CONTENIDO DE LA REVISTA CIENTÍFICA UDO
AGRÍCOLA



