Revista
Científica UDO Agrícola Volumen 10. Número 1. Año 2010. Páginas: 36-47
Persistencia del insecticida Clorpyrifos
en hojas y tallos de guayabo (Psidium
guajava L.)
Persistence
of Chlorpyrifos pesticide in leaves and stems of guava-tree (Psidium guajava L.)
Gretty
ETTIENE1 ![]() , Pedro
GARCÍA1, Roberto BAUZA2, Luis SANDOVAL3 y
Deisy MEDINA1
, Pedro
GARCÍA1, Roberto BAUZA2, Luis SANDOVAL3 y
Deisy MEDINA1
1Departamento de Química, Facultad de Agronomía, 2Departamento
de Química, Facultad Experimental de Ciencias e 3Instituto de
Investigaciones Agronómicas, Facultad de Agronomía. Universidad del Zulia. P.O.
Box 15205, Maracaibo, Venezuela. E-mail: gettiene@yahoo.com ![]() Autor para correspondencia
Autor para correspondencia
|
Recibido: 13/10/2009 |
Fin de arbitraje: 23/09/2010 |
Revisión recibida: 25/11/2010 |
Aceptado: 30/11/2010 |
RESUMEN
El guayabo es un cultivo cuyas hojas y ramas tienen
alto potencial medicinal, pero es atacado por la “Mota Blanca” (Capulinia sp.), que coloniza la planta y
causa su muerte y por esta razón los agricultores emplean frecuentemente
Clorpyrifos para su combate. En esta investigación se estudió la persistencia
de Clorpyrifos en hojas y tallos de tres tipos de guayabo: Criolla Roja,
Brasilera y Tamare, haciendo una sola aplicación a la dosis recomendada por el
fabricante y determinando sus niveles residuales en el tiempo (1, 5, 9, 24, 48
y 72 horas post-aplicación). Las muestras se analizaron empleando cromatografía
de gases con detección nitrógeno-fósforo. Se obtuvieron altos porcentajes de
recuperación en hojas y tallos (88,29-105,48%) para niveles de adición entre
0,025 y 0,250 µg.g-1, con bajas desviaciones estándar
relativas (0,10-6,72%) y un bajo límite de detección (0,0147 µg.g-1).
La disipación de Clorpyrifos en hojas y tallos siguió una cinética de primer
orden. Los tiempos de vida media en hojas de Criolla Roja, Brasilera y Tamare
fueron: 9,42; 12,47 y 10,60 horas, respectivamente y para tallos 12,33; 13,18 y
11,87 horas, respectivamente. Estos resultados indican que la persistencia es
mayor en tallos que en hojas (P<0,01), debido posiblemente a que los tallos
están protegidos de la exposición directa a los rayos solares por las hojas,
por lo que la disipación del insecticida por efectos de volatilización y
fotodegradación es menor. Adicionalmente, se determinó que la disipación en
hojas ocurrió en el siguiente orden: Brasilera>Tamare>Criolla Roja
(P<0,01) y en tallos: Brasilera>CriollaRoja>Tamare (P<0,01).
Palabras
clave: Persistencia, insecticida
organofosforado, tiempo de vida media, Psidium
guajava.
ABSTRACT
The guava is a crop whose leaves and stems have
high medicinal potential, but is attacked by the “Guava Cottony Scale” (Capulinia sp.), which colonizes the
plant and cause his death, and farmers often employ Chlorpyrifos for combat.
This study examined the persistence of Chlorpyrifos in leaves and stems of
three types of guava: Red Native, Brazilian and Tamare, with a single
application at the recommended dose by the manufacturer and determine their
residual levels in time (1, 5, 9, 24, 48 and 72 hours post application). The
samples were analyzed using gas chromatography with nitrogen-phosphorus
detection. There were high percentages of recovery in leaves and stems
(88.29-105.48%) to addition levels between 0.025 and
0.250 μg.g-1, with low relative standard deviations
(0.10-6.72%) and a low detection limit (0.0147 μg.g-1).
Chlorpyrifos dissipation in leaves and stems followed a first order kinetics.
The half-life times in leaves of Red Native, Brazilian and Tamare were 9.42,
12.47 and 10.60 hours, respectively and in stems: 12.33, 13.18 and 11.87 hours,
respectively. These results indicate that the persistence is greater in stems
than in leaves (P<0.01), due possibly to the stems are protected by the
leaves causing exposure to sunlight is less, reducing the dissipation of the
insecticide by volatilization and photodegradation effects. Additionally, it
was determined that the dissipation in leaves occurred in the following order:
Brazilian>Tamare>Red Native (P<0.01) and in stems: Brazilian>Red
Native>Tamare (P<0.01).
Key words: Persistence, organphosphorus
pesticide, half-lives, guava.
INTRODUCCIÓN
“Mota
Blanca del Guayabo” (MBG) es el nombre común de una especie de escama que
comúnmente se consigue formando colonias en las plantas de guayabo (Psidium guajava L.), principalmente
sobre tallos y ramas; es un insecto hemíptero de la familia Eriococcidae
considerado altamente nocivo para este cultivo (Cermeli y Geraud, 1997; Camacho
et al., 2002).
Las infestaciones por la MBG han
representado el mayor problema entomológico en la producción del cultivo del
guayabo en el ámbito nacional, continental y muy probablemente mundial (Geraud y Chirinos,
1999; Geraud et al., 2001). Estudios realizados por expertos en el
control de plagas han demostrado la alta efectividad de un insecticida
organofosforado (fosforotionato) denominado Clorpyrifos, en el control de la
MBG (Chirinos et al., 2000; Chirinos et al., 2007), pero que puede resultar
contraproducente por su toxicidad (ATSDR, 1997; Vargas y Ubillo, 2001; Dow AgroSciences, 2003; Badii
y Varela, 2008). En el estado Zulia se evaluó la persistencia de Clorpyrifos en
frutos de guayabo luego de su aplicación al cultivo, a la dosis recomendada por
el fabricante (Sánchez et al., 2005),
sin embargo, se desconoce cuánto tiempo permanece el insecticida en las hojas y
los tallos de las plantas después de ser aplicado.
El guayabo, además de las propiedades
nutricionales de sus frutos (Arenas et al.,
1999; Laguado et al., 1999; Medina et al., 2003), posee un importantísimo
potencial medicinal en sus hojas, ramas y raíces (Conde et al., 2003; Shaheen et al.,
2000; Ojewole, 2005; Pérez et al., 2008; Won et al., 2005), por los
componentes bioquímicos presentes en ellos, principalmente taninos, fenoles,
triterpenos y flavonoides, que los convierten en posibles fuentes de fármacos
para el combate de parásitos causantes o coadyuvantes de diversas enfermedades
estomacales e intestinales y, también, para el combate de enfermedades
degenerativas, cardiopáticas y cancerígenas, por sus propiedades antioxidantes
y acción cardioactiva (Begum et al., 2002; Conde et al., 2003; Jaiarj et al., 1999; Lozoya et al., 1994; Lozoya
et al., 2002; Lutterodt y Maleque,
1988; Pérez
et al., 2008; Vargas
et al., 2006), lo que justifica el estudio de los factores que
pueden interferir y comprometer esa potencialidad.
El objetivo de este trabajo
fue determinar la persistencia del insecticida Clorpyrifos en hojas y tallos de
tres tipos o selecciones de guayabo: Criolla Roja, Brasilera y Tamare, en
diferentes momentos después de su aplicación.
MATERIALES Y MÉTODOS
El
estudio de disipación del Clorpyrifos en el tiempo, en las muestras de hojas y
tallos de tres tipos de guayabo requirió un experimento diseñado totalmente al
azar con un arreglo de tratamientos de parcelas divididas en el tiempo,
ubicando como parcela principal los efectos del tipo de guayabo y órgano (tallo
y hoja) y como parcela secundaria el efecto del tiempo. Se utilizaron los tipos
de guayabo: “Criolla Roja”, “Brasilera” y “Tamare”, por ser de los más
disponibles y, además, por estar presentes en el Umbráculo de la Facultad de
Agronomía de la Universidad del Zulia, Maracaibo, Venezuela, ubicado en la
coordenadas 10º34’00” LN, 71º44’00” LO y en una zona clasificada
agroecológicamente como de bosque seco tropical; altitud: 6 msnm; precipitación
media anual: 510 mm; temperaturas promedio mínima y máxima: 25 y 32 °C,
respectivamente. Sitio del que se obtuvo el material vegetal y en el cual se
desarrolló la parte de campo de la experiencia.
Los tipos de guayabo
utilizados en esta investigación no pueden ser considerados como variedades,
sino más bien selecciones o variantes de Psidium
por las razones expuestas por Molero et
al. (2003) y Sánchez et al.
(2007). Criolla Roja, Brasilera y Tamare son los nombres con los que comúnmente
se conocen estos cultivares de guayabo en las zonas de producción, lo que se ha
denominado “variedad del agricultor” como indica Sánchez et al. (2007). Criolla Roja es una de las variantes de Psidium más utilizada por los
productores locales y Tamare es una selección denominada técnicamente como
AGROLUZ-14, establecida en el campo experimental del Centro Socialista de Investigación
y Desarrollo Frutícola (CESID Frutícola y Apícola) de CORPOZULIA (Molero et al.,
2003). No hay información publicada sobre el tipo Brasilera, sin embargo, se ha
conocido por vía oral que es una variante de Psidium que fue introducida en la zona del Sur del Lago de
Maracaibo por un productor que trajo semillas de este guayabo de Brasil.
Se hizo una única aplicación del
insecticida y al inicio del experimento. Se aplicó el producto comercial
Lorsban 4E (ingrediente activo Clorpyrifos 48%) a las plantas involucradas, a
la dosis sugerida por el fabricante (1 cm3/L de agua), utilizando 2
L de insecticida para cada uno de los dos tipos de guayabo Criolla Roja y
Tamare y 1 L para el tipo Brasilera, debido a las diferencias de desarrollo
morfológico de las plantas de estos tres tipos de guayabo.
La persistencia del Clorpyrifos se
evaluó, en las muestras vegetales, durante un período en el que se realizaron
seis muestreos espaciados en el tiempo, a 1, 5, 9, 24, 48 y 72 horas, después
de la aplicación. La experiencia no pudo ser prolongada más allá de las 72
horas por problemas técnicos imprevistos, relativos a la fuente de suministro
del material vegetal utilizado en el experimento.
Por
las cuestiones de disponibilidad de material de experimentación y manejo en el
laboratorio en las determinaciones de Clorpyrifos se consideró lo siguiente: En
tallo, se estableció como unidad experimental una rama. Cada muestreo de tallo
consistió de tres ramas por tipo de guayabo, con lo que se conformaron tres
repeticiones de tallo por tipo de guayabo y muestreo, para un total de 54
muestras de ramas en el experimento (3 ramas x 3 tipos de guayabo x 6 muestreos
en el tiempo). En hoja, se consideró tomar 10 hojas por rama como unidad
experimental, para conformar 3 repeticiones por cada tipo de guayabo por
muestreo, lo que totalizaría 540 muestras de hojas colectadas (10 hojas x 3
ramas x 3 tipos de guayabo x 6 muestreos en el tiempo) en el experimento.
En los muestreos se empleó una
metodología de selección aleatoria de las ramas, se cuidó en lo posible que
fueran de longitudes y número de hojas similares, recientemente maduras, de
brotes no fructificados y de la periferia y parte media de la copa de los
árboles (Rendiles et al., 2004). Las
muestras de hojas se obtuvieron de cada una de estás ramas, tratando de que
fueran de igual tamaño y tomadas en dirección del ápice hacia la base de la
rama.
En cada muestreo, el material vegetal colectado fue llevado de
inmediato y debidamente protegido a la Sección de Cromatografía del
Instituto de Investigaciones Agronómicas
de la Facultad de Agronomía de la Universidad del Zulia, donde se hizo la
separación de ramas y hojas, para su posterior procesamiento por separado.
Todos los materiales se homogenizaron con un procesador de alimentos marca
Oster.
La preparación de las muestras de hojas y tallos de cada uno de los
tipos de guayabo Criolla Roja, Tamare y Brasilera para la extracción del
Clorpyrifos se realizó mediante la combinación de extracción
asistida con ultrasonido y limpieza en fase sólida con carbón grafitado,
mediante la metodología descrita en Ettiene et
al. (2010).
En la
evaluación de la eficiencia del método de análisis se empleó un estándar de alta
pureza (99,0%) del insecticida Clorpyrifos, del laboratorio Dr. Ehrenstorfer
GMBH (Ausburg, Alemania) para preparar la solución madre (2000 μg.mL-1)
en acetato de etilo grado HPLC (Baker, U.S.A), a partir de la cual se
prepararon las soluciones de trabajo: calibración y salpicado, por dilución con
acetato de etilo y metanol en grado HPLC, respectivamente; estás soluciones se
almacenaron en oscuridad a 4 °C.
Se utilizó como estándar interno
trifenilfosfato (TPP) con 99,0% de pureza (Riedel de Haën). Los solventes
empleados para el desarrollo de este trabajo fueron: acetona (99,8% de pureza,
Riedel de Haën), acetato de etilo y n-hexano (98,5% de pureza, E.M. Science),
diclorometano y acetonitrilo (99,9% de pureza, Fisher Scientific Company). La
cuantificación se realizó empleando un cromatógrafo de gases Perkin Elmer
Autosystem, equipado con una columna capilar DB-17 de 30 m x 0,53 mm D.I. x 1
μm de espesor de una película de 50% fenil metil polisiloxano, un detector
nitrógeno-fósforo y un inyector automático Perkin Elmer. La cuantificación de
los residuos se realizó por estándar interno, empleando TPP. El tiempo total de
la corrida fue de 30 min. Se usó como gas de arrastre: He a 10 mL.min-1;
gas del detector: H2
1,70 mL.min-1;
Aire: 100 mL.min-1; temperatura del inyector: 250ºC; temperatura del detector: 280ºC; umbral del detector: 0,75 mV;
programa del horno: 0T1: 60ºC, por 0,80 min; rampa 1: 40ºC.min-1 -
160ºC; rampa 2: 3,5ºC.min-1 - 230ºC; rampa 3: 8ºC.min-1 -
280ºC por 1 min.; inyección: modo Split Less con
apertura de válvula a los 0,80 min.
Con los métodos de extracción y limpieza
optimizados se evaluó la disipación de Clorpyrifos en las muestras de hojas y
tallos de los tres tipos de guayabo estudiados. Se determinaron los niveles
residuales en función del tiempo, a 1, 5, 9, 24, 48 y 72 horas después de la
aplicación y, posteriormente, se calcularon los tiempos de vida media y la
cinética de disipación del insecticida como lo indica Sánchez et al. (2005), a su vez, se evaluaron
funciones matemáticas para determinar los mejores ajustes del comportamiento de
la disipación de Clorpyrifos en el tiempo, en cada uno de los tres tipos de
guayabo.
Los datos se analizaron estadísticamente
con medidas de tendencia central y dispersión (media, desviación estándar,
desviación estándar relativa), análisis de varianza con pruebas de separación
de medias, análisis de correlación lineal y análisis de regresión. Los análisis
de regresión se realizaron con el software de Hyams (2010).
RESULTADOS Y DISCUSIÓN
El método de análisis basado
en la combinación de extracción asistida con ultrasonido y limpieza en
fase sólida con carbón grafitado permitió
obtener altos porcentajes de recuperación de Clorpyrifos, tanto en hojas como
en tallos (88,29-105,48%) para niveles de adición entre 0,025 y 0,250 µg.g-1,
con bajas desviaciones estándar relativas (0,10-6,72%) y un bajo límite de
detección (0,0147 µg.g-1). Los porcentajes de
recuperación de Clorpyrifos y sus respectivas desviaciones estándar relativas
para hojas y tallos de los tres tipos de guayabo estudiados, con niveles de
adición entre 0,025 y 0,250 µg.g-1 han sido reportados
por Ettiene et al. (2010).
El seguimiento de la disipación de
Clorpyrifos desde el día de la aplicación de la formulación comercial hasta el
día 3 se presenta en el cuadro 1. Se observan los valores obtenidos de las
concentraciones residuales de Clorpyrifos en las muestras de hojas de guayabo
de los tipos Criolla Roja, Brasilera y Tamare.
|
Cuadro 1. Residuos de Clorpyrifos (en μg.g-1
y porcentaje) en hojas de guayabo (Psidium
guajava L.). |
|||||||||
|
Horas después de la aplicación |
Tipo de guayabo |
||||||||
|
Criolla Roja |
Brasilera |
Tamare |
|||||||
|
|
(DER) |
% |
|
(DER) |
% |
|
(DER) |
% |
|
|
1 |
56,59 |
(1,01) |
100,00 |
26,75 |
(1,58) |
100,00 |
68,44 |
(2,48) |
100,00 |
|
5 |
24,58 |
(0,28) |
43,44 |
20,27 |
(0,36) |
75,78 |
36,29 |
(0,79) |
53,02 |
|
9 |
35,37 |
(1,28) |
62,50 |
25,18 |
(0,46) |
94,13 |
49,98 |
(1,72) |
73,03 |
|
24 |
5,00 |
(0,25) |
8,84 |
5,75 |
(0,07) |
21,50 |
7,81 |
(0,11) |
11,41 |
|
48 |
2,20 |
(0,04) |
3,89 |
2,49 |
(0,14) |
9,31 |
4,48 |
(0,11) |
6,55 |
|
72 |
1,53 |
(0,03) |
2,70 |
2,27 |
(0,20) |
8,49 |
2,80 |
(0,10) |
4,09 |
|
|
|||||||||
La concentración de
Clorpyrifos determinada una hora después de la aplicación al tipo de guayabo
Criolla Roja fue de 56,59 μg.g-1, es considerada como la
concentración inicial (100,00%). Cuatro horas más tarde (quinta hora) se
observó un descenso de 32,01 μg.g-1, que corresponde a un 56,56%
de disipación con respecto a la concentración de la primera hora post
aplicación. En la determinación de la novena hora se observó un incremento de
10,79 μg.g-1 con respecto a la segunda medición, lo cual no es
un comportamiento esperado, sin embargo, Liapis et al. (1994), quienes estudiaron la disipación de Monocrotofos en
tomates y reportan un comportamiento similar, atribuyeron la brusca disminución
de la concentración del insecticida a la volatilización y el posterior
incremento de la concentración a la adhesión del insecticida al órgano y a su
subsecuente penetración. Sánchez et al.
(2005) destacan que Clorpyrifos se clasifica como un insecticida de contacto,
pero presenta un ligero poder de penetración en el tejido, por lo que este
comportamiento no ideal en la hoja posiblemente se deba a esos mismos factores:
volatilización que disminuyen la concentración del insecticida y
adhesión-penetración que aumentan su concentración.
Después de 24 horas de la aplicación del
insecticida la concentración en la muestra de hojas de guayabo Criolla Roja
disminuyó bruscamente hasta 5,00 μg.g-1, correspondiendo a un
91,16% de disipación en relación a la concentración medida la primera hora. La
disipación del insecticida siguió aumentando en forma progresiva los días dos y
tres, con porcentajes de disipación de 96,11 y 97,30%, respectivamente, en
relación a la concentración de la primera medición.
El comportamiento matemático de la
disminución de la concentración residual de Clorpyrifos en las hojas de guayabo
tipo Criolla Roja que se observa en la Figura 1 se ajustó más adecuadamente al
modelo conocido como modelo de Hoerl, que pertenece a la familia de los modelos
de potencia (Hyams, 2010) y su ecuación específica es: ![]() , R2 = 0,9111.
, R2 = 0,9111.
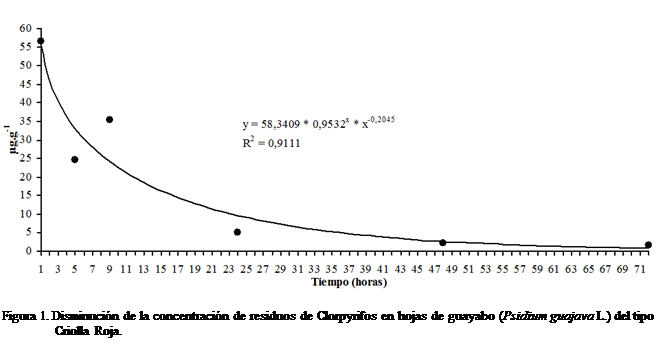
La determinación de la
cinética de disipación del insecticida se hizo graficando el logaritmo
neperiano de la concentración versus el tiempo transcurrido después de la
aplicación (Ettiene et al., 2005 y
Ettiene et al., 2006). Esta
representación gráfica muestra una línea recta con un r = -0,9382 (P<0,01),
lo que indica que la velocidad de disipación de Clorpyrifos en hojas de guayabo
del tipo Criolla Roja sigue una cinética de primer orden, con un tiempo de vida
media de 9,42 horas y una alta correlación negativa entre los residuos de
Clorpyrifos y el tiempo. La ecuación matemática correspondiente es: ![]() , R2 = 0,8802.
, R2 = 0,8802.
En términos generales, el
comportamiento de la disipación del Clorpyrifos en las hojas de guayabo del
tipo Brasilera fue similar al observado en Criolla Roja. La concentración del
insecticida determinada en la primera hora fue de 26,75 μg.g-1
(100,00%), menor que la de Criolla Roja posiblemente debido al menor volumen de
solución insecticida aplicado a este tipo de guayabo.
A la quinta hora después de la aplicación
se observó una reducción de 6,48 μg.g-1, que corresponden a un porcentaje
de disipación de Clorpyrifos de 24,22 %, con respecto a la concentración de la
primera hora; luego hubo un incremento de la concentración de los residuos en
la novena hora (25,18 μg.g-1), equivalente a un 94,13% de la
concentración inicial) en relación a la concentración de la quinta hora (20,27
μg.g-1), de 4,91 μg.g-1, que se justifica
igualmente como en el caso de Criolla Roja, por lo explicado por Liapis et al. (1994) y Sánchez et al. (2005), como un efecto de la
penetración del insecticida en el tejido de las hojas muestreadas.
Los porcentajes de
disipación de Clorpyrifos en hojas de guayabo del tipo Brasilera los días uno,
dos y tres, con respecto a la primera hora de muestreo, fueron 78,50%, 90,69% y
91,51%, respectivamente. La representación gráfica del comportamiento de la
disipación de Clorpyrifos en hojas de guayabo del tipo Brasilera en el tiempo
se muestra en la Figura 2. Este comportamiento se corresponde más adecuadamente
con el descrito por el modelo de Harris, el cual pertenece a la familia de los
modelos de rendimiento y densidad, según el análisis hecho con el software de
Hyams (2010). La ecuación matemática correspondiente es: ![]() , R2 = 0,9336.
, R2 = 0,9336.
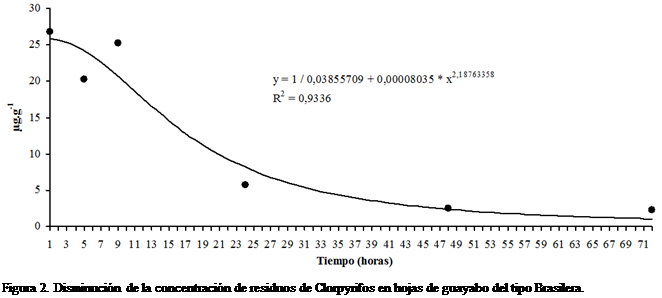
La cinética de disipación de Clorpyrifos
en hojas de guayabo del tipo Brasilera fue de primer orden, con tiempo de vida
media de 12,47 horas y coeficiente de correlación r = -0,9397 (P<0,01). La
ecuación matemática correspondiente es: ![]() con R2 =
0,883.
con R2 =
0,883.
En el caso de las hojas
de guayabo del tipo Tamare, la disipación de Clorpyrifos presentó un
comportamiento como el descrito para los tipos Criolla Roja y Brasilera; la
concentración de Clorpyrifos determinada la primera hora fue de 68,44 μg.g-1
(concentración inicial, 100,00%), produciéndose un descenso a 36,29 μg.g-1
(53,02% de la inicial) en la quinta hora, que representa una disminución de
32,15 μg.g-1, lo que corresponde a un 46,98 % de disipación con
respecto a la concentración inicial. En la novena hora se presentó el mismo
fenómeno observado en los casos de Criolla Roja y Brasilera: la concentración
se incrementó a 49,98 μg.g-1 (73,03% de la inicial), 13,69
μg.g-1 más que la concentración de la quinta hora de muestreo,
posiblemente por las razones expuestas por Liapis et al. (1994) y Sánchez et al.
(2005).
Entre las 24 y 72 horas
después de la aplicación del Clorpyrifos los residuos disminuyeron con
porcentajes de disipación de 88,59 % el primer día, 93,45 % el segundo día y
95,91 % el tercer día, en relación a la concentración residual determinada en
la primera hora después de la aplicación. La Figura 3 muestra la disminución de
la concentración residual de Clorpyrifos en hojas de guayabo del tipo Tamare,
en el tiempo. El mejor ajuste de este comportamiento se logró con el modelo de
Hoerl (Hyams, 2010) y la ecuación matemática correspondiente es: ![]() , R2 = 0,9039.
, R2 = 0,9039.
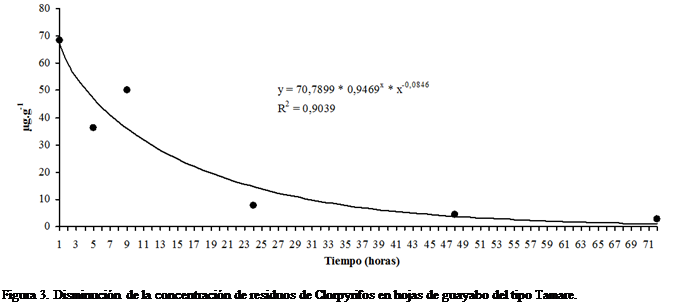
El gradiente de reducción de la
concentración de residuos de Clorpyrifos en muestras de hojas de guayabo del
tipo Tamare siguió una cinética de primer orden, con un tiempo de vida media de
10,60 horas y un coeficiente de correlación lineal r = -0,9388 (P<0,01), indicando un decrecimiento lineal en el
tiempo que se corresponde con el modelo matemático: .![]() , con R2 = 0,8813.
, con R2 = 0,8813.
El análisis de los
tiempos de vida media determinados para Clorpyrifos en muestras de hojas de
guayabo Criolla Roja, Brasilera y Tamare indica que el insecticida demuestra
mayor persistencia en el orden siguiente: Brasilera > Tamare > Criolla
Roja (P<0,01), Este resultado posiblemente se pueda atribuir a la
variabilidad genética de los tipos de guayabo Criolla Roja, Tamare y Brasilera.
Esta variabilidad ya ha sido verificada por Molero, et al. (2003) en las poblaciones de guayabo establecidas en el
municipio Mara del estado Zulia, de donde provienen las plantas utilizadas en
esta investigación, y que también ha sido corroborada por Sánchez et al. (2007); sin embargo, el
comportamiento de la disipación de Clorpyrifos en los tres tipos de guayabo fue
similar, con cinéticas de disipación de primer orden.
En el cuadro 2 se presentan los valores
de concentración residual de Clorpyrifos correspondientes a las muestras de
tallo, que fueron determinados en el tiempo, luego de la aplicación del insecticida
a las plantas de guayabo Criolla Roja, Brasilera y Tamare. Se aprecian
comportamientos de la disipación del Clorpyrifos muy similares a los observados
en las muestras de hoja, para todos los tipos de guayabo.
|
Cuadro 2. Residuos de Clorpyrifos (μg.g-1
y %) en tallos de guayabo (Psidium
guajava L.). |
|||||||||
|
Horas
después de de aplicación |
Tipo de guayabo |
||||||||
|
Criolla
Roja |
Brasilera |
Tamare |
|||||||
|
|
(DER) |
% |
|
(DER) |
% |
|
(DER) |
% |
|
|
1 |
41,80 |
(1,99) |
100,00 |
11,24 |
(0,29) |
100,00 |
47,28 |
(1,27) |
100,00 |
|
5 |
13,52 |
(0,38) |
32,34 |
4,94 |
(0,07) |
43,95 |
17,81 |
(2,00) |
37,67 |
|
9 |
21,17 |
(0,42) |
50,65 |
6,55 |
(0,16) |
58,27 |
32,91 |
(0,78) |
69,61 |
|
24 |
4,53 |
(0,32) |
10,84 |
2,41 |
(0,070 |
21,44 |
6,21 |
(0,26) |
13,13 |
|
48 |
2,50 |
(0,02) |
5,98 |
0,89 |
(0,01) |
7,92 |
3,08 |
(0,05) |
6,51 |
|
72 |
2,14 |
(0,04) |
5,12 |
0,79 |
(0,01) |
7,03 |
2,50 |
(0,03) |
5,29 |
|
|
|||||||||
La concentración residual de Clorpyrifos
una hora después de la aplicación en las muestras de tallo de Criolla Roja fue
de 41,80 μg.g-1 y de 13,52 μg.g-1 en la quinta
hora (100,00% y 32,34%, respectivamente), observándose una reducción de 28,28
μg, lo que representa una disipación del 67,66%. En la novena hora de
muestreo nuevamente se observa un incremento inesperado (7,65 μg más) con
respecto a la quinta hora (21,17 μg.g-1), lo que hace suponer
que en muestras de tallos el comportamiento del insecticida el primer día de
muestreo se ve afectado también por el poder de penetración del Clorpyrifos en
el tejido de las muestras (Sánchez et al.,
2005).
La disipación de
Clorpyrifos en los tallos de guayabo Criolla Roja fue en aumento progresivo
después del primer día luego de su aplicación, con porcentajes de 89,16%,
94,02% y 94,88%, los días uno, dos y tres, respectivamente. La Figura 4
presenta el comportamiento de la concentración residual de Clorpyrifos en el
tiempo en muestra de tallos de guayabo Criolla Roja. El mejor ajuste de los
datos para este comportamiento se obtuvo con el modelo de Hoerl (Hyams, 2010) y
la ecuación obtenida es: ![]() con R2 =
0,9222.
con R2 =
0,9222.
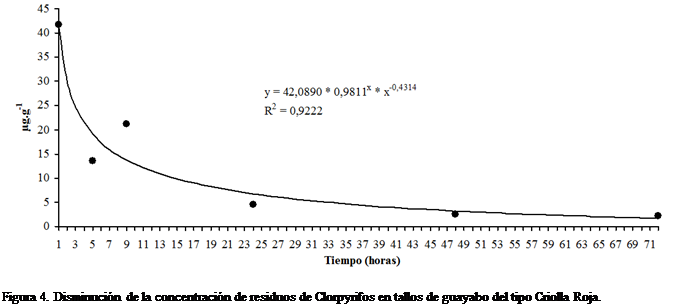
La velocidad de disipación
del insecticida en tallos de guayabo Criolla Roja siguió una cinética de primer
orden, con tiempo de vida media de 12,33 horas, mayor que el tiempo de vida
media para hojas en este mismo tipo de guayabo, con coeficiente de correlación
r = -0,9021 (P<0,01), lo que indica que la disipación de Clorpyrifos en este
tipo de muestra es decreciente y se resume en la siguiente ecuación lineal: ![]() , con coeficiente de determinación igual a 0,8138.
, con coeficiente de determinación igual a 0,8138.
En los tallos de guayabo
Brasilera la concentración residual de la primera hora después de la aplicación
fue de 11,24 μg.g-1 y 4,94 μg.g-1 en la quinta
hora (100,00% y 43,95%, respectivamente), produciéndose una reducción de 6,30
μg, que representa un porcentaje de disipación de 56,05%. En la novena
hora se observó, como en los casos anteriores, un incremento en la
concentración residual del Clorpyrifos en las muestras de tallo de Brasilera de
1,61 μg, con respecto a la concentración de la quinta hora.
Los días uno, dos y tres el porcentaje de
disipación en tallos de Brasilera fue de 78,56%, 92,08% y 92,97%
respectivamente. La Figura 5 muestra la disipación de Clorpyrifos con el tiempo
en tallos de guayabo del tipo Brasilera.
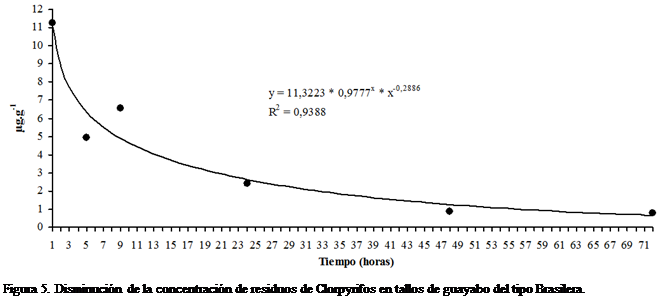
El comportamiento de esta disipación se
puede explicar matemáticamente de forma más adecuada con el modelo de Hoerl
(Hyams, 2010) y la ecuación de ajuste es: ![]() , con coeficiente de determinación igual a 0,9388.
, con coeficiente de determinación igual a 0,9388.
La cinética de disipación
de Clorpyrifos en tallos de Brasilera fue de primer orden, con tiempo de vida
media de 13,18 horas, mayor que el obtenido en hojas del mismo tipo de guayabo,
con r = -0,9445 (P<0,01), indicando una fuerte correlación lineal inversa de
la concentración del insecticida con el tiempo. La ecuación lineal que describe
la cinética de disipación de Clorpyrifos en tallos de guayabo del tipo
Brasilera es: ![]() , con R2 = 0,892.
, con R2 = 0,892.
La disipación de Clorpyrifos en tallos de
guayabo del tipo Tamare muestra el mismo comportamiento observado en Criolla
Roja y Brasilera, con un valor de concentración la primera hora después de la
aspersión de 47,28 μg.g-1 (concentración inicial, 100,00%),
disminuyendo rápidamente a la quinta hora de muestreo a 17,81 μg.g-1
(37,67% de la inicial), lo que corresponde a un 62,33% de disipación;
nuevamente, a la novena hora se determinó un incremento de la concentración
residual de Clorpyrifos (15,1 μg), en relación a la concentración
observada en la quinta hora.
El primer día luego de la
aspersión el porcentaje de disipación fue de 86,87%, el segundo día fue de
93,49% y el tercer día de 94,71%, con respecto a la concentración de la primera
hora. La Figura 6 muestra la reducción en el tiempo de la concentración
residual de Clorpyrifos en tallos de guayabo Tamare. Este comportamiento se
corresponde, según el análisis de regresión realizado con el software de Hyams
(2010), al modelo de Hoerl y la ecuación matemática que aporta el mejor ajuste
(R2 = 0,8483) de los datos es: ![]() .
.
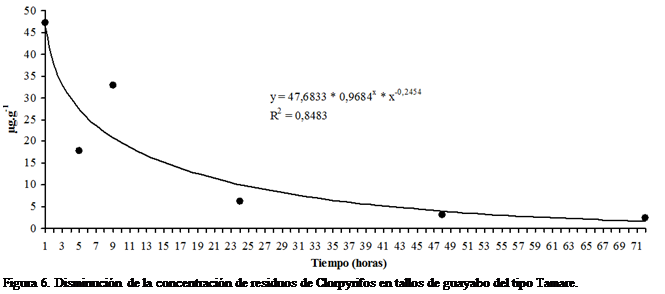
La cinética de disipación de Clorpyrifos
en tallos de Tamare fue determinada como de primer orden, con tiempo de vida
media de 11,87 horas, resultando mayor que en hojas, y con un coeficiente de
correlación r = -0,9177 (P<0,01), correspondiéndose con la ecuación lineal: ![]() y R2 =
0,8422.
y R2 =
0,8422.
El tiempo de vida media en la disipación
de Clorpyrifos en los tallos de guayabo del tipo Brasilera resultó mayor que el
de Criolla Roja y el de Tamare y, a su vez, el de Criolla Roja mayor que el de
Tamare (P<0,01), lo que puede representarse con la siguiente desigualdad:
Brasilera > Criolla roja > Tamare. Este resultado en tallos, al igual que
en el caso de hojas, posiblemente sea consecuencia de la variabilidad genética
ya mencionada por Molero, et al.
(2003) y por Sánchez et al., (2007).
Por otra parte, el tiempo promedio de vida media de Clorpyrifos en tallos
(12,46 horas) resultó significativamente mayor (P<0,01) que el observado en
hojas (10,83 horas), esto posiblemente pueda deberse a que gran parte de los
tallos de la planta de guayabo están cubiertos y protegidos por las hojas, lo
que ocasiona que la exposición al sol sea indirecta y, por lo tanto, la
incidencia de los rayos solares menor, retardándose la disipación del
insecticida por efectos de volatilización y fotodegradación. Como indican
Lartiges y Garrigues (1995), Kumar et al.,
(2007) y Badii y Landeros, (2007) el comportamiento, persistencia y degradación
de los insecticidas está influido por muchos factores, ambientales y de otra
índole, entre los que destacan la temperatura ambiental, la humedad, el pH, la
composición química del insecticida, las partículas presentes en el medio, la
luz, biodegradación por sistemas microbianos, entre otros. La temperatura
ambiental y la humedad son los factores más influyentes en la degradación de
Clorpyrifos en muestras de suelo, indica Castro (2002), así mismo, indica que
el 50% de la cantidad de Endosulfan aplicada a hojas de tomate se volatilizó en
apenas 48 horas, lo que demuestra la influencia de la presión de vapor del
insecticida en su degradación y la existencia de emisiones a la atmosfera del
insecticida en las zonas donde se aplica.
Es posible también que la rugosidad de la
superficie de los tallos en contraposición a la superficie más lisa de las
hojas (haz), que además presentan una capa de cera cuticular (lípidos solubles
cuticulares), sea otra de las razones por las cuales el Clorpyrifos en los
tallos presente mayor tiempo de vida media y se aprecie una disipación más
lenta de los residuos del insecticida en los tallos de todos los tipos de
guayabo. Se conoce que la rugosidad de la superficie, así como la presencia de
pelos o tricomas y otros tipos de protuberancias observables en los tallos,
aumentan la retención del insecticida y que la cera epicuticular de las hojas
desfavorece la retención (Dale, 2007). El límite máximo de residuos (LMRs)
indicado por el Codex Alimentarius para guayaba es 0,5 μg.g-1 y
el nivel crítico de ingestión diaria admisible (IDA) 0,010 μg.g-1
(FAO/OMS. CODEX ALIMENTARIUS. 1993). Tanto en las muestras de hojas como en las
de tallos de todos los tipos de guayabo las concentraciones residuales de
Clorpyrifos, incluso hasta el tercer día, fueron muy superiores al IDA y al
LMRs de la FAO/OMS. Las concentraciones de Clorpyrifos al tercer día para hojas
de Criolla Roja, Brasilera y Tamare fueron 1,03, 1,77 y 2,30 μg.g-1
mayores, respectivamente, que el LMRs del Codex Alimentarius, y las de tallo
fueron 1,64, 0,29 y 2,00 μg.g-1.
Comparando las concentraciones residuales
de Clorpyrifos para el tercer día, en las muestras de hojas y tallos de los
tres tipos de guayabo estudiados, con el valor reportado por Sánchez et al, (2005), determinado en frutos de
guayabo, que fue de 0,027 μg.g-1, al tercer
día de disipación, se observa una reducción aparentemente mucho más acelerada
de la concentración de Clorpyrifos en los frutos que en las hojas y tallos de
guayabo. El tiempo de vida media obtenido para Clorpyrifos por Sánchez et al. (2005) fue de 2,32 días (55,68
horas), que contrasta notablemente con los obtenidos en esta investigación, que
estuvieron en todos los casos por debajo de las 15 horas, probablemente debido
a que en el ensayo de Sánchez la disipación del Clorpyrifos se evaluó hasta el
día once, lo que posibilitó la acción de los factores ambientales: luz solar,
lluvia, humedad relativa, temperatura, así como la actividad de microorganismos
cuyas enzimas pueden modificar la estructura química del insecticida (Dale 2007; Kumar et al., 2007). Khan
(2005) obtuvo concentraciones residuales de Clorpyrifos que variaron entre 1,60
y 2,39 μg.g-1 (según el
método de cuantificación HPTLC o HPLC y el período de estudio) para el tercer
día de disipación, en muestras de melocotón y entre 2,08 y 3,24 μg.g-1 en muestras de manzana,
valores estos superiores al LMR del Codex Alimentarius y que no fueron muy
diferentes a los determinados en esta investigación. Khan (2005) también
estudió la disipación en guayaba y obtuvo concentraciones residuales de otros
insecticidas organofosforados que variaron según el método de cuantificación
(HPTLC o HPLC), el período de estudio y la composición química del insecticida,
para el tercer día de disipación, entre 1,20 y 2,21 μg.g-1, igualmente superiores al LMR
del Codex Alimentarius.
Según
estos resultados, tres días después de la aplicación de Clorpyrifos no es un
tiempo de espera suficiente para utilizar las hojas y tallos de guayabo de
cualquiera de los tipos estudiados (Criolla Roja, Brasilera o Tamare) con la
seguridad de que no posean concentraciones de residuos de Clorpyrifos a niveles
que se puedan considerar por el Codex Alimentarius como inocuos para la salud
humana.
CONCLUSIONES
La cinética de disipación
de Clorpyrifos tanto en hojas como en tallos, para los tres tipos de guayabo
Criolla Roja, Brasilera y Tamare, ocurre en forma lineal decreciente con
respecto al tiempo, después de la aplicación del insecticida, por lo que puede
establecerse como de primer orden.
El tiempo de vida media de Clorpyrifos es
mayor en tallos (12,46 horas) que en hojas (10,83 horas) de guayabo.
La secuencia de disipación del
Clorpyrifos en hojas es Brasilera (12,47 horas) > Tamare (10,60 horas) >
Criolla Roja (9,42 horas).
La secuencia de disipación del
Clorpyrifos en tallos es Brasilera (13,18 horas) > Criolla Roja (12,33
horas) > Tamare (11,87 horas).
Tres
días no es un tiempo de espera suficiente para la utilización de hojas y tallos
de guayabo en los que se haya aplicado Clorpyrifos a la dosis recomendada por
el fabricante.
LITERATURA
CITADA
Agencia
para Sustancias Tóxicas y el Registro de Enfermedades (ATSDR). 1997.
Clorpirifos. CAS # 2921-88-2. http://www.atsdr.cdc.gov/es/. (Consultado el 07
de Noviembre de 2010).
Almeida, C. E.; M. G. O. Karnikowski, R. Foleto and
B. Baldisserotto. 1995. Analysis of antidiarrhoeic effect of plants used in
popular medicine. Rev. Saûde Pública 29 (6): 428-433.
Arenas de M., L.; M. Marín, D. Peña, E. Toyo y L.
Sandoval. 1999. Contenido de humedad, materia seca y cenizas totales en
guayabas (Pisidium guajava L.) cosechadas en granjas del municipio Mara
del estado Zulia. Rev. Fac. Agron. (LUZ) 16 (1): 1-10.
Badii, M. H. y J. Landeros. 2007. Plaguicidas que
afectan a la salud humana y la sustentabilidad. CULCyT. Toxicología de
Plaguicidas 4 (19): 21-34.
Badii, M. H. y S. Varela. 2008. Insecticidas
Organofosforados: Efectos sobre la Salud y el Ambiente. CULCyT. Toxicología de
Insecticidas. 5 (28): 5-17.
Begum, S.; S. I. Hassan, B. S. Siddiqui, F. Shaheen, M. N. Ghayur and
A. H. Gilani. 2002. Triterpenoids
from the leaves of Psidium guajava. Phytochemistry 61
(4): 399-403.
Camacho M., J.; P.
Güerere P. y M. Quirós de G. 2002. Insectos y ácaros del guayabo (Psidium guajava L.) en plantaciones
comerciales del estado Zulia, Venezuela. Rev. Fac. Agron. (LUZ) 19 (2):
140-148.
Cermeli, M. y F.
Geraud-Pouey. 1997. Capulinia sp
cercana a jaboticabae von Ihering
(Hemiptera: coccoidea, ericoccidea) nueva plaga del guayabo en Venezuela. Agronomía Tropical
47 (1): 125-126.
Chirinos, D. T.; F. Geraud-Pouey, L. Bastidas, M. García y Y. Sánchez.
2007. Efecto de algunos insecticidas sobre la mota blanca del guayabo, Capulinia sp. (Hemiptera: Eriococcidae).
Interciencia 32 (8): 547-553.
Chirinos-Torres, L.; F. Geraud-Pouey, D. Chirinos, C. Fernández, N.
Guerrero, M. Polanco, G. Fernández y R. Fuenmayor. 2000. Efecto de insecticidas
sobre Capulinia sp. cercana a jaboticabae von Ihering (Hemiptera:
Eriococcidae) y sus enemigos naturales en el municipio Mara, estado Zulia, Venezuela.
Bol Entomol Venez. 15 (1): 1-16.
Castro J., J. 2002.
Determinación, persistencia y distribución de insecticidas de uso agrícola en
el medio ambiente. Tesis Doctoral. Universidad Autónoma de Madrid. España. 176
p. http://jcastrojimenez.net/web_documents/PhD%20thesis%20JCJ.pdf (Consultad0
el 15 de Noviembre de 2010).
Conde Garcia, E.
A.; V. T. Nascimento and A. B. Santiago Santos. 2003. Inotropic effects of extracts of Psidium guajava L. (guava) leaves
on the guinea pig atrium. Braz J Med Biol Res. 36(5): 661-668.
Dale, W. E. 2007. Toxicología insecticidas.
Penetración residuos y su manejo, tolerancia, generalidades sobre metabolismo
insecticidas. Versión 01.T05. http://www.lamolina.edu.pe/profesores/wdale/
tox_insect/TOXICOLOG%CDA%20INSECTICIDAS.%20PENETRACI%D3N,%20RESIDUOS%20Y%20SU%20MANEJO,%20TOLERANCIA,%20%20GENERALIDADES%20SOBRE%20MET.pdf.
(Consultado el 15 de Noviembre de 2010).
Dow AgroSciences. 2003. LORSBAN 480 CE. Hoja de
manejo seguro. http://www.dowagro.com/ PublishedLiterature/dh_0047/0901b80380047281.pdf?filepath=mx/pdfs/noreg/013-20119.pdf&from
Page=GetDoc. (Consultado el 08 de Noviembre de 2010).
Ettiene, G.; S. Ortega,
D. Medina, J. Sepúlveda, I. Buscema and L. Sandoval. 2005. Persistence of diazinon,
malathion, and parathion in coriander (Coriandrum
sativum L.), cultivated in Barbacoas. Trop.
Agric. (Trinidad) 82 (4): 343-348.
Ettiene, G.; S. Ortega,
J. Sepúlveda, D. Medina, I. Buscema and L. Sandoval. 2006. Dissipation of
organophosphorus pesticides in green onion (Allium
fistulosum L.), cultivated in forced system called “Barbacoas”. Bull. Environ. Contam. Toxicol. 76: 415-421.
Ettiene, G.; P. García, R. Bauza, D. Medina y L. Sandoval. 2010.
Validación de un método para la determinación de insecticidas organofosforados
en hojas y tallos de guayabo (Psidium
guajava L.), usando extracción ultrasónica y limpieza en fase sólida. Rev.
Fac. Agron. (LUZ) 27 (1): 88-111.
FAO/OMS. CODEX ALIMENTARIUS. 1993. Residuos de Plaguicidas en Alimentos.
Programa conjunto FAO/OMS sobre Normas Alimentarias. Comisión del Codex
Alimentarius. Vol 2.
Geraud-Pouey, F.;
D. T. Chirinos y G. Romay. 2001. Efecto físico de las exfoliaciones de la
corteza del guayabo (Psidium guajava)
sobre Capulinia sp. cercana a jaboticabae von Ihering (Hemiptera:
Eriococcidae). Entomotropica 16 (1): 21-27.
Geraud-Pouey.
F. y D. Chirinos. 1999. Desarrollo poblacional de la mota blanca, Capulinia sp. (Hemiptera: Eriococcidae)
sobre tres especies de Psidium guajava
bajo condiciones de laboratorio. Rev.
Fac. Agron. (LUZ) 16 (Suplemento 1): 23-29.
Hyams, D. G. 2010.
CurveExpert software. http://www.curveexpert.net. (Consultado el 11 de
Noviembre de 2010).
Jaiarj, P.; P. Khoohaswan, Y. Wongkrajang, P. Peungvicha, P. Suriyawong,
M. L. Sumal Saraya and O. Ruangsomboon. 1999. Anticough and
antimicrobial activities of Psidium
guajava Linn. leaf extract. J. Ethnopharmacol. 67 (2): 203-212.
Khan, B. A. 2005. Studies on the residues of commonly used insecticides
on fruits and vegetables grown in NWFP-Pakistan. Thesis for the degree of
Doctor of Philosophy (Ph.D.) in Agriculture (Agricultural Chemistry). NWFP
Agricultural University Peshawar. Pakistan. 193 p.
Kumar Bhagobaty, R.; S. Ram Joshi and A. Malik. 2007. Microbial
degradation of organophosphorous pesticide: Chlorpyrifos (Mini-Review). The
Internet Journal of Microbiology. 4 (1). 13p.
Laguado, N.; E. Pérez y C. Alvarado. 1999.
Características físico-químicas y fisiológicas de frutos de guayaba de los
tipos Criolla Roja y San Miguel procedentes de dos plantaciones comerciales. Rev. Fac. Agron.
(LUZ) 16 (4): 382-397.
Lartiges, S. B. and P. P. Garrigues. 1995. Degradation kinetics of
organophosphorus and organonitrogen pesticides in different water under various
environmental conditions. Environ. Sci. Technol. 29: 1246-1254.
Liapis, K. S.; G. E. Miliadis and P. Aplada-Sarlis. 1994. Persistence of monocrotophos residues in
greenhouse tomatoes. Bull.
Environ. Contam. Toxicol. 53: 303-308.
Lozoya, X.; H. Reyes
Morales, M. A. Chávez Soto, M. C. Martínez García, Y. Soto González and S. V.
Doubova. 2002. Intestinal anti-spasmodic effect of a phytodrug of Psidium guajava folia in the treatment of acute diarrheic disease.
J. Ethnopharmacol. 83 (1-2): 19-24.
Lozoya, X.; M. Meckes, M. Abou-Zaid, J.
Tortoriello, C. Nozzolillo and J. T. Arnason. 1994. Quercetin glycosides in
Psidium guajava L. leaves and
determination of a spasmolytic principle. Arch Med Res. 25
(1): 11-15.
Lutterodt, G. D. and A. Maleque. 1988. Effects on mice locomotor
activity of a narcotic-like principle from Psidium
guajava leaves. J. Ethnopharmacol. 24
(2-3): 219-231.
Medina B., M. L. y F.
Pagano G. 2003. Caracterización de la
pulpa de guayaba (Psidium guajava L.) tipo "Criolla Roja". Rev.
Fac. Agron. (LUZ) 20 (1): 72-86.
Molero, T.; J. Molina y
A. Casassa-Padrón. 2003. Descripción morfológica de selecciones de Psidium guajava L. tolerantes y Psidium friedrichsthalianum (Berg.) Nied
resistente a Meloidogyne incognita en
el estado Zulia, Venezuela. Rev. Fac. Agron. (LUZ) 20 (4): 478-492.
Oh, W. K.; C. H. Lee, M. S. Lee, E. Y. Bae, C.
B. Sohn, H. Oh, B. Y. Kim and J. S. Ahn. 2005. Antidiabetic effects of extracts from Psidium
guajava. Journal of Ethnopharmacology 96 (3): 411-415.
Ojewole, J. A. O.
2005. Hypoglycaemic and hypotensive
effects of Psidium guajava Linn.
(Myrtaceae) leaf aqueous extract. Methods Find Exp
Clin Pharmacol. 27 (10): 689-695.
Pérez Gutiérrez, R. M.; S.
Mitchell and R. Vargas-Solis. 2008. Psidium guajava: A review of its
traditional uses, phytochemistry and pharmacology. Journal of
Ethnopharmacology. 117 (1): 1-27.
Rendiles O., E.; M.
Marín L.; C. Castro de R. y O. Ferrer M. 2004. Variación en la concentración
foliar del guayabo (Psidium guajava
L.) y su relación con el rendimiento del cultivo. Rev. Fac. Agron. (LUZ) 21
(1): 36-50.
Sánchez, J.; G.
Ettiene, I. Buscema y D. Medina. 2005. Persistencia de los insecticidas
organofosforados Malathion y Chlorpiryphos en guayaba (Psidium guajava L.). Rev. Fac. Agron. (LUZ) 22 (1): 62-71.
Sánchez-Urdaneta, A.
B.; C. Colmenares, B. Bracho, J. Ortega, G. Rivero, G. Gutiérrez y J. Paz.
2007. Caracterización morfológica del fruto en variantes de guayabo (Psidium guajava L.) en una finca del
municipio Mara, estado Zulia. Rev. Fac. Agron. (LUZ) 24 (2): 282-302.
Shaheen, H. M.; B. H. Ali, A. A. Alqarawi and
A. K. Bashir. 2000. Effect of
Psidium guajava leaves on some aspects of the
central nervous system in mice. Phytotherapy Research 14 (2): 107-111.
Vargas-Álvarez,
D.; M. Soto-Hernández, V. A. González-Hernández,
E. Mark Engleman y Á. Martínez-Garza. 2006. Cinética de acumulación
y distribución de flavonoides en guayaba (Psidium guajava L.).
AGROCIENCIA 40 (1): 109-115.
Página
diseñada por Prof. Jesús Rafael Méndez Natera
TABLA DE CONTENIDO DE LA REVISTA CIENTÍFICA UDO
AGRÍCOLA



