Revista
Científica UDO Agrícola Volumen 10. Número 1. Año 2010. Páginas: 133-140
Biorremediación de lodos petroquímicos mediante el uso de la
biota microbiana autóctona en un oxisol del municipio
Lagunillas del estado Zulia, Venezuela
Bioremediation of
petrochemicals sludges by native microflora
in an oxisol at the Lagunillas
Municipality, Zulia State, Venezuela
Iván
CHIRINOS ![]() ,
Miguel LARREAL y Jesús DIAZ
,
Miguel LARREAL y Jesús DIAZ
Departamento de Ingeniería Suelos y Agua. Facultad de
Agronomía. Universidad del Zulia. Maracaibo. Venezuela. E-mails:
ichirinos3@gmail.com y miguellarreal@cantv.net
![]() Autor para correspondencia
Autor para correspondencia
|
Recibido: 25/03/2009 |
Fin de arbitraje: 26/07/2009 |
Revisión recibida: 28/12/2010 |
Aceptado: 30/12/2010 |
RESUMEN
Con el fin de evaluar el
proceso de degradación de lodos petroquímicos ricos en hidrocarburos, se
realizó un trabajo de investigación en un oxisol del
municipio Lagunillas del estado Zulia. Se diseñaron parcelas de 1m x 2m, con
una separación entre parcela de 50 cm, y una altura de borde de 40 cm. El lodo
fue adicionado en dosis crecientes de 0,
5, 7,5 y 10 L*m-2 con
cuatro repeticiones. En este experimento no se aplicó ningún tipo de
fertilizante mineral ni orgánico. La población bacteriana total, Pseudomonas y Alcaligenes
fueron evaluadas mensualmente, hasta los 150 días. La degradación de los
hidrocarburos, tanto aromáticos como saturados o alifáticos, se evaluó a los
30, 120 y 300 días, determinando el % de
remoción de los mismos. Los resultados mostraron que las bacterias del
género Alcaligenes se desempeñaron mejor y se adaptaron de
manera aceptable ante las condiciones de alta concentración de hidrocarburos al
contrario de las Pseudomonas.
La degradación de hidrocarburos fue más rápida en aromáticos que en alifáticos,
debido a la volatilidad de los primeros.
Palabras clave: Biorremediación, hidrocarburo aromático, hidrocarburo
alifático
ABSTRACT
In order to evaluate degradation process of hydrocarbons in
petrochemicals sludge was made an investigation in an oxisol
soil at the Municipality Lagunillas at the Zulia
state. Designed plots with 1m x 2m as dimensions, 50cm between plots and 40 cm
of height. Sludge was aggregated in crescents doses (0.0, 5.0, 7.5 and 10.0 L*m-2)
and 4 replications. No mineral and organic fertilizer was used. The total
bacterial population, Pseudomonas and
Alcaligenes
was evaluated every month, till 150 days. Hydrocarbons degradation, aromatic
and aliphatic, was evaluated at 30, 120 and 300 days, determining their
degradation %. The results showed that the Alcaligenes bacterial was better to degrade hydrocarbons than the Pseudomonas bacteria. Aromatic
hydrocarbons degradation was more rapid than aliphatic hydrocarbons, due to the
aromatic volatility.
Key words: Bioremediation, aromatic hydrocarbon, aliphatic hydrocarbon
INTRODUCCIÓN
La sociedad actual, con un alto
desarrollo industrial y tecnológico para la obtención de bienes de consumo,
basado en un elevado uso de energía, genera una serie de desechos que impactan
de forma negativa sobre los ecosistemas: suelo, agua y aire.
En el caso particular del suelo, se puede
aprovechar la capacidad que este posee para procesar y degradar en su interior
compuestos de origen orgánico, a través de la biorremediación
(Benavides et al, 2006).
En nuestra región, las actividades
petrolera y petroquímica han generado durante décadas una gran cantidad de desechos ricos en hidrocarburos que de
alguna manera han impactado el medio ambiente, provocando deterioro de la
flora, fauna y en los recursos hídricos de las zonas adyacentes a los sitios de
explotación (Bracho et al, 2004).
Esto ha obligado al establecimiento en la región de Centros de Manejo de
Desechos, autorizados por el estado, bajo el cumplimiento de ciertos
requisitos, y que han obtenido resultados satisfactorios en tratamiento de
dichos de desechos, con un mínimo impacto al ecosistema, empleando la técnica
de biorremediación.
Estos Centros de Manejo de Desechos están
ubicados en zonas cuyos suelos poseen condiciones ideales para tal fin como
son: baja fertilidad y poca capacidad para el uso agrícola debido a la
condición de acidez que los caracteriza, típicos de las regiones tropicales con
períodos definidos de precipitación.
Estas condiciones de suelo mejoran con el
aporte de nutrimentos producto de la degradación de los componentes orgánicos
presentes en los desechos, como consecuencia de la actividad de microorganismos
del suelo que poseen la capacidad de desdoblar esos compuestos hasta sustancias
no tóxicas y asimilables por los organismos vivos del suelo (Siqueira, 1988).
Una manera de lograr dicha degradación,
bajo condiciones de clima tropical, sería el aprovechamiento de la microflora del suelo (Atlas y Bartha,
2002).
La biodegradación de hidrocarburos por
poblaciones nativas de microorganismos representa uno de los mecanismos
primarios por el cual los hidrocarburos contaminantes son eliminados del
ambiente. Las tasas de degradación bajo condiciones óptimas de laboratorio se
encuentran entre 2.500 – 100.000 g/m3/día, bajo condiciones de campo
(in situ) están en un orden de magnitud bajo, en el rango de 0,001-60 g/m3/día
(Atlas, 1981).
Esta tasa de descomposición microbiana de
compuestos orgánicos en los suelos es una función de varios factores:
disponibilidad de microorganismos; cantidad de estos microorganismos; grado de
actividad de estos, tipo de sustrato, concentración de los compuestos
orgánicos, etc.
Existen además factores muy importantes
como contenido de materia orgánica y arcilla, nivel de humedad, pH, aireación y
contenido de nutrimentos (Vecchioli et al, 1990).
La actividad y/o población de las
bacterias nativas puede ser incrementada por el suministro de nutrimentos
esenciales para el crecimiento de las mismas, además de la adición de cepas
bacterianas lo cual puede alterar drásticamente las características físicas y
químicas de las superficies sólidas, alterando
la capacidad de sorción de contaminantes por
la fase sólida del suelo (Siqueira, 1988).
La tasa de degradación de las moléculas
orgánicas depende básicamente de su estructura química. La biodegradabilidad
disminuye con la reducción del tamaño de la cadena; y las formas insaturadas
son menos biodegradables que las saturadas, de la misma forma que las cadenas
ramificadas en relación a las lineales y las cíclicas en relación a las
abiertas (Benavides et al, 2006).
El paso inicial en el proceso de
degradación de hidrocarburos por bacterias y hongos envuelve oxidación del
sustrato por oxigenasas, para lo cual se requiere
oxígeno molecular. La disponibilidad de oxígeno en suelos, sedimentos y acuíferos es frecuentemente limitante y
depende del tipo de suelo (Overcash y Pal, 1979).
La degradación anaeróbica de
hidrocarburos por microorganismos también ocurre, no obstante, es muy baja y su
significación ecológica puede ser menor (Atlas y Bartha,
2002).
Este estudio tuvo como objetivo evaluar
el proceso de biodegradación de lodo petroquímico in situ, aprovechando la microflora
nativa, y bajo condiciones naturales, sin fertilización, sin inoculación de
bacterias, con el fin de lograr la descontaminación de suelos sometidos a
derrames de productos hidrocarbonados.
MATERIALES Y
MÉTODOS
El experimento fue realizado empleando un
suelo Francoarcilloarenoso (FAa)
en el Centro de Manejo de Desechos de la Empresa Samfor
(Cuadro 1) ubicado en el Danto, municipio Lagunillas, del estado Zulia,
Venezuela, zona cuya precipitación media anual es de 650 mm.,
la evaporación acumulada de 2.383 mm., la temperatura
media anual de 28,3 ºC
y radiación solar cercana a 400 cal*m-2.
|
Cuadro 1.
Caracterización física y química del suelo bajo estudio. |
|||||||||||||||||||
|
Profundidad (cm) |
Arena (mm) |
|
Textura |
||||||||||||||||
|
Muy
Gruesa |
Gruesa |
Media |
Fina |
Muy Fina |
Partícula (%) |
||||||||||||||
|
2-1 |
1-0,5 |
0,5-0,25 |
0,25-0,1 |
0,1-0,05 |
Arena |
Limo |
Arcilla |
||||||||||||
|
0-24 |
0,20 |
3,17 |
9,73 |
21,36 |
14,36 |
49,04 |
23,46 |
27,50 |
FAa |
||||||||||
|
24-45 |
0,30 |
2,45 |
8,37 |
22,10 |
8,20 |
41,42 |
30,68 |
27,90 |
FAa |
||||||||||
|
45-75 |
0,41 |
1,57 |
7,50 |
22,69 |
4,83 |
37,00 |
34,30 |
28,70 |
FA |
||||||||||
|
75-124 |
0,43 |
1,63 |
7,15 |
20,93 |
3,38 |
33,52 |
36,18 |
30,30 |
FA |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
Profundidad (cm) |
pH H2O |
C E (dS m-1) |
Carbono orgánico (%) |
Fósforo disponible (ppm) Bray I |
Al (cmol*kg-1) |
||||||||||||||
|
1: 2 |
H2O 1: 2 |
||||||||||||||||||
|
0-24 |
4,33 |
0,19 |
1,01 |
3,39 |
1,44 |
||||||||||||||
|
24-45 |
4,37 |
0,12 |
0,26 |
1,45 |
1,80 |
||||||||||||||
|
45-75 |
4,31 |
0,19 |
0,20 |
1,64 |
1,62 |
||||||||||||||
|
75-124 |
4,15 |
0,16 |
0,12 |
1,33 |
1,80 |
||||||||||||||
|
|
|
|
|
|
|
||||||||||||||
|
Profundidad (cm) |
Bases intercambiables
(cmol*kg-1) |
H (cmol*kg-1) |
C.I.C |
C.I.C |
|||||||||||||||
|
NH4 AcO |
Suma |
||||||||||||||||||
|
Ca |
Mg |
Na |
K |
Total |
(cmol*kg-1)
(1) |
(cmol*kg-1)
(2) |
|||||||||||||
|
0-24 |
0,53 |
0,07 |
0,19 |
0,31 |
1,10 |
2,0 |
7,50 |
4,54 |
|||||||||||
|
24-45 |
0,50 |
0,10 |
0,15 |
0,11 |
0,86 |
2,0 |
5,62 |
4,66 |
|||||||||||
|
45-75 |
0,25 |
0,23 |
0,17 |
0,11 |
0,76 |
1,8 |
5,62 |
4,18 |
|||||||||||
|
75-124 |
0,28 |
0,12 |
0,15 |
0,18 |
0,73 |
2,0 |
5,00 |
4,53 |
|||||||||||
Se usó lodo petroquímico no tratado en
dosis crecientes de 0,0; 5,0; 7,5 y 10,0 L*m-2, dispuestos e
incorporados al suelo dentro de cuadrículas
de 2 m2 de superficie y
bordes de separación de 40 cm. de altura. La caracterización química del
lodo aparece en el cuadro 2. El carbono orgánico se determinó por el método de Walkley-Black, implica la oxidación de la materia orgánica
mediante digestión húmeda (120 ºC) con una mezcla de dicromato
de potasio y ácido sulfúrico. En síntesis, un volumen exacto de dicromato de potasio es agregado a una muestra de suelo finamente molida, el
cual oxida una parte del carbono orgánico (≈ 77% del carbono total) y el
excedente de dicromato de potasio es titulado con
sulfato ferroso. Luego, por diferencia se estima la cantidad de carbono
orgánico oxidado (Houba et al., 1995).
|
Cuadro 2. Caracterización
química del lodo empleado en el ensayo. |
|
|
Variable |
Valor |
|
pH |
7,9 |
|
Hidrocarburos aromáticos (mg/kg) |
3800 |
|
Hidrocarburos saturados(mg/kg) |
4200 |
|
Carbono orgánico (mg/kg) |
4312 |
|
Nitrógeno Total (mg/kg) |
1785 |
|
Fósforo (mg/Kg) |
587 |
Para la determinación del nitrógeno (N)
se realizó la digestión con ácido sulfúrico concentrado de una muestra en un bloque digestor a 375 ºC. El nitrógeno orgánico es transformado a nitrógeno
amoniacal por la acción del ácido sulfúrico y los catalizadores (sulfato de
potasio, sulfato de cobre y selenio). Luego se realizó una destilación en
presencia de hidróxido de sodio, recogiendo el destilado en una solución ácido
bórica indicadora y titulándola con un ácido de concentración conocida (ácido
sulfúrico o ácido clorhídrico) estandarizado (Bremner,
1996).
El fósforo disponible del suelo fue
extraído con una solución de bicarbonato de sodio (NaHCO3) 0,5 M,
con un pH 8,5. En suelos alcalinos, calcáreos y neutros que contienen fosfatos
de calcio, esta solución precipita el calcio como CaCO3, y
consecuentemente, se induce un aumento en la concentración de fósforo de la
solución de suelo. En suelos ácidos, conteniendo hierro y aluminio, la
concentración de fósforo en la solución del suelo aumenta a medida que el pH
aumenta. Este método es conocido como de Olsen (Houba et al.,
1995).
Luego de su disposición se procedió al
secado del mismo por efecto del aire (durante 10 días), se incorporó mediante
el uso de implementos sencillos como escardilla, pala, etc., a la aplicación de
riego con una frecuencia diaria y labranza manual mínima para facilitar la
aireación. La humedad se mantuvo cercana a capacidad de campo (CC) alrededor de
27%.
El método de biorremediación
usado en este experimento fue Landfarming que
consiste en: método in situ que
combina la utilización de los microorganismos autóctonos para degradar
compuestos orgánicos por el suelo y la aireación suministrada con el uso de
implementos manuales de labranza. (Benavides et al., 2006).
El muestreo de suelo se efectuó a los
30, 60,
90, 120 y 150
días para determinar el tamaño de la población bacteriana (heterótrofos
totales, Pseudomonas y
Alcaligenes), a través de la técnica de recuento en placas, empleado por Daniels en 1972. Por medio de esta técnica se determinó el
número de Unidades Formadoras de Colonia en muestras de 50 g de mezcla
suelo-lodo cada gramo de suelo (UFC*g-2), tomando 1 mL de cada fiola para realizar
diluciones seriadas en solución salina al 0,85% hasta 106 diluyendo
10 mL en 90 mL de agua y
sembrando 100 µL de cada dilución en placas de agar nutritivo. Los cuales se incubaron por 24 h a 30 ºC, después de lo cual se cuantificaron las colonias
bacterianas en las placas que contenían entre 30 y 300 colonias.
El muestreo de suelo para la
determinación de los hidrocarburos aromáticos y saturados se realizó a los 30
días de iniciado el ensayo, luego a los 120 días y el último muestreo se
efectuó a los 300 días, colocando la muestra en envases refrigerados para evitar
la pérdida de estos compuestos por volatilización y/o desnaturalización. El
análisis de las muestras se realizó mediante el método de extracción con
cloroformo y determinación gravimétrica del hidrocarburo extraído. La fracción
saturada y la aromática fueron diluidas
con hexano y benceno, respectivamente, la determinación se obtuvo por colorimetría para aromáticos y cromatografía
de gases para saturados, según metodología establecida por la Agencia Americana
de Protección Ambiental (Rudolph, et al., 2002). No se muestran las
concentraciones obtenidas por cromatografía debido a la prohibición expresa de
la empresa PEQUIVEN, por lo que sólo se expresan en porcentajes de remoción.
RESULTADOS Y
DISCUSIÓN
Población
bacteriana
Los resultados obtenidos en cuanto a
población bacteriana, parámetro importante en la evaluación de la biorremediación, muestran según la Figura 1, el
comportamiento como se describe a continuación:
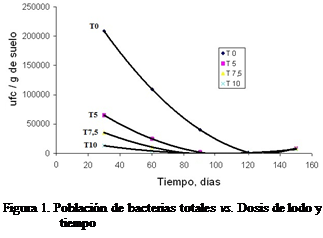
La máxima población de bacterias totales
presentes se alcanzó en la dosis de 0 L de lodo * m-2 de suelo y estuvo por encima de las 200.000
unidades formadoras de colonia * g-1 de suelo (UFC*g-1 de
suelo), seguida de las dosis de 5,0; 7,5
y 10,0 L*m-2.
Este resultado es lógico y tiene sentido
debido a que durante el proceso degradación del lodo (derivado de
hidrocarburos) resultan productos intermedios que poseen un alto grado de
toxicidad y provocan un impacto negativo en la biota microbiana del suelo,
disminuyendo su población por debajo de las 100.000 UFC*g-1 de suelo para la dosis 5
L*m-2 y por debajo de las 50.000 UFC*g-1 para las dosis
de 7,5 y 10 L*m-2.
Esto según Siqueira,
(1988), se explica por las diferentes transformaciones debido a las reacciones
químicas por las que pasan los compuestos orgánicos en el suelo, entre las
cuales se conocen: Conjugación: cuando el sustrato se torna más complejo por la
adición o acomplejamiento con
metabolitos microbianos, pudiéndose tornar más recalcitrante y más tóxico.
Activación: es la conversión, por acción enzimática, del sustrato no tóxico a
una molécula tóxica.
Dado que el ensayo fue realizado en un
suelo de reacción ácida (Cuadro 1), esto demuestra que además de los compuestos
tóxicos derivados de las reacciones de degradación inicial, se suma el efecto
limitante del factor pH, ya que la mayoría de los microorganismos,
especialmente las bacterias se ven limitadas y afectadas por la acidez del
suelo (Atlas y Bartha, 2002).
Por otro lado, es importante resaltar el
hecho de que la población bacteriana total, disminuye drásticamente para la
dosis 0 (cero) a pesar de no estar afectada por el lodo, lo cual tiene su
explicación en la falta de nutrimentos debido a que el ensayo se diseñó para
realizarse sin fertilización, y al disturbar el suelo dejándolo sin cubierta
vegetal, se afecta la condición original del mismo desmejorando su calidad como
sustrato, mermando la población bacteriana, acentuada a partir de los 60 días
de iniciado el experimento.
Entre los géneros de bacterias
específicas para degradar hidrocarburos se encuentra las Pseudomonas, cuya población tuvo un comportamiento similar a la población
total (Figura 2), disminuyendo su número a partir de los 30 días a niveles de
menos de 400 UFC*g-1 para la
dosis de 5 L*m-2 y menos de 200 UFC*g-1 para las dosis de
7,5 y 10 L*m-2.
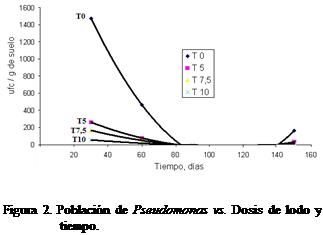
El género Pseudomonas, ha sido identificado
históricamente como degradador de gran cantidad de sustratos como el n-hexadecano, mineralización de compuestos alifáticos en
condiciones anaeróbicas y degradador de hidrocarburos aromáticos y poli
aromáticos, así como del pireno en estudios in vitro (Fan et al., 2000, Braker et al.,
1998). De acuerdo con los resultados de
la Figura 2, las Pseudomonas
representan un género susceptible a la acidez del sustrato y a la toxicidad
debida a la presencia de compuestos recalcitrantes como hidrocarburos
aromáticos y saturados contenidos en el lodo.
Comportamiento opuesto mostró el género Alcaligenes cuya población, aunque no muy numerosa,
registró un incremento a partir de los 60 días de iniciado el ensayo, en los
tratamientos de 5, 7,5 y 10 L*m-2,
no siendo así para el testigo o tratamiento 0 (Figura 3).
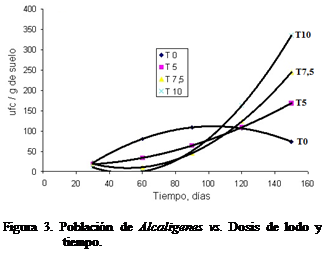
Según la Figura 3 a partir de los 120
días la población de Alcaligenes
registra un comportamiento exponencial, lo que hace pensar que manteniendo los
niveles de sustrato rico en carbono en el suelo, se alcanzaría en cualquier
momento una población elevada lo cual garantizaría la degradación de los
componentes orgánicos dispuestos en el suelo. Resultados similares obtuvieron
Díaz Borrego et al., (2005) quienes
trabajaron con Pseudomonas y Alcaligenes
en sustratos formados por Antraceno y Naftaleno, sin suelo.
Alcaligenes han
mostrado capacidad para degradar hidrocarburos de petróleo (TPH), lo que los
hace candidatos para el tratamiento de terrenos contaminados con estos
productos. Sin embrago, su poca abundancia se convierte en una desventaja para
su aplicación (Nannipieri et al., 2001). Este es un factor limitante y explica su baja
población en condiciones naturales del suelo (< 50 UFC*g-1 ).
Al analizar los resultados de poblaciones
bacterianas, totales, Pseudomonas y Alcaligenes,
la sumatoria de estos últimos géneros debería ser bastante aproximada a la
población total, en este caso, la población total es cientos de veces mayor que
dicha sumatoria. La explicación a este fenómeno radica en que cuando se
determina la población total de bacterias se incluyen géneros menos importantes
en la degradación de hidrocarburos que no son identificados o tomados en cuenta
tales como: Corynebacterium,
Bacillus, Acinetobacter, Rhodococcus, Agrobacterium, Flavobacterium, Micobacterium,
etc.
La disminución drástica de la población
bacteriana a partir de los 60 días de iniciado el ensayo se debe, además de los
aspectos mencionados anteriormente a la baja fertilidad del suelo y al
agotamiento de los pocos nutrimentos existentes en el mismo.
Según la figura 3 a partir de los 120
días la población de Alcaligenes
registra un comportamiento exponencial, lo que hace pensar que manteniendo los
niveles de sustrato rico en carbono en el suelo, se alcanzaría en cualquier
momento una población elevada lo cual garantizaría la degradación de los
componentes orgánicos dispuestos en el suelo. Resultados similares obtuvieron
Díaz Borrego et al., (2005) quienes
trabajaron con Pseudomonas y Alcaligenes
en sustratos formados por Antraceno y Naftaleno, sin suelo.
Remoción de
hidrocarburos aromáticos
En el cuadro 3 se observa que los
hidrocarburos aromáticos alcanzan el máximo de remoción o degradación (100%) al
cabo de 300 días con excepción del tratamiento
10 L*m-2 cuyo porcentaje de remoción o degradación, a pesar
de ser elevado, no alcanzó el 100%, lo cual hace pensar que se logrará en un
tiempo mayor, cercano a los 300 días. No se muestran las concentraciones
obtenidas por cromatografía y espectofotometría
debido a la prohibición expresa de la empresa PEQUIVEN, por lo que sólo se
expresan en porcentajes de remoción.
|
Cuadro 3. Degradación de
hidrocarburos aromáticos, expresados en porcentaje de remoción. |
|||
|
Tratamiento |
Tiempo (días) |
||
|
(L lodo*m-2) |
30 |
120 |
300 |
|
0,0 |
44 |
81 |
100 |
|
5,0 |
19 |
33 |
100 |
|
7,5 |
19 |
50 |
100 |
|
10,0 |
13 |
52 |
94 |
En el cuadro 3, se puede apreciar que el
tratamiento con 5 L lodo*m-2 tuvo un comportamiento irregular
considerando que la diferencia de remoción entre los 30 y 120 días no fue muy
marcada si se compara con el resto de los tratamientos.
Esto pudo deberse a múltiples factores,
entre ellos: efecto de una baja actividad microbiana durante ese período para
dicho tratamiento, efecto bordura, etc.
Orientados en el mismo objetivo, Bracho et al., (2004), aislaron 37 cepas bacterianas capaces de degradar hidrocarburos
aromáticos, entre ellas bacterias del género Pseudomonas y Alcaligenes, y lograron la degradación total de
hidrocarburos aromáticos policíclicos como el
naftaleno y el antraceno y en un 78,57% se degradó el fenantreno.
Por otro lado, Xiaojun
et al., (2008), trabajaron sobre degradación de hidrocarburos policíclicos
aromáticos en un suelo limoso (63% de limo), empleando combinaciones de hongos
y bacterias y poblaciones aisladas de bacterias, obteniendo mayor degradación
con el uso de bacterias, registrando un mayor % de degradación el benceno y el
antraceno (64,5% y 84,5% respectivamente).
Chang et
al., (2002) trabajaron en condiciones anaeróbicas en un suelo franco y
estudiaron la degradación de hidrocarburos aromáticos policíclicos
y lograron la degradación total del antraceno a los 35 días y a los 95 días se
degradaron totalmente los compuestos fenantreno, pireno y acenafteno.
Otro trabajo similar fue realizado por Rahman et al.,
(2002), basado en la biorremediación de un oxisol de la India contaminado por gasolina y emplearon
restos de cosecha como abono a fin de estimular a microflora
autóctona, sobre todo el género Pseudomona con tiempo de duración de 90 días en el que
lograron hasta 80 % de degradación de los componentes aromáticos en el suelo.
Remoción de
hidrocarburos saturados
Estos compuestos por ser de cadenas
abiertas no cíclicas son generalmente más fáciles de degradas que los
aromáticos (cíclicas). Sin embargo, el cuadro 4 muestra que al final del
experimento se alcanzó una degradación que varió entre 70 y 78 %.
A diferencia de los aromáticos, los
hidrocarburos saturados, en este caso no fueron degradados totalmente debido a
que ellos no tienen la propiedad de ser volátiles, característica de los
aromáticos que se ve acentuada y elevada en condiciones de altas temperaturas,
siendo este aspecto lo que explica el hecho de que los aromáticos fueron
degradados totalmente y los saturados no.
Díaz Borrego et al., (2005), estudiaron en condiciones de laboratorio, usando
bacterias del género Pseudomonas, Bacillus, etc, la
degradación de hidrocarburos saturados del petróleo, en medios y sustratos
minerales y obtuvieron que los hidrocarburos alifáticos o saturados fueron
degradados totalmente y los aromáticos apenas alcanzó un 12,5% de degradación y
los hidrocarburos totales un 40,5% de degradación.
En cuanto a la presencia de hidrocarburos
tanto aromáticos (Cuadro 3) y saturados o alifáticos (Cuadro 4) en el
tratamiento 0 L lodo*m-2, esto se debe al efecto de la
volatilización y/o infiltración en el caso de los aromáticos y a la
infiltración en el caso de los saturados.
|
Cuadro 4. Degradación de
hidrocarburos saturados o alifáticos, expresados en porcentaje de remoción. |
|||
|
Tratamiento |
Tiempo (días) |
||
|
(L lodo*m-2) |
30 |
120 |
300 |
|
0,0 |
22 |
43 |
73 |
|
5,0 |
12 |
27 |
78 |
|
7,5 |
21 |
29 |
72 |
|
10,0 |
22 |
26 |
70 |
CONCLUSIONES
·
La microflora autóctona del suelo poseen la capacidad de
biodegradación de de los compuestos hidrocarbonados
contenidos en los desechos de origen petroquímico.
·
El efecto de los
compuestos aromáticos y alifáticos sobre
la población de bacterias, se relaciona con el nivel de fertilidad y/o
disponibilidad de nutrimentos en suelo, además del pH,
factor que limita tanto la disponibilidad como la solubilidad de nutrimentos
y la actividad sobre todo de las bacterias, cuyo rango de pH para su adaptación
es reducido.
·
La población
total de bacterias se ve afectada
drásticamente a partir de los 60 días de iniciado el ensayo y es más marcado
cuanto mayor es la dosis de lodo petroquímico adicionado, el género Pseudomonas se
mostró muy sensible a la presencia de compuestos orgánicos de origen
petroquímico, siendo más afectado cuanto mayor fue la dosis de lodo adicionado,
el género Alcaligenes por
el contrario tuvo un comportamiento inverso a Pseudomonas y se adaptaron mejor
ante la presencia de contaminantes orgánicos y cuando disminuyó la población de
Pseudomonas,
la de Alcaligenes tendieron a incrementarse.
·
A partir de los
90 días, el aumento de la población de Alcaligenes fue directamente proporcional a la
dosis de lodo petroquímico, al contrario a lo observado en la población total
de bacterias y en el género Pseudomonas.
·
La degradación de
hidrocarburos aromáticos se logró totalmente a los 300 días de iniciado el
experimento, esta degradación en parte se debió a las pérdidas de los mismos en
forma volátil, dadas las condiciones de alta temperatura registradas en la zona
donde se realizó el experimento, a pesar de ser más fáciles de degradar los
hidrocarburos saturados o alifáticos que los aromáticos, con los alifáticos no
se logró la degradación total, debido a la característica de volatilidad de los
aromáticos.
LITERATURA CITADA
Atlas, R. M. 1981. Microbial degradation of petroleum hydrocarbons:
an environmental
perspective. Microbiol. Rev. 45: 180-209.
Atlas, R. M. y R. Bartha. 2002. Ecología microbiana y microbiología
ambiental. Ed. Addison Wesley. Madrid. 561 p.
Benavides, L. J.; G.
Quintero, V. A. Guevara, C. D. Jaimes, R. S.
Gutiérrez y G. J. Miranda. 2006. Biorremediación de
suelos contaminados con hidrocarburos derivados de petróleo. Nova 4 (5): 82-90.
Bracho, M.; D. Laugeny y S. Luz. 2004.
Degradación de hidrocarburos aromáticos por bacterias aisladas de suelos
contaminados con petróleo en el estado Zulia, Venezuela. Boletín del Centro de
Investigaciones Biológicas 38 (3): 15-22.
Braker, G.; A. Fesefeldt and K. P.
Witzel. 1998. Development of PCR primer systems for
amplification of nitrite reductase genes (nirK and nirS) to detect
denitrifying bacteria in environmental samples. Applied and Environmental
Microbiology 64 (10): 3769-3775.
Bremner, J. M. 1996. Nitrogen-Total.
p. 1085-1121. In Sparks, D.L. (ed.).
Methods of soil analysis. Part 3. Chemical methods. Soil Science Society of
America Book Series 5. Amer. Soc. of Agron, Madison,
Wisconsin.
Chang, B.; L. Shiung and S. Yuan. 2002. Anaerobic biodegradation of
polycyclic aromatic hydrocarbon in soil. Chemosphere 48: 717-724.
Daniels, S. L. 1972. The adsorption of microorganisms on surfaces: a
review. Dev. Ind. Microbiol.
13: 211-253.
Díaz Borrego, L.; J. Dupontt, L. Atencio, X. Montiel y
L. M. Soto Díaz. 2005. Crecimiento de Pseudomonas alcaligenes en antraceno y naftaleno por recuento en
placas y microscopía de epifluorescencia. Boletín
Centro de Investigaciones Biológicas 3 9(1): 1-12.
Fan, C.; X. Qing and J. Kuang. 2003. Aerobic denitrification of Pseudomona aeruginosa monitored by online NAD(P)H Fluorescence.
Applied and Environmental Microbiology 69 (11): 6715-6722.
Houba, V. J. G.; J. J. Van der Lee
and I. Novozamsky. 1995. Soil analysis procedures. Other procedures (Soil and Plant Análisis, part 5B). 6th edition. Series Syllabi.
Department of Soil Science and Plant Nutrition, Wageningen
Agricultural University 45 p.
Nannipieri, P.; J. Ascher,
M. Ceccherini, L. Landi, M.
Pietramellara and G. Resella.
2001. Microbial diversity and soil functions. European Journal Soil Science 54 (4): 655-670.
Overcash, M. and D. Pal. 1979. Design
of land treatment systems for industrial wastes. Theory and practice. Ann Arbor. Sci. Pub. Inc., p. 684.
Rahman, K. ; I. Banat and J. Thahira. 2002. Bioremediation of
gasoline contaminated soil by a bacterial consortium amended with poultry
litter, coir pith and rhamnolipid biosurfactant.
Bioresource Technology 81: 25-32.
Rudolph, A.; C. Franco, J. Becerra, A. Barros y R. Ahumada.
2002. Análisis de materia orgánica e
hidrocarburos aromáticos policíclicos en
sedimentos de Bahía Concepción, Chile. Boletín de la Sociedad Chilena de
Química 47 (4): 403-410.
Siqueira, J. 1988. Biotecnología do Solo. Editorial Ceres.
Brasil. 231 p.
Vecchioli, G.; M. T. Del Panno and M.
T. Painceira 1990. Use of selected autocthonous soil bacteria to enhance degradation of
hydrocarbons in soil. Environmental Pollution 67: 249-258.
Xiaojun, L. ; L. Peijun and L. Xin. 2008. Biodegradation of aged
polycyclic aromatic hydrocarbons (PAHs) by microbial consortia in soil and
slurry phases. Journal of Hazardous Materials 150: 21-26.
Página
diseñada por Prof. Jesús Rafael Méndez Natera
TABLA DE CONTENIDO DE LA REVISTA CIENTÍFICA UDO
AGRÍCOLA



